黄芪多糖缓解急性脑缺血再灌注损伤的氧化应激反应和免疫功能紊乱①
何 佳 鄢 波 宋晓征 伍雪英
(三六三医院神经内科,成都610041)
脑卒中是世界范围内常见的疾病之一,以高发病率、高死亡率、高致残率为主要特点,严重威胁人类生命与健康,其中缺血性脑卒中占80%以上[1]。缺血性脑卒中大脑供血主动脉发生狭窄或闭塞,导致脑组织急剧缺氧,引起局部组织缺血性坏死[2]。缺血后血流的再灌注可以挽救濒临梗死的神经细胞,但一些患者缺血再灌注会加重神经细胞的损伤[3]。近年来研究发现,脑缺血再灌注引起的损伤是一个复杂的病理生理过程,氧化应激反应和免疫功能紊乱是导致脑缺血性损伤的重要因素[4,5]。目前虽然对脑缺血的病理生理机制的研究已经取得重大进展,但治疗的方法和手段仍然有限。黄芪为豆科植物属蒙古黄芪、膜荚黄芪的干燥根,是历史悠久、应用广泛的传统补益中药[6]。黄芪的主要成分有黄芪多糖、黄芪皂苷、氨基酸等。黄芪多糖(Astragalus polysaccharide,AP)是黄芪的主要活性成分,具有广泛的药理活性。近年来的研究发现,黄芪多糖可以参与免疫调节,作为敏化剂参与2型糖尿病的治疗,具有抗病毒、抗衰老、抗肿瘤的作用[7-10]。黄芪多糖在急性脑缺血再灌注损伤中的相关研究很少出现。本研究利用大脑中动脉线栓法建立大鼠脑缺血再灌注损伤模型,探究黄芪多糖对急性脑缺血再灌注大鼠氧化应激反应和免疫功能的影响。
1 材料与方法
1.1实验动物及主要试剂 清洁级SD大鼠50只,雄性,体重250~300 g,由凯学生物科技(上海)有限公司提供。黄芪多糖(纯度>97%,CAS:89250-26-0)购自百灵威科技有限公司;HE染色试剂、Tunel染色试剂均购自碧云天;兔抗大鼠Bcl-2、BAX、GAPDH、NLRP3、ASC一抗购自Thermo Fisher Scientific;cleaved-caspase-1(p20)一抗和山羊抗兔二抗及显影液购自Abacam公司;ELISA检测试剂盒购自ED公司;谷胱甘肽(Glutathione,GSH)超 氧 化 物 歧 化 酶(Superoxide dismutase,SOD)和丙二醛(Malondialdehyde,MDA)检测试剂盒购自上海索莱宝生物科技有限公司。
1.2方法
1.2.1大鼠分组及急性脑缺血再灌注模型的构建 大鼠随机分成5组,健康大鼠对照组(Ctrl);模型组(I/R model);加药组按黄芪多糖的浓度分成3组,10 mg/kg组、20 mg/kg组、50 mg/kg组。模型组和加药组在实验前需要建立急性脑缺血再灌注大鼠模型。黄芪多糖采用腹腔注射给药,每天1次,连续6周。
大鼠建模前24 h禁食,不限制水摄入。用10%的水合氯酸腹腔注射对大鼠进行麻醉,大鼠采取仰卧位于实验台上固定。分离右侧颈总动脉、颈外动脉和颈内动脉;用动脉夹对颈外动脉进行结扎,在颈总动脉和颈内动脉分叉处剪小口,将线栓经切口处插入大脑中动脉始端。栓塞大脑中动脉,栓塞6 min后,缓慢拔出线栓,恢复血流灌注。缝合切口,对伤口进行消毒处理,涂抹抗生素预防感染。
1.2.2HE染色 断头处死大鼠,取脑,选取大鼠缺血局部区域的大脑皮层,用预冷的PBS清洗3次,清除杂质。用4%的多聚甲醛在4℃环境下固定2 h。预冷的PBS清洗3次,再用30%、50%、70%的酒精依次脱水处理。脱水后,进行石蜡包埋。切片后按照HE染色液说明书进行染色,于光镜下观察并拍照。
1.2.3Tunel染色 石蜡切片于二甲苯中脱蜡10 min,换新鲜的二甲苯,再脱蜡10 min。依次用无水乙醇、90%乙醇、70%乙醇、蒸馏水处理2 min。加蛋白酶K于室温下处理20 min,PBS洗3次,清除蛋白酶K。生物素标记后,样品的DAB显色。随机选取5个视野,在光镜下观察并拍照。使用软件Image J分析阳性细胞比率。
1.2.4免疫印迹法 用预冷的PBS将待检测的组织细胞清洗3次,分离细胞后,加入裂解液在冰上裂解30 min。于4℃冷冻离心机中15 000 r/min离心10 min,上清中即为总蛋白。BSA法测定蛋白浓度,制备蛋白样品,95℃金属浴10 min,15 000 r/min离心10 min。用12%的SDS-PAGE分离蛋白样品,将胶上的蛋白转移到PVDF膜上。5%的脱脂奶粉室温下封闭1 h,加入一抗4℃ 孵育过夜,TBST洗膜3次,加二抗在室温下孵育1 h。化学荧光试剂显影,使用Bio-Rad成像系统分析。
1.2.5氧化应激指标检测 取大鼠脑组织,冰上匀浆,4℃冷冻离心机中14 000 r/min离心30 min,取上清。按照试剂说明书,检测组织中GSH、MDA的含量和SOD的活力。
1.2.6ELISA检测炎症因子水平 断头取血,收集血液样品,2 500 r/min离心5 min,移液枪转移血清至新收集管。按照实际说明书进行操作,通过酶标仪检测血清中IL-6、TNF-α、IL-1β、IL-18的含量。
1.3统计学分析 用SPSS18.0软件对实验数据进行统计学分析,两两比较用独立的t检验。P<0.01认为差异具有统计学意义。
2 结果
2.1黄芪多糖缓解脑缺血再灌注对大鼠脑组织的损伤 通过HE染色观察不同浓度黄芪多糖对急性脑缺血再灌注损伤大鼠脑组织病变的影响。对照组组织切片中,细胞边界清晰,胞浆丰富,折光性强。与对照组相比较,I/R模型组大鼠脑组织出现严重的细胞排列紊乱,折光度差,出现大量空泡(图1);与I/R模型组相比较,加药各组大鼠脑组织病变出现缓解,且黄芪多糖浓度为50 mg/kg时,黄芪多糖对脑组织病变的缓解作用最明显(图1)。结果显示,黄芪多糖能够有效缓解急性脑缺血再灌注诱导的脑组织损伤。
2.2黄芪多糖抑制脑缺血再灌注诱导的细胞自噬 光学显微镜下观察健康组大鼠脑组织切片,未见Tunel染色阳性颗粒;I/R模型组与健康组相比较,核膜结构不明显、核固缩、有空泡,出现大量Tunel染色阳性颗粒,表明大鼠模型构建成功(图2,P<0.01);与模型组相比较,随着AP剂量由10、20、50 mg/kg 增加,各组Tunel染色阳性颗粒随AP浓度增加而减少(图2,P<0.01)。表明黄芪多糖能抑制急性脑缺血再灌注损伤对细胞凋亡的诱导。
2.3黄芪多糖抑制脑缺血再灌注损伤诱导的细胞凋亡 Western blot结果显示,模型组与对照组相比较,Bcl-2蛋白表达水平明显下降,BAX蛋白表达显著上升(图3,P<0.01);与模型组相比较,加药组Bcl-2的表达显著上调,BAX的表达显著下调,且随着黄芪多糖浓度的增加,变化越明显(图3,P<0.01)。结果提示黄芪多糖通过调控细胞凋亡相关蛋白的表达,抑制脑缺血再灌注损伤诱导的脑组织细胞凋亡。
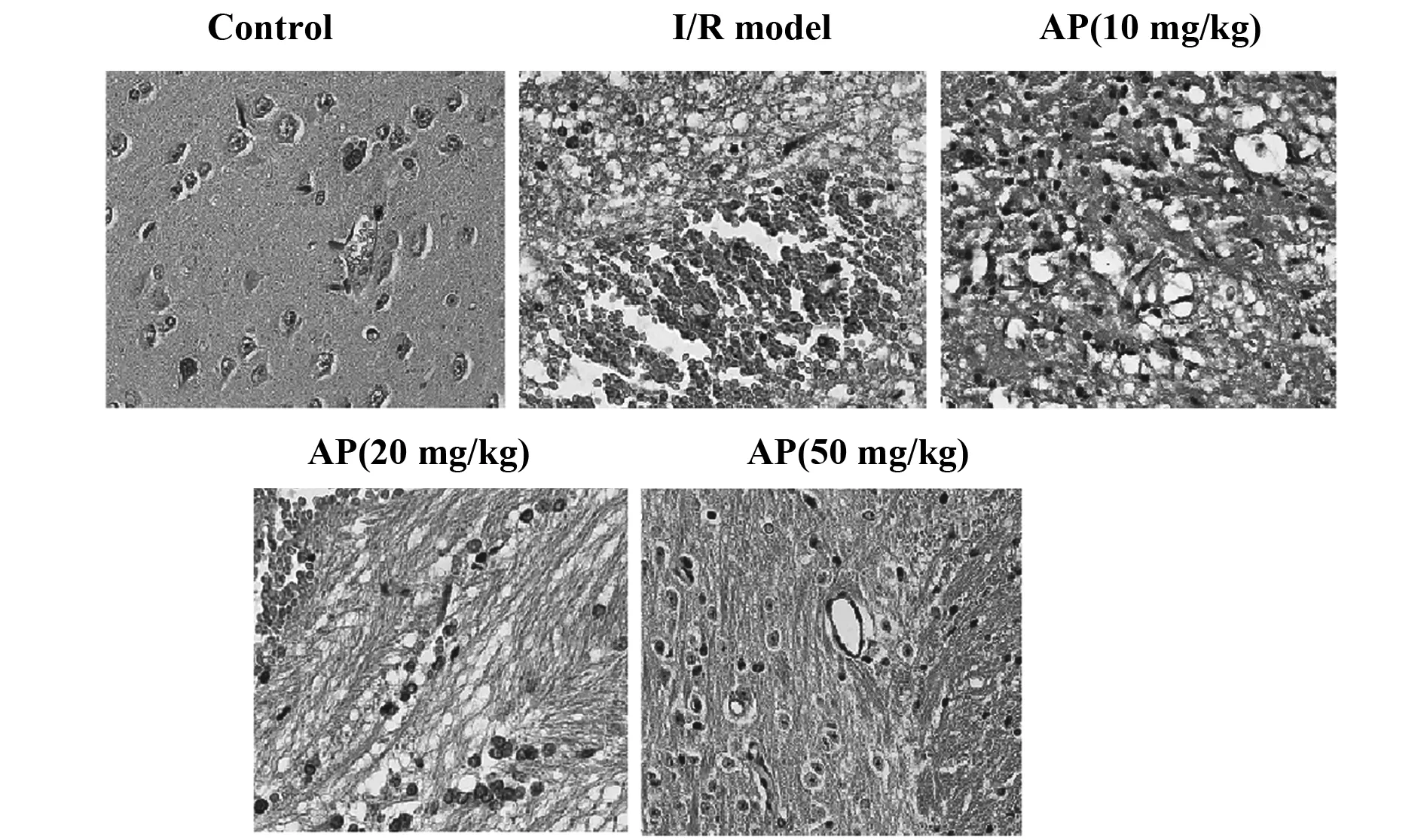
图1 HE染色检测脑组织病变(HE,×400)Fig.1 Brain tissue lesion was detected by HE staining(HE,×400)
2.4黄芪多糖抑制脑缺血再灌注诱导的氧化应激反应 模型组与对照组相比较,组织中GSH、SOD的含量明显下降,MDA的含量明显上升,表明缺血再灌注后大鼠脑组织脂质氧化反应强烈,伴随有脑组织自由基的聚集和抗氧化酶活性下降(图4,P<0.01);加药组与模型组相比较,随着AP浓度的增加,GSH和SOD的浓度逐渐上升,而MDA的浓度逐渐下降(图4,P<0.01)。以上结果表明,黄芪多糖能抑制脑缺血再灌注诱导的氧化应激反应。
2.5黄芪多糖减弱脑缺血再灌注诱导的炎症反应 通过ELISA检测大鼠血液中炎症因子IL-6、TNF-α、IL-1β、IL-18的含量,分析黄芪多糖对急性脑缺血再灌注损伤诱导的炎症反应的影响。实验结果显示,模型组与对照组相比较,大鼠血液中IL-6、TNF-α、IL-1β、IL-18的含量显著上升(图5,P<0.01);
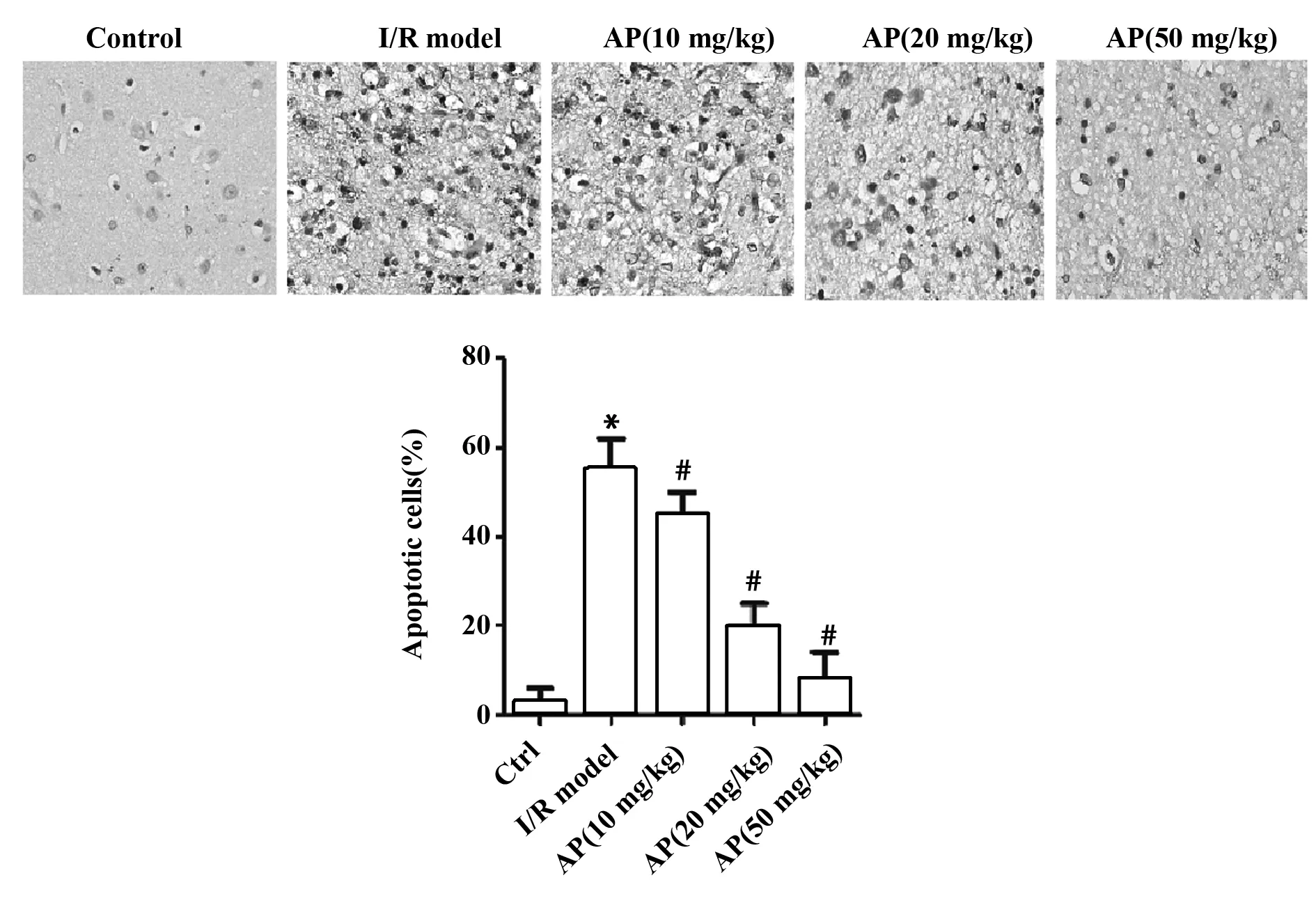
图2 Tunel检测黄芪多糖对缺血再灌注大鼠脑组织细胞凋亡的影响(×400)Fig.2 Effect of astragalus polysaccharide on apoptosis of brain tissue cells in rats with ischemia reperfusion were detected by Tunel(×400)Note:*.P<0.01 compared with control group;#.P<0.01 compared with model group.

图3 蛋白质印迹检测凋亡相关蛋白的表达Fig.3 Expression level of apoptosis related protein was detected by Western blotNote:*.P<0.01 compared with control group;#.P<0.01 compared with model group.
加药组与模型组相比较,发现大鼠血液中炎症因子IL-6、TNF-α、IL-1β、IL-18的浓度随着AP浓度的增加而降低(图5,P<0.01)。实验结果表明,黄芪多糖减弱急性脑缺血再灌注诱导的炎症反应。
2.6黄芪多糖对炎症小体相关蛋白表达的影响 蛋白印迹检测炎症小体相关蛋白的表达,结果显示,与对照组相比较,模型组NLRP3、ASC、cl-caspase-1的蛋白表达水平明显上升(图6,P<0.01);加药组与模型组相比较, NLRP3、ASC、 cl-caspase-1的蛋白表达水平随着黄芪多糖浓度的增加而逐渐降低,呈现负相关的关系(图6,P<0.01)。结果表明,黄芪多糖下调NLRP3、ASC和cl-caspase-1的表达,抑制炎症小体的形成。

图4 试剂盒检测氧化应激相关指标Fig.4 Oxidative stress indicator was detected by KitNote:*.P<0.01 compared with control group;#.P<0.01 compared with model group.
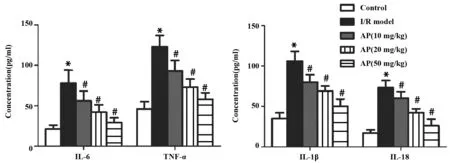
图5 ELISA检测大鼠血清中炎症因子水平Fig.5 Level of inflammatory factor were detected by ELISANote:*.P<0.05 compared with control group;#.P<0.05 compared with model group.

图6 蛋白印迹检测炎症相关蛋白的表达Fig.6 Expression level of inflammation related proteins were detected by Western blotNote:*.P<0.01 compared with control group;#.P<0.01 compared with model group.
3 讨论
缺血再灌注损伤是器官移植、心胸外科、血管外科和普通外科手术的主要挑战。缺血性器官内代谢供应和需求的不平衡导致了严重的组织缺氧和微血管功能障碍。急性脑缺血再灌注损伤的病理和生理机制相当复杂。之前的研究发现,急性脑缺血再灌注会刺激局部脑组织释放出大量的氧自由基,诱导氧化应激和炎症反应的发生从而加重对神经的损伤[11]。除了造成神经损伤外,氧自由基还会影响血管内皮延伸和神经组织的修复。与前人研究一致,本文在构建大鼠模型后,HE染色检测大鼠急性脑缺血再灌注损伤区域,发现脑组织出现严重的病变。研究表明黄芪多糖能缓解急性脑缺血再灌注诱导的大鼠脑组织病变。
氧化应激为机体内氧化系统失衡,造成体内生物大分子损伤,诱导细胞凋亡。细胞凋亡指生理条件下机体受刺激后,在一系列基因的参与下,细胞自主有序的程序性死亡[12]。许多研究发现,黄芪多糖能抑制细胞凋亡的发生,如Zhang等[13]的研究发现,黄芪多糖通过积累Nrf1抑制人心肌细胞的凋亡;Yin等[14]发现黄芪多糖通过调控mTOR信号通路抑制细胞自噬,通过调控caspase-3依赖的信号通路抑制自噬。与上述研究一致,本文研究发现黄芪多糖能有效抑制大鼠急性脑缺血再灌注损伤诱导的细胞凋亡。
脑缺血再灌注引起Bcl-2、caspase、Bax、P53等高度保守基因的激活、表达及调控是细胞凋亡启动的关键[15]。其中Bcl-2和Bax通过形成同源或异源二聚体发挥作用[16,17]。本文研究结果显示,模型组大鼠组织中Bcl-2表达显著下调,Bax表达显著上调。观察给药组可以发现,随着黄芪多糖给药浓度的增加,Bcl-2表达逐渐升高,而Bax的表达逐渐降低。Xie等[18]的研究发现,黄芪多糖通过下调Bax蛋白水平、上调Bcl-2蛋白,保护人心脏微血管内皮细胞免受缺氧/再氧化损伤。Bcl-2能有效降低线粒体外膜的通透性,抑制细胞色素c从线粒体释放到细胞质,从而抑制凋亡的发生[19]。而Bax通过抑制Bcl-2的活性,促进凋亡的发生。在细胞凋亡发生过程中,Bcl-2表达下调、Bax表达上调,综合实验结果表明黄芪多糖抑制急性脑缺血再灌注大鼠脑组织细胞凋亡。SOD活性和GSH、MDA的含量是反映机体氧化水平的可靠指标,能间接反映缺血再灌注大鼠脑组织的损伤程度[20,21]。大量的研究发现,黄芪多糖可以影响SOD的活性和GSH、MDA的含量。如Zhong等[22]研究发现,黄芪多糖通过减少血管活性物质的产生,减少氧化应激损伤,增加SOD的含量,减少MDA的产生,改善血流性能和微循环灌注,从而减轻严重烫伤兔心肌的损伤。实验结果显示,黄芪多糖作用于模型鼠后,缺血区域组织中SOD、GSH的含量明显上升,MDA的含量明显降低。SOD催化体内超氧自由基的歧化反应,而GSH是重要的抗氧化剂和氧自由基清除剂。表明黄芪多糖增强模型鼠清除氧自由基的能力和抗氧化能力,降低氧自由基对DNA和细胞的损伤。
当机体出现病变时,常常伴随着炎症反应。很多研究表明,黄芪多糖具有免疫调节作用。如Zhou等[23]发现,黄芪多糖可以抑制肺癌细胞,降低模型小鼠血液中IL-6、TNF-α的含量。如Xie等[24]研究发现,黄芪多糖通过NF-κB细胞信号通路,使细胞免受镉诱导的毒性伤害,文中指出黄芪多糖能降低IL-6、TNF-α、IL-1β等炎性因子的含量。Lv等[25]发现,黄芪多糖通过下调PKC-α-ERK1/2-NF-κB信号通路降低IL-6、TNF-α的含量。与前人研究一致,本文研究发现,黄芪多糖能缓解脑缺血再灌注诱导的免疫紊乱。
炎性体是由多种蛋白组成的复合体,具有调节炎性因子分泌和释放的作用[26]。NLRP3炎性体由NLRP3、ASC和cl-caspase-1组成。当NLRP3高表达或被激活时,加工剪切炎性因子前体,形成成熟的炎性因子,进而产生一系列的反应[27]。Tian等[28]发现,黄芪多糖能下调NLRP3的表达,减少炎症体的形成,进而减弱小鼠结肠炎症反应。本研究发现,黄芪多糖能抑制NLRP3炎性小体的活化。NLRP3炎症小体活化后,成熟的cl-caspase-1降解IL-1β和IL-18前体,促进炎症反应。研究发现活性氧的产生能激活NLRP3炎性小体。黄芪多糖抑制模型鼠氧化应激反应,可能与NLRP3炎性小体的激活相关,但具体的作用机制需要深入研究。
在急性脑缺血再灌注损伤大鼠中,黄芪多糖可以改善脑组织病变;上调Bcl-2蛋白,下调BAX蛋白,抑制细胞自噬;提高SOD的活性,增加GSH的含量,降低MDA的含量;降低血液IL-6、TNF-α、IL-1β、IL-18的含量;下调NLRP3、ASC、cl-caspase-1蛋白表达。综上所述,黄芪多糖能缓解大鼠急性脑缺血再灌注损伤引起的氧化应激反应和免疫功能紊乱。下一步计划研究黄芪多糖对急性脑缺血再灌注损伤产生缓解作用的相关分子机制。

