高铝暴露通过PI3K信号通路致大鼠糖耐量异常的作用及机制
杨大伟 韦喜 黄庆 何明杰 王民登 吴标良
(右江民族医学院附属医院内分泌科,广西 百色 533000)
环境因素与糖尿病的发病密切相关〔1〕。Levine等〔2〕报道,铝元素在人体组织中蓄积到一定程度后,会增加糖尿病发生的危险度,但未能进一步阐明其机制。Obukhova等〔3〕对396例铝厂工人定期体检结果进行分析,发现铝产业工人2型糖尿病的发病率较正常人群升高,并建议有必要对铝产业工人实施保护措施。铝暴露与糖耐量异常密切相关,但机制仍不清楚。本研究拟观察高铝暴露对大鼠糖耐量及磷脂酰肌醇3-激酶(PI3K)信号通路相关蛋白表达水平变化,探讨高铝暴露对糖耐量异常的影响及机制。
1 材料与方法
1.1实验动物及试剂 Wistar大鼠(雌雄各半)购于右江民族医学院实验中心动物房(CL级,动物许可证号:syxk桂2011-0010),体重250~300 g。氯化铝粉购自西安化工石。抗胰岛素受体底物(IRS)1抗体(ab52167)、抗胰岛素受体(IR)-β抗体〔C18C4〕(ab69508)购于ABCAM(英国),Phospho-IRS-1(Ser307)抗体#2381购于CST1,人短效胰岛素(优泌林R)购于礼来公司(美国)。本研究符合本院实验动物伦理委员会标准。
1.2动物分组及造模 将大鼠随机分为高铅暴露组和对照组,每组30只,根据参考文献〔4〕,制作高铝暴露条件。高铝暴露组使用三氯化铝40 mg/kg,1次/d,尾静脉注射;对照组从尾静脉注射生理盐水3 ml/kg,1 次/d,同步实验,连续注射7 d。造模过程中,对照组死亡1只(可能与注射生理盐水速度过快有关),高铝暴露组死亡2只(可能与注射三氯化铝有关),已根据实验前设定补充入组,最终实验例数仍为每组30只。
1.3口服葡萄糖耐量试验(OGTT) 随机每组抽取8只大鼠,取20%的葡萄糖溶液比例按10 ml/kg将禁食12 h的大鼠经灌胃给药。于实验开始后0、30、60、120 min尾静脉取血1次,约10 μl,使用罗氏血糖仪进行血糖测定,并计算血糖曲线下面积(AUC)。葡萄糖AUC=1/4(0 min血糖 +30 min血糖)+1/4(30 min血糖 +60 min血糖)+1/2(60 min血糖+120 min血糖)。
1.4高胰岛素正葡萄糖钳夹(HECT)试验 随机抽取两组各8只大鼠,实验参考Kraegen等〔5〕的方法。实验前禁食12 h。将大鼠单独置于可自由活动小铁笼内,颈动、静脉导管分别与采血延长管和输液管连接,整个实验过程中保持安静,尽量减少环境干扰。待大鼠适应新环境后开始从颈动脉导管采血测基础血糖值和胰岛素值。经颈静脉注射重组人胰岛素(优泌林R)10 mU/(kg·min),每5 min取颈动脉血测定全血血糖,如血糖低于5.0 mmol/L后开始同时经颈静脉输入20%葡萄糖溶液,继续每5 min使用罗氏血糖仪测定血糖,并据血糖值调整葡萄糖输注率(GIR),将血糖维持在4.8~5.2 mmol/L,连续3次均在上述范围时,提示钳夹成功,进入稳态。以稳定时5次GIR的平均值评价胰岛素敏感性。
1.5Western印迹法测定IR-β、IRS-1及IRS-1 Ser307磷酸化蛋白 提取小鼠肝脏组织,裂解、离心、分装以备用,十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白,半干法转膜,加入Western封闭液,室温下封闭1 h,将抗IR、IRS-1、IRS-1 Ser307磷酸化及抗β-actin抗体按说明书稀释至合适浓度,进行一抗孵育,4℃冰箱中摇床上过夜,加入羊抗小鼠二抗抗体,室温下摇床上孵育1 h,化学发光,显影、定影。用高清扫描仪扫描胶片,然后使用ImageJ软件半定量法分析目标带净光密度值(以特异性条带浓度与面积的乘积为有效值,反映蛋白表达水平)。
1.6统计学方法 采用SPSS13.0软件行t检验。
2 结 果
2.1OGTT结果 与对照组相比,高铝暴露组30、60、120 min血糖水平明显高于对照组(P<0.01),AUC显著高于对照组(P<0.05),见表1。
2.2HECT试验结果 与对照组〔(11.80±1.80)mg/min〕相比,高铝暴露组外周组织GIR〔(3.80±0.70)mg/min〕明显降低(P<0.01)。
2.3Western印迹检测结果 与对照组相比,高铝暴露组肝脏中IR-β、IRS-1表达显著下降,IRS-1 ser307表达显著升高(P<0.05)。见表2,图1。

表1 两组血糖水平及AUC比较
与对照组比较:1)P<0.01;下表同

表2 两组肝脏组织中IR-β、IRS-1及IRS-1 Ser307的相对光密度值比较
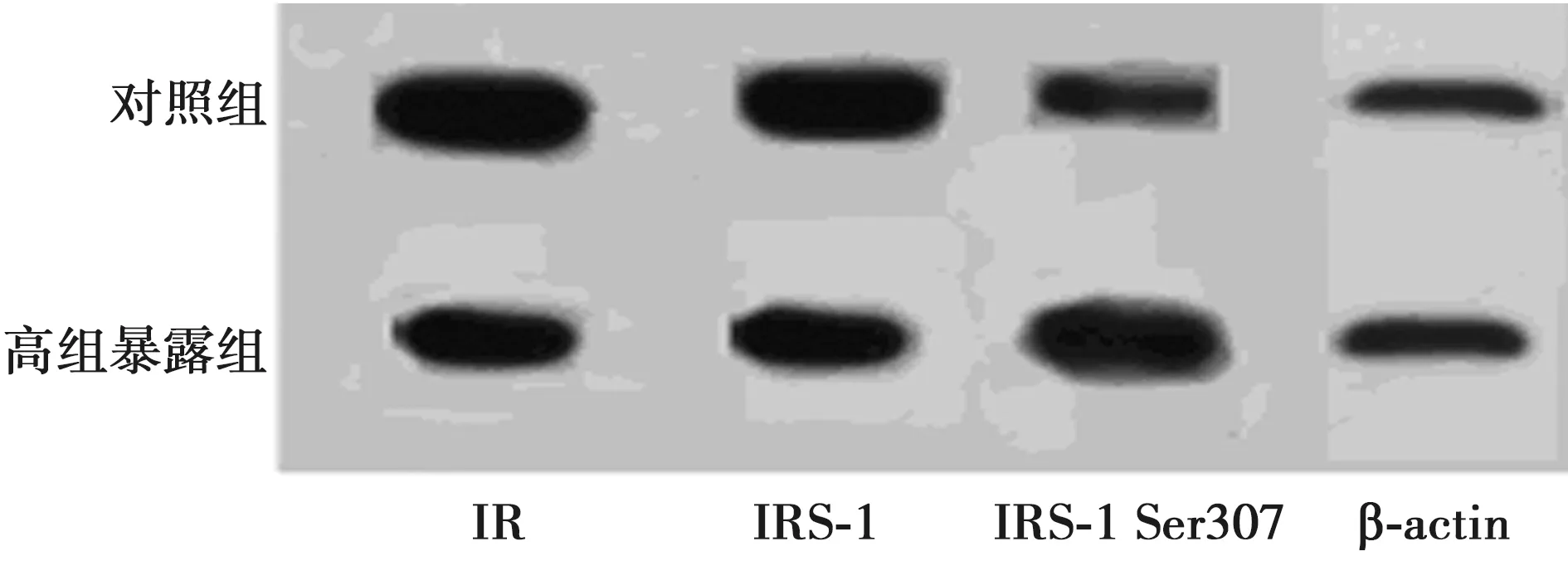
图1 两组肝脏组织中IR-β、IRS-1及IRS-1 Ser307的表达
3 讨 论
糖尿病早期表现主要为糖耐量异常,本研究表明,在高铝暴露后,大鼠OGTT中表现出了糖耐量减低的情况。糖耐量异常的影响因素非常多,机制十分复杂,但其中最重要的是胰岛素抵抗。
胰岛素抵抗与PI3K信号转导通路密切相关。PI3K信号通路中有几个重要组成部分:IR、IRS、葡萄糖转运体蛋白等。IR是由位于人类基因组19 P13.3~13.2区的基因所编码。目前已发现50种以上IR的点状突变或片段缺失,与严重的胰岛素抵抗发生有关〔6〕。IRS主要包括IRS-1和IRS-2。IRS-1是一种受体信号传导蛋白,主要分布在肌肉、肝脏、脂肪等胰岛素敏感组织内。IRS-1的表达不足和磷酸化的异常均可导致胰岛素结合后不能有效地转运葡萄糖,从而引起胰岛素抵抗〔7,8〕。另外IRS-1磷酸化在胰岛素抵抗的发生过程中起十分重要的作用。目前有研究表明〔9,10〕,2型糖尿病患者脂肪细胞InR与IRS-1的结合是正常的,但IRS-1的酪氨酸磷酸化水平低于正常人,而其丝氨酸磷酸化的水平会高于正常人,起负反馈调节作用。胰岛素抵抗患者骨骼肌细胞IRS-1酪氨酸磷酸化水平较正常人降低,同时IRS-1含量也下降。有研究表明,敲除IRS-1基因而保留IRS-2基因的大鼠仅出现胰岛素抵抗,但其胰岛β细胞胰岛素的分泌会代偿性增加,未出现糖尿病;而敲除IRS-2保留IRS-1的大鼠则因未出现β细胞的代偿性分泌而更早地出现了糖尿病〔11,12〕。
胰岛素的跨膜信号转导需要胰岛素与细胞膜表面的IR结合,IR会使自身β亚基膜内部分的酪氨酸残基磷酸化,提高其酪氨酸蛋白激酶活性,并进一步使其膜内IRS-1的酪氨酸残基磷酸化。IRS-1 Ser307的主要作用为对胰岛素生物效应起反馈调节。当IRS-1 Ser307被磷酸化后,IRS-1酪氨酸磷酸化水平就会被抑制,胰岛素信号传导就会减弱,就会导致胰岛素抵抗。本研究表明,高铝暴露导致大鼠糖耐量异常的主要原因可能是高铝暴露导致IR-β、IRS-1蛋白水平下降,影响胰岛素信号的跨膜转导,同时IRS-1 Ser307磷酸化的增高负反馈抑制了IRS-1的作用,从而使葡萄糖转运障碍,出现糖耐量异常。综上,高铝暴露可诱导大鼠糖耐量异常发生,其机制可能与PI3K通路受抑制有关。

