铁皮石斛热激转录因子(Hsf)基因家族鉴定及生物信息学分析
韩利红 刘潮 张维维 李发 邓发虎 阮子恒

摘要:【目的】鑒定铁皮石斛热激转录因子(Hsf)基因家族成员,并进行生物信息学分析,为深入研究该家族在铁皮石斛热应激响应中的调控机制提供理论参考。【方法】以拟南芥和水稻Hsf蛋白氨基酸序列为参考序列,在铁皮石斛蛋白数据中搜索其同源蛋白序列,利用SMART和Pfam数据库鉴定出其Hsf基因家族成员。利用生物信息学方法对铁皮石斛Hsf基因家族组成、基因结构、启动子区顺式作用元件及其编码蛋白结构域和进化关系等进行分析。【结果】共鉴定获得23个铁皮石斛Hsf基因家族成员,编码氨基酸数量为132~514个,平均343个,多数属于酸性蛋白和亲水性蛋白,可分为HsfA、HsfB和HsfC组,其中HsfA组成员13个、HsfB组成员9个、HsfC组成员1个。除DoHsfA3仅包含motif 1和motif 2外,其他HsfA组蛋白均含有motif 1~motif 5,HsfB和HsfC组蛋白均缺少motif 5。铁皮石斛Hsf蛋白缺少A9、B3、B5和C1亚类成员,与同属于单子叶兰科植物的小兰屿蝴蝶兰Hsf蛋白亲缘关系最近。HsfA组成员包含完整的HSF功能域和卷曲螺旋(CC)功能域,HsfB和HsfC组成员缺少或含不完整的CC功能域。DoHsfA1A蛋白具有保守的丝氨酸—苯丙氨酸—缬氨酸—精氨酸—谷氨酰胺序列。铁皮石斛Hsf基因启动子区含有大量激素响应、胁迫响应和生长相关元件。【结论】铁皮石斛Hsf基因家族成员进化较保守,其生物学功能存在明显物种特异性,进化关系较复杂,推测其在不同的非生物胁迫和植物激素信号途径中发挥潜在“节点”作用。
关键词: 铁皮石斛;热激转录因子(Hsf);基因家族;系统发育进化树;胁迫;顺式作用元件
中图分类号: S567.239 文献标志码: A 文章编号:2095-1191(2019)04-0677-08
Abstract:【Objective】In this study,gene family members of heat shock transcription factors(Hsf) in Dendrobium officinale were identified and bioinformatics analysis was conducted. It provided reference for studying the regulation me-chanism of this family in response of D. officinale to heat stress. 【Method】The amino acid sequences of Hsf protein in Arabidopsis thaliana and rice were as reference sequence,the homologous protein sequence was searched in D. officinale protein database,and the Hsf gene family members were identified by SMART and Pfam database. The member composition,gene structure,cis-acting elements of gene promoter, protein functional domain and evolution of D. officinale Hsf family were analyzed by bioinformatics methods. 【Result】A total of 23 Hsf gene family members were identified in D. officinale,the number of coding amino acids ranged from 132 to 514,with an average of 343,and most of them belonged to acidic and hydrophilic proteins. The proteins were divided into HsfA,HsfB and HsfC groups,members of each group were thirteen,nine and one,respectively. All HsfA group proteins contained motif 1-motif 5,except DoHsfA3 only contained motif 1 and motif 2. Proteins in HsfB and HsfC groups all lacked motif 5. D. officinale Hsf protein lacked members belonging to A9, B3, B5 and C1 subclasses. Their genetic relationship was close to Hsf protein of Phalaenopsis equestris belonging to monocotyledon Orchidaceae. HsfA group members included complete HSF domain and coiled helix(CC) domain,while the HsfB and HsfC groups contained incomplete or missing CC domain. DoHsfA1A protein had conservative serine-phenylalanine-valine-arginine-glutamine sequence and Lys80 residues. The promoter region of D. officinale Hsf genes contained a large number of hormone response, stress response and growth related elements. 【Conclusion】These results indicate that D. officinale Hsf gene family members are conservative in evolution,with obvious species specificity in function and complex evolutionary relationship. It is speculated that they play a potential node role in different abiotic stresses and plant hormone signaling pathways.
Key words: Dendrobium officinale; heat shock transcription factor(Hsf); gene family; phylogenetic tree; stress;cis-acting element
0 引言
【研究意义】铁皮石斛(Dendrobium officinale)为兰科(Orchidaceae)石斛属(Dendrobium)多年生草本植物,适宜生长于凉爽、湿润、半阴湿的环境中,生长速度缓慢,对生长环境和气候条件要求较苛刻,其茎可入药,具有滋阴明目、润肺益肾的功效,市场前景较好(蒋素华等,2017;冼康华等,2017;江爱明等,2018;曾贞等,2018)。植物在整个生命周期需应对多种生物和非生物胁迫而发生热应激响应,从而产生热激蛋白(Heat shock proteins,Hsp)等响应分子,该蛋白在植物细胞修复、蛋白折叠和降解及信号转导过程中发挥重要作用(Al-Whaibi,2011)。在该响应过程中,热激转录因子(Heat shock transcription factors,Hsf)是主要的调控因子,通过识别保守的热应激元件直接激活Hsp的表达(陈晓军等,2006;王海波等,2016)。研究铁皮石斛Hsf蛋白对探究铁皮石斛的应激反应机制具有重要意义。【前人研究进展】有关铁皮石斛的研究主要集中在栽培技术、有效成分含量及产品开发等方面(Huang et al.,2016;Zhang et al.,2017)。随着铁皮石斛基因组数据的公布,对铁皮石斛分子生物学方面的研究逐渐增多(Zhang et al.,2016;Wang et al.,2018;Yu et al.,2018),但对Hsf蛋白家族研究主要集中于拟南芥(Guo et al.,2008)、水稻(Guo et al.,2008)、大豆(Scharf et al.,2012)、大白菜(Song et al.,2014)、辣椒(Guo et al.,2015)、梨(Qiao et al.,2015)、杨树(Zhang et al.,2015)等植物,其原因是这些植物基因组数据公布相对较早,为该家族的研究提供了条件。目前,对植物细胞的应激反应系统已有了深入了解,且研究发现,热应激可诱导Hsp蛋白家族持续表达,但Hsf蛋白可抑制Hsp基因的转录(Pratt et al.,2010)。典型的植物Hsf蛋白具有DNA结合功能域(DBD)、寡聚化功能域(OD)、核定位信号(NLS)和核输出信号(NES),其中DBD位于Hsf蛋白的N端,由H1、H2和H3等3个α螺旋和1个β片层组成(Schultheiss et al.,1996),可特异性识别热激响应元件(5'-AGAA nnTTCT-3')(Åkerfelt et al.,2010)。根据OD序列的特异性,可将Hsf分为HsfA、HsfB和HsfC 3组,不同植物中Hsf的数量及各组组成有明显差异,如拟南芥中有21个Hsf蛋白,而大豆中有52个Hsf蛋白,且在进化过程中各组的成员数量和组成会发生改变,可能是由物种间全基因组复制事件差异造成(Scharf et al.,2012)。相比于裸子植物和被子植物间的Hsf蛋白家族差异,单子叶和双子叶植物间的Hsf蛋白家族差异较少,如Hsf蛋白的A9、B3和B5亚类仅存在于双子叶植物中(Scharf et al.,2012)。大量研究表明,拟南芥的热激响应调控网络中,作为主要调控因子的热激转录因子HsfA1s可能通过调控DREB2A、HsfA2、HsfA7a、HsfBs和MBF1C等基因的转录在植物热应激响应中发挥作用(Liu et al.,2011;Yoshida et al.,2011;Ohama et al.,2017)。拟南芥HsfA2基因在光照、热激和H2O2处理下表达上调,其编码蛋白是多种环境胁迫信号的防御诱导因子(Zhang et al.,2009)。番茄中HsfA2受热激诱导表达,可与HsfA1形成异源寡聚物,增強其调控能力(Chan-Schaminet et al.,2009)。Hsf可调控Hsp表达,同时也受Hsp的反馈调控作用,如番茄Hsp70通过物理作用抑制HsfA1和HsfB1活性(Hahn et al.,2011)。此外,辣椒中大部分Hsf能响应热激、高盐和渗透胁迫,其中HsfA1、HsfA6a、HsfA9a和HsfB1基因在多个组织中持续高效表达(Guo et al.,2015)。【本研究切入点】目前,鲜见有关铁皮石斛Hsf基因家族的研究报道。【拟解决的关键问题】通过生物信息学软件对铁皮石斛Hsf基因家族组成、结构、进化和启动子区元件进行分析,以期揭示铁皮石斛Hsf基因家族的特征,为深入研究该家族在铁皮石斛热应激响应中的调控机制提供理论参考。
1 材料与方法
1. 1 铁皮石斛Hsf基因家族成员鉴定
从NCBI网站GenBank搜索下载拟南芥和水稻Hsf蛋白的氨基酸序列,将其作为参考序列,在铁皮石斛蛋白数据中搜索其同源蛋白序列。利用SMART和Pfam数据库对获得的Hsf蛋白序列进行HSF保守结构域(PF00447)鉴定。利用ExPASy ProtParam对蛋白理化性质进行预测。
1. 2 铁皮石斛Hsf基因家族结构和蛋白保守基序分析
使用基因结构显示系统GSDS 2.0绘制铁皮石斛Hsf基因家族的基因结构示意图。使用MEME 5.0.2对铁皮石斛Hsf蛋白的保守基序进行分析,基序搜索数目为5,其他参数为默认设置。利用SWISS-MODEL预测蛋白的三维结构,并使用VMD 1.9.1实现蛋白三维结构的可视化。
1. 3 铁皮石斛Hsf基因的系统发育进化树分析
从PlantTFDB 4.0数据库下载拟南芥(Arabidopsis thaliana)、水稻(Oryza sativa)和小兰屿蝴蝶兰(Phalaenopsis equestris)Hsf蛋白序列,并利用SMART和Pfam数据库对其进行HSF保守结构域(PF00447)鉴定。利用MEGA 6.0的Neighbor-Joining构建系统发育进化树,Bootstrap值为1000。
1. 4 鐵皮石斛Hsf基因家族成员启动子区顺式作用元件分析
从GenBank数据库获取铁皮石斛Hsf基因家族成员转录起始位点上游1.5 kb序列,并通过PlantCARE在线数据库对启动子区的顺式作用元件进行分析。
2 结果与分析
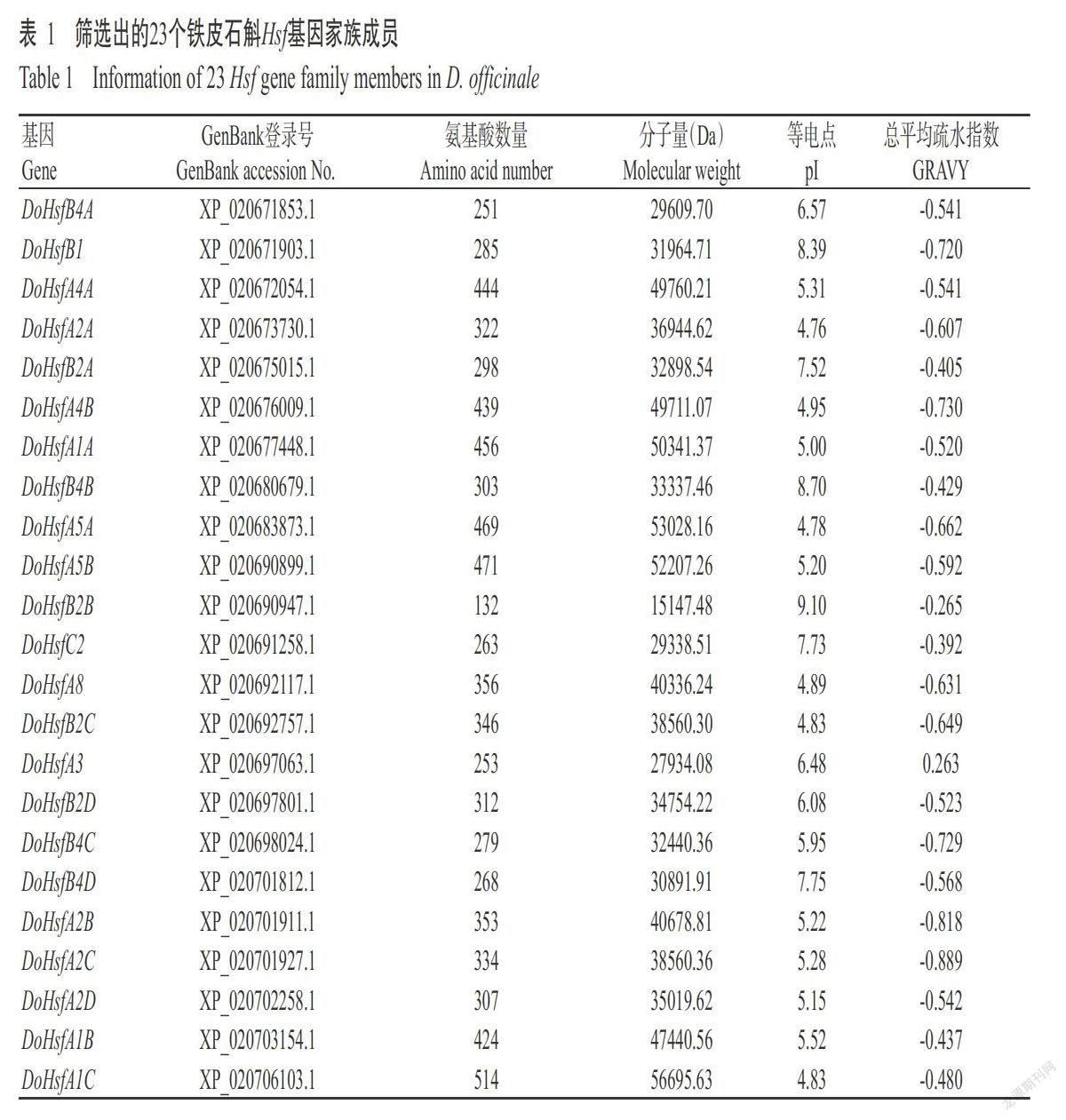
2. 1 铁皮石斛Hsf基因家族成员的鉴定及理化性质预测结果
以拟南芥和水稻Hsf蛋白的氨基酸序列为参考序列,搜索获得铁皮石斛同源蛋白序列,去除不含HSF结构域和重复冗余的Hsf蛋白后,共获得23个铁皮石斛Hsf基因家族成员,经SMART和Pfam数据库鉴定发现均具有HSF保守结构域,最后根据进化分组对其进行命名(表1),其中有13个HsfA组成员、9个HsfB组成员和1个HsfC组成员,但仅HsfA组成员包含完整的CC功能域,HsfB和HsfC组成员缺少或含不完整的CC功能域。铁皮石斛Hsf蛋白的氨基酸数量为132~514个,平均343个,分子量为15147.48~56695.63 Da,理论等电点(pI)4.76~9.10,73.91%属于酸性蛋白,除DoHsfA3外,其他铁皮石斛Hsf蛋白总平均疏水指数均为负值,属于亲水蛋白。
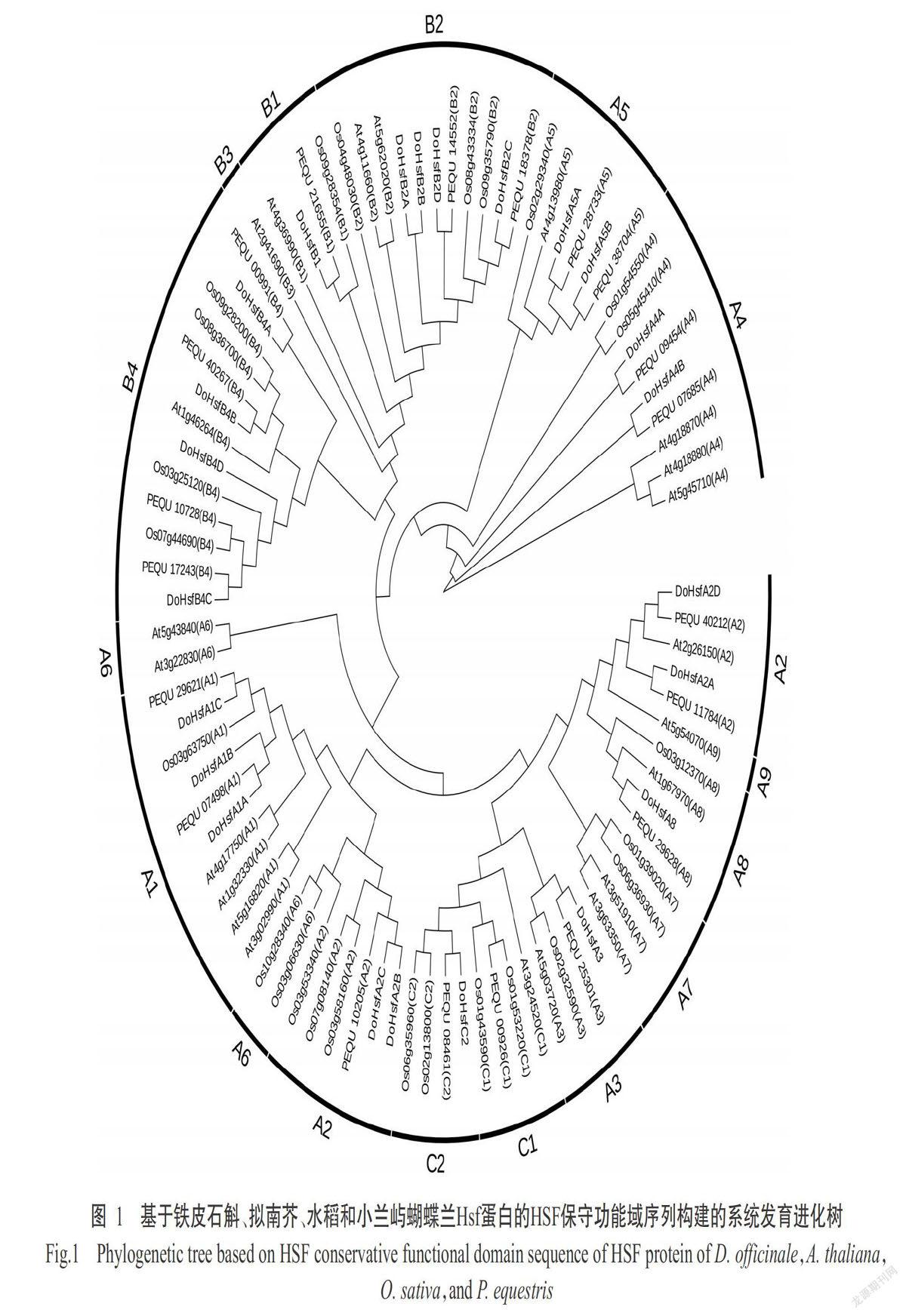
2. 2 植物Hsf蛋白的系统进化关系分析结果
为了解植物Hsf基因家族的系统进化关系,本研究使用MEGA 6.0基于铁皮石斛、拟南芥、水稻和小兰屿蝴蝶兰Hsf蛋白的HSF保守功能域序列构建系统发育进化树,结果如图1所示。HsfA组成员数量最多,可分为A1~A9亚类,其次为HsfB组,可分为B1~B4亚类,HsfC组成员数最少,可分为C1和C2亚类。铁皮石斛的13个HsfA组成员分布在A1~A8亚类,其中A1亚类中3个成员,A2亚类中4个成员,A4和A5亚类中各有2个成员,A3和A8亚类中各有1个成员。铁皮石斛的9个HsfB组成员分布在B1、B2和B4亚类中,其中B2和B4亚类中均有4个成员,B1亚类中有1个成员。铁皮石斛的1个HsfC组成员(DoHsfC2)位于C2亚类。拟南芥、水稻和小兰屿蝴蝶兰中Hsf蛋白各组的成员数量与铁皮石斛相似,且同样表现为HsfA组成员数量最多,HsfB组次之,HsfC组成员数量最少。可见,铁皮石斛Hsf蛋白缺少A9、B3、B5和C1亚类的成员,与同属于单子叶兰科植物的小兰屿蝴蝶兰Hsf蛋白亲缘关系最近。
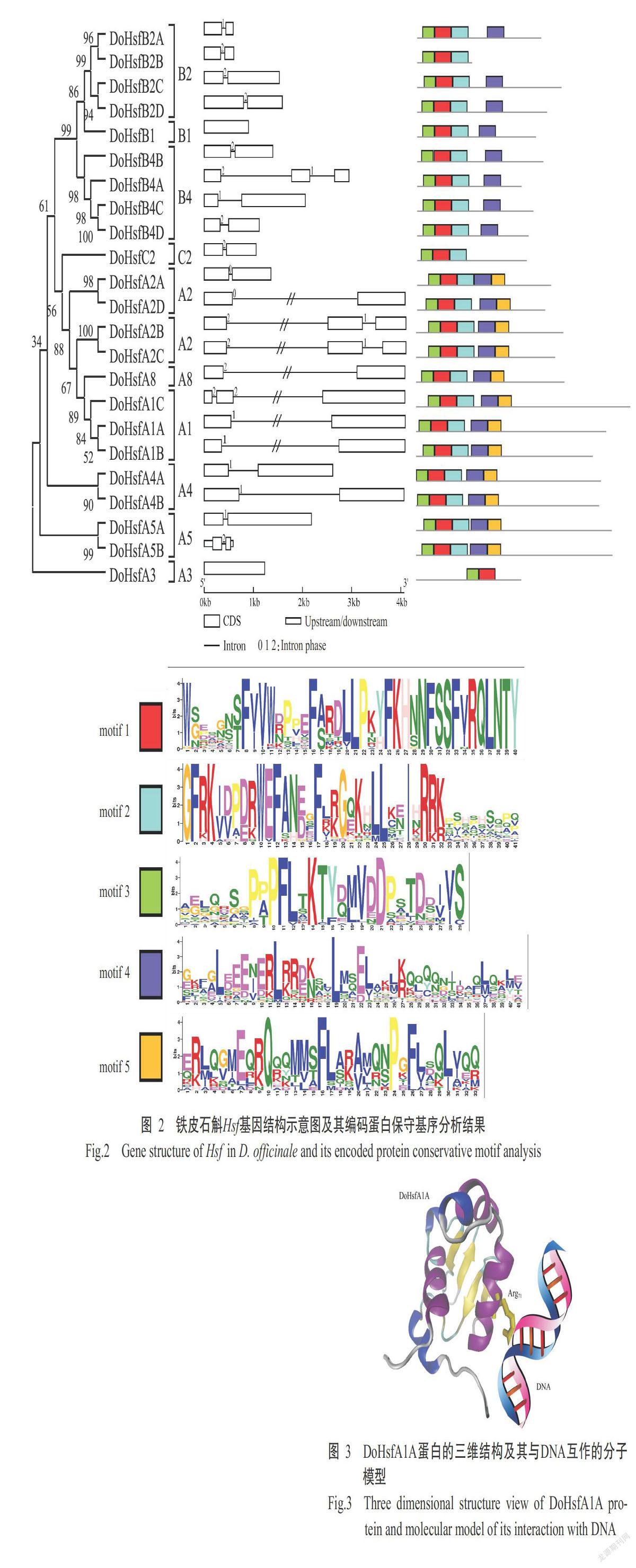
2. 3 铁皮石斛Hsf基因结构及其编码蛋白的保守基序分析结果
利用GSDS 2.0绘制铁皮石斛Hsf基因结构示意图(图2),结果发现有17个Hsf基因仅含1个内含子,4个Hsf基因含2个内含子,2个Hsf基因无内含子,其中仅含1个内含子的Hsf基因中,内含子为0型、1型和2型相位的数目分别为2、7和8个。A1、A2和A8亚类中多个成员具有较大的内含子。
使用MEME 5.0.2对23个铁皮石斛Hsf蛋白保守基序进行分析(图2),结果发现5个基序(motif 1~motif 5)保守性较强;除DoHsfA3仅包含motif 1和motif 2外,其他HsfA组蛋白均含motif 1~motif 5,HsfB和HsfC组蛋白均缺少motif 5,DoHsfB2B和DoHsfC2仅包含motif 1~motif 3。其中,motif 1~motif 3共同构成了HSF保守功能域,保证蛋白的特异性结合DNA功能。motif 4和motif 5共同构成了卷曲螺旋功能域,可能在信号激活中发挥作用(Maekawa et al.,2011)。
利用SWISS-MODEL预测23个铁皮石斛Hsf蛋白的三维结构,使用VMD 1.9.1进行可视化,结果发现,铁皮石斛HsfA组蛋白结构较完整,其中DoHsfA1A蛋白(图3)与乳酸克鲁维酵母(Kluyveromyces lactis)Hsf1蛋白类似,其68~72位置上有保守的丝氨酸—苯丙氨酸—缬氨酸—精氨酸—谷氨酰胺序列,其可识别并插入至DNA热激元件的沟槽中,序列中的精氨酸(Arg71)残基通过与nGAAn元件中的鸟嘌呤形成氢键实现与DNA的结合(Littlefield and Nelson,1999)。由此推测DoHsfA1A蛋白的Arg71在蛋白与DNA的结合中发挥作用。
2. 4 铁皮石斛Hsf基因启动子区顺式作用元件分析结果
为了解铁皮石斛Hsf基因在植物生长发育中的作用及对胁迫响应的能力,使用PlantCARE对铁皮石斛Hsf基因启动子区顺式作用元件进行预测,结果如表2所示。除了最基本的TATA-box和CAAT-box外,铁皮石斛Hsf基因启动子区含大量的激素响应、胁迫响应和生长相关元件,其中启动子区含脱落酸响应元件(ABRE)的Hsf基因占56.5%,含茉莉酸响应元件(CGTCA-motif)的Hsf基因占65.2%,含赤霉素响应元件(TATC-box和P-box)和水杨酸响应元件(TCA-element)的Hsf基因占34.8%,含生长素响应元件(TGA-element)的Hsf基因占17.4%,含厌氧诱导必需的顺式作用元件(ARE)的Hsf基因占73.9%,含脱水响应相关元件(MYB-like sequence)的Hsf基因占47.8%,含干旱响应MYB结合元件(MBS)、低温响应元件(LTR)、损伤响应元件(WUN-motif)及防御和胁迫响应元件(TC-rich repeats)的Hsf基因均占21.7%,含病原激发子响应元件(W box)的Hsf基因占26.1%。除此之外,34.8%和21.7%的Hsf基因启动子区分别含分生组织表达相关顺式调控元件(CAT-box)和胚乳表达相关顺式调控元件(GCN4_motif)等。
3 讨论
高温是农业生产的重要影响因素,通过干扰植物细胞的生理和代谢阻碍植物的生长发育,从而导致作物减产(Bita and Gerats,2013)。研究表明,植物Hsf基因可增强植物的耐热性,响应多种非生物胁迫,从而保护机体免受应激损伤,并在其他许多生物学过程中发挥重要作用(Xin et al.,2010;Scharf et al.,2012;Xue et al.,2014)。多种植物的Hsf基因家族成员已被鉴定,如拟南芥(21个)、水稻(25个)、番茄(24个)、辣椒(25个)、杨树(28个)、大豆(52个)、小麦(56个)等(Scharfet al.,2012;Xue et al.,2013;Fragkostefanakis et al.,2015;Guo et al.,2015;Zhang et al.,2015)。除Scharf等(2012)报道的21个拟南芥Hsf基因家族成员外,本研究发现,拟南芥Hsf基因家族还有一个新成员At4g18870,该蛋白含有2个HSF结构域。Hsf基因家族成员数量与物种基因组大小不相关,如水稻、番茄和辣椒基因组大小分别为466 Mb、900 Mb和3.14 Gb,而Hsf基因家族成员数却相差不大,分别为25、24和25个。铁皮石斛基因组为1.35 Gb,介于番茄和辣椒基因组大小之间,其Hsf基因家族成员数量(23个)与二者的Hsf基因家族成员数量相当,但与基因组为1.10 Gb的大豆Hsf基因家族成员数量(52个)相差较大。前人研究发现,植物Hsf基因家族成员数量除取决于基因组复制事件外,很可能与植物进化过程中所受的选择压力有关(Scharf et al.,2012)。
植物Hsf蛋白存在保守的功能域,包括N端的HSF功能域和中部的CC功能域,其中,HSF功能域含有DBD,其在DNA的特異性结合中发挥作用,CC功能域可能在信号激活中发挥作用(Maekawa et al.,2011)。Guo等(2016)研究认为Hsf蛋白的A9、B3和B5亚类成员仅限于双子叶植物,而HsfC2亚类成员属于单子叶特异型,与本研究结果一致。本研究发现,归属于单子叶植物的铁皮石斛同样缺少Hsf蛋白的A9、B3和B5亚类成员,但含C2亚类成员。且系统发育进化树分析结果显示,铁皮石斛Hsf蛋白与同属于单子叶兰科植物的小兰屿蝴蝶兰Hsf蛋白亲缘关系最近,与物种的进化关系一致。
植物HsfA组蛋白是热应激响应的主要调控因子,尤其是A1和A2亚类(Mishra et al.,2002;Zhu et al.,2006)。本研究DoHsfA1A蛋白三维结构显示,其具有典型的DNA结合保守序列。Jaeger等(2016)研究发现,Hsf蛋白A1亚类的赖氨酸(Lys80)发生乙酰化后,其电荷发生改变,进而抑制该类蛋白与DNA结合。由此推测DoHsfA1A蛋白活性受Lys80乙酰化作用的控制。可见,Hsf基因家族在植物机体中的调控机制非常复杂。此外,HsfB组蛋白可能缺乏激活功能域,无法独立发挥功能活性,但其能通过与HsfA组蛋白形成复合体而发挥作用(Scharf et al.,2012;Fragkostefanakis et al.,2015)。铁皮石斛Hsf蛋白均含有保守的HSF结构域,但仅HsfA组成员包含完整的CC功能域,HsfB和HsfC组缺少或含不完整的CC功能域,可能与不同组成员的功能活性有关。综上所述,Hsf基因家族成员的生物学功能存在明显物种特异性,进化关系较复杂。
大量研究表明,Hsf蛋白在植物响应非生物胁迫和激素信号中发挥作用(Xue et al.,2013;Fragkostefanakis et al.,2015;Guo et al.,2015;Huang et al.,2015;Zhang et al.,2015)。启动子区的顺式作用元件可调控基因的转录活性,通过分析顺式作用元件组成,可了解基因的功能及其表达潜力。铁皮石斛Hsf基因家族成员的启动子区含大量激素响应、胁迫响应和生长相关元件,且含顺式作用元件的种类和数量不尽相同,存在顺式作用元件的重叠和交叉现象,推测该家族成员在不同的非生物胁迫和植物激素信号途径中发挥潜在的“节点”作用,说明其可能同时调节多种非生物胁迫和植物激素信号通路,体现了该基因家族生物学功能的多样性和复杂性。
4 结论
铁皮石斛Hsf基因家族成员进化上保守,其生物学功能存在明显物种特异性,进化关系较复杂,推测其在不同的非生物胁迫和植物激素信号途径中发挥潜在“节点”作用。
参考文献:
陈晓军,叶春江,吕慧颖,徐民新,李葳,张利明,王超,罗淑萍,朱保葛. 2006. GmHSFA1基因克隆及其过量表达提高转基因大豆的耐热性[J]. 遗传,(11):1411-1420. [Chen X J,Ye C J,Lü H Y,Xu M X,Li W,Zhang L M,Wang C,Luo S P,Zhu B G. 2006. Cloning of GmHSFAI gene and its overexpression leading to enhancement of heat tolerance in transgenic soybean[J]. Hereditas,(11):1411-1420.]
江爱明,蔡高磊,曹俊,周向宇,柯尊伟. 2018. 白及小分子热激蛋白BsHsp17.3基因的克隆与表达分析[J]. 广西植物,38(9):1191-1198. [Jiang A M,Cai G L,Cao J,Zhou X Y,Ke Z W. 2018. Cloning and expression analysis of small heat shock protein gene BsHsp17.3 in Bletilla striata[J]. Guihaia,38(9):1191-1198.]
蒋素华,张燕,王默霏,王洁琼,崔波. 2017. 铁皮石斛RCA2基因克隆与生物信息学分析[J]. 广西植物,37(1):80-86. [Jiang S H,Zhang Y,Wang M F,Wang J Q,Cui B. 2017. Cloning and bioinformatics analysis of RCA2 gene in Dendrobium officinale[J]. Guihaia,37(1):80-86.]
王海波,李璐,苏新国,张昭其,庞学群. 2016. MaHSFA1和MaHSP70在热处理诱导香蕉抗冷性中的作用[J]. 南方农业学报,47(6):873-878. [Wang H B,Li L,Su X G,Zhang Z Q,Pang X Q. 2016. Role of MaHSFA1 and MaHSP70 in heat-induced chilling tolerance of banana fruit[J]. Journal of Southern Agriculture,47(6):873-878.]
冼康华,付传明,何金祥,龚庆芳,苏江,黄宁珍. 2017. 花粉管通道法介导的铁皮石斛转基因技术[J]. 广西植物,37(9):1101-1110. [Xian K H,Fu C M,He J X,Gong Q F,Su J,Huang N Z. 2017. Transgene by pollen-tube pathway of Dendrobium officinale[J]. Guihaia,37(9):1101-1110.]
曾貞,孙恒,陈骏飞,徐天才,王宇萍,李坤,康平德,胡强. 2018. FTIR结合化学计量学快速预测铁皮石斛中总多糖含量[J]. 江西农业学报,30(1):117-121. [Zeng Z,Sun H,Chen J F,Xu T C,Wang Y P,Li K,Kang P D,Hu Q. 2018. Rapid forecast of total polysaccharide content in Dendrobium officinale by FTIR combined with chemometrics[J]. Acta Agriculturae Jiangxi,30(1):117-121.]
Åkerfelt M,Morimoto R I,Sistonen L. 2010. Heat shock factors: Integrators of cell stress,development and lifespan[J]. Nature Reviews Molecular Cell Biology,11(8):545-555.
Al-Whaibi M H. 2011. Plant heat-shock proteins:A mini review[J]. Journal of King Saud University-Science,23(2):139-150.
Bita C,Gerats T. 2013. Plant tolerance to high temperature in a changing environment:Scientific fundamentals and production of heat stress-tolerant crops[J]. Frontiers in Plant Science,4:273. doi:10.3389/fpls.2013.00273.
Chan-Schaminet K Y,Baniwal S K,Bublak D,Nover L,Scharf K D. 2009. Specific interaction between tomato HsfA1 and HsfA2 creates hetero-oligomeric superactivator complexes for synergistic activation of heat stress gene expression[J]. Journal of Biological Chemistry,284(31):20848-20857.
Fragkostefanakis S,Roeth S,Schleiff E,Scharf K. 2015. Prospects of engineering thermotolerance in crops through modulation of heat stress transcription factor and heat shock protein networks[J]. Plant,Cell and Environment,38(9):1881-1895.
Guo J,Wu J,Ji Q,Wang C,Luo L,Yuan Y,Wang Y,Wang J. 2008. Genome-wide analysis of heat shock transcription factor families in rice and Arabidopsis[J]. Journal of Genetics and Genomics,35(2):105-118.
Guo M,Liu J H,Ma X,Luo D X,Gong Z H,Lu M H. 2016. The plant heat stress transcription factors(HSFs):Structure,regulation,and function in response to abiotic stre-sses[J]. Frontiers in Plant Science,7:114. doi:10.3389/fpls.2016.00114. eCollection 2016.
Guo M,Lu J P,Zhai Y F,Chai W G,Gong Z H,Lu M H. 2015. Genome-wide analysis,expression profile of heat shock factor gene family(CaHsfs) and characterisation of CaHsfA2 in pepper(Capsicum annuum L.)[J]. BMC Plant Biology,15(1):151. doi:10.1186/s12870-015-0512-7.
Hahn A,Bublak D,Schleiff E,Scharf K D. 2011. Crosstalk between Hsp90 and Hsp70 chaperones and heat stress transcription factors in tomato[J]. The Plant Cell,23(2):741-755.
Huang K,Li Y,Tao S,Wei G,Huang Y,Chen D,Wu C. 2016. Purification,characterization and biological activity of polysaccharides from Dendrobium officinale[J]. Molecules,21(6):701. doi:10.3390/molecules21060701.
Huang Y,Li M Y,Wang F,Xu Z F,Huang W,Wang G L,Ma J,Xiong A S. 2015. Heat shock factors in carrot:Genome-wide identification,classification,and expression profiles response to abiotic stress[J]. Molecular Biology Reports,42(5):893-905.
Jaeger A M,Pemble IV C W,Sistonen L,Thiele D J. 2016. Structures of HSF2 reveal mechanisms for differential regulation of human heat-shock factors[J]. Nature Structural and Molecular Biology,23(2):147-154.
Littlefield O,Nelson H C M. 1999. A new use for the ‘wing’of the ‘winged’ helix-turn-helix motif in the HSF-DNA cocrystal[J]. Nature Structural and Molecular Biology,6(5):464-470.
Liu H C,Liao H T,Charng Y Y. 2011. The role of class A1 heat shock factors(HSFA1s) in response to heat and other stresses in Arabidopsis[J]. Plant,Cell and Environment,34(5):738-751.
Maekawa T,Cheng W,Spiridon L N,Töller A,Lukasik E,Saijo Y,Liu P,Shen Q H,Micluta M A,Somssich I E,Ta-kken F L W,Petrescu A J,Chai J,Schulze-Lefert P. 2011. Coiled-coil domain-dependent homodimerization of intracellular barley immune receptors defines a minimal functional module for triggering cell death[J]. Cell Host and Microbe,9(3):187-199.
Mishra S K,Tripp J,Winkelhaus S,Tschiersch B,Theres K,Nover L,Scharf K D. 2002. In the complex family of heat stress transcription factors,HsfA1 has a unique role as master regulator of thermotolerance in tomato[J]. Genes & Development,16(12):1555-1567.
Ohama N,Sato H,Shinozaki K,Yamaguchi-Shinozaki K. 2017. Transcriptional regulatory network of plant heat stress response[J]. Trends in Plant Science,22(1):53-65.
Pratt W B,Morishima Y,Peng H M,Osawa Y. 2010. Propo-sal for a role of the Hsp90/Hsp70-based chaperone machinery in making triage decisions when proteins undergo oxidative and toxic damage[J]. Experimental Biology and Medicine,235(3):278-289.
Qiao X,Li M,Li L T,Yin H,Wu J Y,Zhang S L. 2015. Genome-wide identification and comparative analysis of the heat shock transcription factor family in Chinese white pear(Pyrus bretschneideri) and five other Rosaceae species[J]. BMC Plant Biology,15(1):12.
Scharf K D,Berberich T,Ebersberger I,Nover L. 2012. The plant heat stress transcription factor(Hsf) family:Structure,function and evolution[J]. Biochimica et Biophysica Acta(BBA)-gene Regulatory Mechanisms,1819(2):104-119.
Schultheiss J,Kunert O,Gase U,Scharf K D,Nover L,Rüterjans H. 1996. Solution structure of the DNA-binding domain of the tomato heat-stress transcription factor HSF24[J]. European Journal of Biochemistry,236(3):911-921.
Song X,Liu G,Duan W,Liu T,Huang Z,Ren J,Li Y,Hou X. 2014. Genome-wide identification,classification and expression analysis of the heat shock transcription factor family in Chinese cabbage[J]. Molecular Genetics and Genomics,289(4):541-551.
Wang T,Song Z,Wei L,Li L. 2018. Molecular characterization and expression analysis of WRKY family genes in Dendrobium officinale[J]. Genes & Genomics,40(3):265-279.
Xin H,Zhang H,Chen L,Li X,Lian Q,Yuan X,Hu X,Cao L,He X,Yi M. 2010. Cloning and characterization of HsfA2 from lily(Lilium longiflorum)[J]. Plant Cell Reports,29(8):875-885.
Xue G P,Drenth J,McIntyre C L. 2014. TaHsfA6f is a transcriptional activator that regulates a suite of heat stress protection genes in wheat(Triticum aestivum L.) inclu-ding previously unknown Hsf targets[J]. Journal of Experi-mental Botany,66(3):1025-1039.
Xue G P,Sadat S,Drenth J,Mcintyre C L. 2013. The heat shock factor family from Triticum aestivum in response to heat and other major abiotic stresses and their role in regulation of heat shock protein genes[J]. Journal of Experimental Botany,65(2):539-557.
Yoshida T,Ohama N,Nakajima J,Kidokoro S,Mizoi J,Nakashima K,Maruyama K,Kim J M,Seki M,Todaka D,Osakabe Y,Sakuma Y,Schoffl F,Shinozaki K,Yamaguchi-Shinozaki K. 2011. Arabidopsis HsfA1 transcription factors function as the main positive regulators in heat shock-responsive gene expression[J]. Molecular Genetics and Genomics,286(5-6):321-332.
Yu Z,He C,da Silva J A T,Luo J,Yang Z,Duan J. 2018. The GDP-mannose transporter gene(DoGMT) from Dendrobium officinale is critical for mannan biosynthesis in plant growth and development[J]. Plant Science,277:43-54.
Zhang G Q,Xu Q,Bian C,Tsai W C,Yeh C M,Liu K W,Yoshida K,Zhang L S,Chang S B,Chen F,Shi Y,Su Y Y,Zhang Y Q,Chen L J,Yin Y,Lin M,Huang H,Deng H,Wang Z W,Zhu S L,Zhao X,Deng C,Niu S C,Huang J,Wang M,Liu G H,Yang H J,Xiao X J,Hsiao Y Y,Wu W L,Chen Y Y,Mitsuda N,Ohme-Takagi M,Luo Y B,Van de Peer Y,Liu Z J. 2016. The Dendrobium catenatum Lindl. genome sequence provides insights into polysaccharide synthase,floral development and adaptive evolution[J]. Scientific Reports,6:19029.
Zhang J,Liu B,Li J,Li Z,Wang Y,Zheng H,Lu M,Chen J. 2015. Hsf and Hsp gene families in Populus:Genome-wide identification,organization and correlated expre-ssion during development and in stress responses[J]. BMC Genomics,16(1):181.
Zhang L,Li Y,Xing D,Gao C. 2009. Characterization of mitochondrial dynamics and subcellular localization of ROS reveal that HsfA2 alleviates oxidative damage caused by heat stress in Arabidopsis[J]. Journal of Experimental Botany,60(7):2073-2091.
Zhang Y,Zhang L,Liu J,Liang J,Si J,Wu S. 2017. Dendrobium officinale leaves as a new antioxidant source[J]. Journal of Functional Foods,37:400-415.
Zhu B,Ye C,Lü H,Chen X,Chai G,Chen J,Wang C. 2006. Identification and characterization of a novel heat shock transcription factor gene,GmHsfA1,in soybeans(Glycine max)[J]. Journal of Plant Research,119(3):247-256.
(責任编辑 陈 燕)

