基于Bcl-2/Beclin-1复合体探讨黄连素对脑缺血再灌注损伤大鼠模型的保护作用
丁实,赵学荣,李宝群,赵亮,周健,毕红东,庞冲,郭娜娜
(1.承德医学院药理学教研室,承德 067000;2.承德医学院免疫学教研室,承德 067000)
缺血性脑卒中属于常见的脑血管疾病,占脑血管疾病的60%以上,近年来发病率逐渐升高,给患者的家庭和生活质量带来了严重的影响[1]。患者脑缺血后引起的炎症反应、自噬、细胞坏死、钙超载等多种原因进而导致脑损伤,加重病情并影响患者的预后[2]。脑缺血过程中自噬具有双重作用,适度自噬清除受损、衰老细胞,对神经细胞主要起保护作用,过度自噬则导致细胞死亡增加,加重脑损伤[3]。Beclin是一种特异性的自噬调节基因,可与配体结合激活自噬活性[4]。研究报道自噬与凋亡两种细胞死亡方式存在相互调节作用,B细胞淋巴瘤/白血病-2(B cell lymphoma/lewkmia-2,Bcl-2)等凋亡蛋白可结合beclin蛋白激活自噬活性,调控细胞的自噬[5]。黄连素(berberine,Ber)是从黄柏等植物中提取出来的生物碱,具有抗菌、抗心律失常、抗肿瘤等多种作用,对脑缺血、老年痴呆、焦虑等神经细胞具有保护作用[6]。然而关于黄连素对脑损伤中细胞自噬的作用尚不清楚,本研究通过制备大鼠脑缺血再灌注模型,观察黄连素对大鼠神经细胞的保护作用及对细胞自噬的影响,以期探究黄连素的可能保护机制。
1 材料和方法
1.1 材料
1.1.1 实验动物
SPF级雄性SD大鼠108只,8周龄,体重200 ~ 260 g,由郑州大学动物实验中心提供【SCXK证号2017-0002】,在承德医学院动物实验室进行实验,所有实验动物均严格按照动物饲养规则喂养,本研究中经河北省承德市动物伦理委员会批准同意,批号为IACUC-01(20180917)。
1.1.2 主要试剂及仪器
黄连素原粉(哈尔滨三精制药厂,中国);尼莫地平(Nimodipine,NMDP)注射液(山东新华制药股份有限公司,规格:10 mL/2mg,中国);2,3,5-苯氯化四氮锉(2,3,5-triphenyl-2H-tetrazolium chloride,TTC)溶液(Amresco公司,美国);Bcl-2、Bax、caspase-3兔抗鼠单抗(R&D Systems公司,美国);Beclin单抗(Abcam生物公司,英国);羊抗鼠IgG二抗(北京博奥森公司,中国);苏木素、伊红染液(Sigma公司,美国);RNA提取试剂盒、逆转录试剂盒(大连宝生物工程公司,中国);BCA试剂盒(上海经科化学科技有限公司,中国);尼康SMZ745光学显微镜(尼康株式会社,日本);蛋白电泳仪1659001、CFX96 PCR仪(Bio-Rad公司,美国);GIS-500凝胶成像仪(杭州米欧仪器有限公司,中国)。
1.2 方法
1.2.1 动物分组与给药
1.2.2 药物的配置和使用
0.5% Tween80溶解黄连素,配置成10 mg/mL的混悬溶液;于再灌注后30 min腹腔注射给药。
1.2.3 脑缺血再灌注损伤模型大鼠制备
大鼠分组后禁食12 h,10%戊巴比妥钠(3 mL/kg)腹腔麻醉,参照马贤德等[7]制备方法制备右侧大脑中动脉缺血再灌注(middle cerebral artery occlusion,MCAO)模型,大鼠仰卧位固定,颈正中部位消毒、切口,暴露右侧颈总,颈内、颈外动脉,结扎颈外动脉,在残端插入0.24 mm单丝尼龙鱼线,插入栓线约18 ~ 20 mm,缝合皮肤,固定尼龙鱼线尾部于皮肤上,大鼠缺血2 h后小心抽出栓线8 mm左右,即形成MCAO模型。
1.2.4 大鼠神经功能缺损评分
参照Longa等[8]的分级法对苏醒后大鼠进行神经功能缺损评分,分别在大鼠清醒后6、24、48 h进行评分:无神经功能缺损记0分,提尾时大鼠双上肢可伸展;1分,对侧前肢不能完全伸展;2分,行走出现向对侧旋转;3分,行走出现向对侧倾倒;4分,意识丧失,不能自发行走;5分,死亡。得分为1 ~ 3分即造模成功。造模完成后,大鼠随机分组。
1.2.5 TTC染色观察大鼠脑梗死面积
治疗24 h后,每组随机选取6只大鼠取脑,冰生理盐水冲洗,切除额极、枕极,沿冠状切面切为5片,迅速置于2%TTC磷酸盐缓冲液中,37℃恒温水浴锅中避光孵育30 min,每5 min翻动一次,染色均匀后,放置于4%多聚甲醛中固定,24 h后拍照,采用Image pro软件进行分析,计算大鼠脑梗死面积百分比。计算公式:脑梗死面积=全脑梗死面积/全脑片面积 × 100%。
采用SPSS20.0统计软件对各组实验数据进行分析,计量资料数据以均数±标准差表示,计数资料数据以率(%)表示,两组比较用χ2检验,P<0.05表示差异有统计学意义。
1.2.6 HE染色观察大鼠脑组织病理学变化
治疗24 h后,每组随机选取6只大鼠,取脑组织后4%多聚甲醛固定,制备石蜡切片;常规二甲苯,乙醇低度脱水,蒸馏水冲洗;苏木精染色10 min,流水冲洗; 0.7% 盐酸乙醇5 s,流水冲洗;伊红染色复染5 min,梯度乙醇脱水2 min,二甲苯透明,中性树脂封片,显微镜下观察切片。
1.2.7 RT-PCR法检测脑组织中Bcl-2、caspase-3、Bax mRNA的表达
治疗24 h后,每组随机选取6只大鼠处死,取大鼠缺血侧脑组织,根据RNA提取试剂盒说明书提取总RNA,参照逆转录试剂盒说明书反转录为cDNA,以cDNA为模板进行RT-PCR,反应体系为20 μL: 2× SYBR Mix 10 μL,引物各0.5 μL,10× cDNA 1 μL,ddH2O 8 μL。反应参数设置为:95℃ 5 min,95℃ 10 s、60℃ 30 s,72℃ 2 min,40个循环,72℃ 10 min。引物序列见下表1。以β-actin作为内参基因,根据2-ΔΔCt法计算Bcl-2、caspase-3、Bax mRNA的相对表达量。
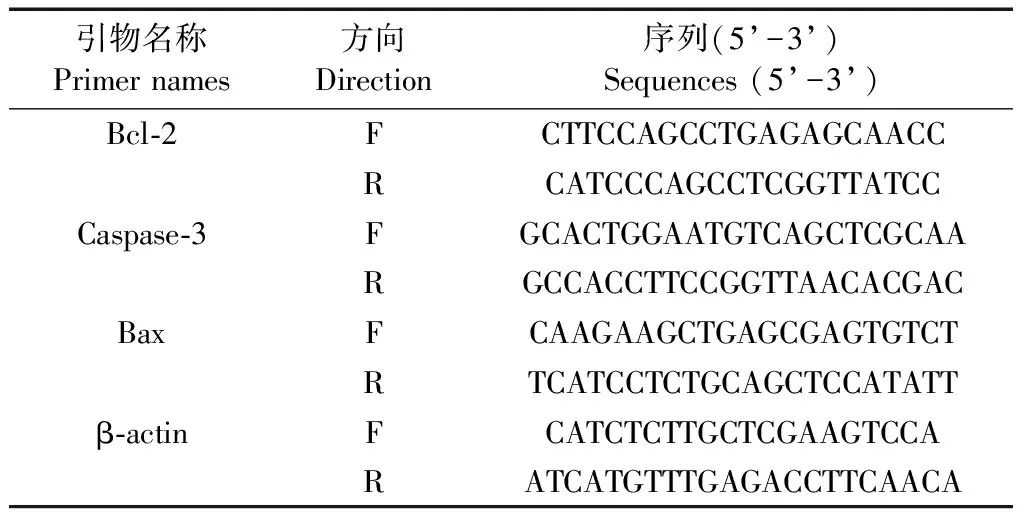
表1 RT-PCR引物序列Table 1 RT-PCR primer sequences
1.2.8 Western blot检测脑皮质中 Bcl-2、caspase-3、Bax、Beclin-1蛋白表达
采用Western blot检测脑组织中Bcl-2、caspase-3、Bax、Beclin-1蛋白表达量,RIPA 裂解液裂解组织,匀浆脑组织样品,提取总蛋白;BCA法测定蛋白浓度;配制10%分离胶、5%浓缩胶,等量蛋白样品(50 μg/孔)上样;浓缩胶设置电压80 V,分离胶设置电压120 V,电泳后将目的蛋白转膜至PVDF膜上,TBST清洗;5%脱脂奶封闭1 h,一抗(Bcl-2、caspase-3、Bax、Beclin-1)1∶500稀释后4℃孵育过夜,TBST清洗3次/5 min;二抗1∶5000稀释后室温孵育1 h,TBST清洗3次/5 min,滴加ECL显影液,凝胶成像系统观察蛋白表达,以β-actin为内参进行灰度值比较。
1.3 统计学分析
2 结果
2.1 大鼠脑缺血模型的鉴定
所有大鼠缺血前生命体征正常,处于清醒状态。模型大鼠缺血后四肢僵直,角弓反张,活动能力消失,眼球颜色由鲜红色转为灰白色;再灌注后,眼球颜色恢复,瞳孔活动,灌注约1 h后可自主活动,表明造模成功。
2.2 各组大鼠神经功能评分比较
在大鼠缺血再灌注后Sham组无行为学改变,MCAO大鼠在24 h出现不同程度的脑缺血损伤表现,再灌注6、24、48 h分别对各组大鼠进行神经功能Longa评分,Sham组无神经功能缺损,I/R组6、24、48 h 3个时间点的神经功能评分均显著高于Sham组,24 h的神经功能评分最高;与模型组比较,BBR处理组和NMDP组24 h、48 h的神经功能缺损评分显著降低(P< 0.05),且NMDP组作用效果更显著(P< 0.05)。见表2。

表2 脑缺血再灌注大鼠神经功能评分的比较Table 2 Comparison of neurological function scores of the rats with cerebral ischemia-reperfusion
注:与Sham组比较,*P< 0.05;与I/R组比较,△P< 0.05;与BBR-L组比较,#P< 0.05。
Note. Compared with the sham group,*P< 0.05. Compared with the I/R group,△P< 0.05. Compared with the BBR-L group,#P< 0.05.
2.3 TTC染色观察黄连素对各组大鼠脑组织梗死面积的影响
Longa评分显示,24 h神经功能评分最高,对24 h的各组大鼠进行TTC染色检测脑组织梗死面积,均一红色为正常脑组织,大小不等、苍白色为梗死灶;Sham组无肉眼可见梗死组织;与Sham组比较,I/R组梗死面积百分比为(36.45 ± 4.44)显著升高(P< 0.05),与I/R组比较,BBR-L组、BBR-M组、BBR-H组和NMDP组梗死面积分别为(20.50 ± 3.34)、(15.28 ± 0.28)、(12.34 ± 0.25)、(8.23 ± 0.19)显著减少(P< 0.05)。见图1。
2.4 HE染色观察黄连素对大鼠脑组织病理学的影响
HE染色显示Sham组大鼠神经细胞呈层状排列,形态规则,细胞核圆且核仁明显;I/R组大鼠神经细胞明显减少,排列紊乱,细胞核固缩,多数细胞坏死;BBR治疗组大鼠神经细胞也有减少,少部分细胞结构不完整,出现核固缩现象,随着BBR浓度的增加坏死细胞数量减少;NMDP组神经细胞排列较整齐,坏死细胞较BBR治疗组减少。见图2。

图1 各组大鼠梗死面积TTC染色图Figure 1 TTC staining of the infarct size of rats in each group

图2 各组大鼠脑组织的病理学改变(HE染色)Figure 2 Histopathological changes in the brain tissues of rats in each group(HE staining)
2.5 qRT-PCR检测黄连素对各组大鼠脑组织凋亡相关基因mRNA水平的影响
与Sham组比较,I/R组Bcl-2、caspase-3、Bax mRNA水平均显著升高(P<0.05);与I/R组比较,BBR治疗组和NMDP组Bcl-2 mRNA水平均显著升高,caspase-3、Bax mRNA水平均显著降低(P< 0.05),呈剂量依赖性;与Sham组比较,I/R组Bcl-2/Bax比值显著降低(P< 0.05);与I/R组比较,各治疗组Bcl-2/Bax比值均显著上升(P< 0.05),且呈剂量依赖性,BBR-H组与NMDP组无显著差异(P> 0.05)。见表3。
表3 黄连素对各组大鼠脑组织凋亡相关基因mRNA表达的影响Table 3 Effects of berberine on expression of apoptosis-related genes in brain tissues of the rats in different n=6)
注:与Sham组比较,*P< 0.05;与I/R组比较,△P< 0.05;与BBR-L组比较,#P< 0.05;与BBR-M组比较,&P< 0.05。
Note. Compared with the sham group,*P< 0.05. Compared with the I/R group,△P< 0.05. Compared with the BBR-L group,#P< 0.05. Compared with the BBR-M group,&P< 0.05.
2.6 Western blot检测黄连素对各组大鼠脑组织凋亡相关蛋白水平的影响
Western blot检测结果显示,与Sham组比较,I/R组Bcl-2、caspase-3、Bax蛋白水平均显著升高;与I/R组比较,BBR治疗组和NMDP组Bcl-2蛋白水平显著升高(P< 0.05),BBR-H组与NMDP组无显著差异(P> 0.05);caspase-3、Bax蛋白水平显著降低(P< 0.05)。见图3。
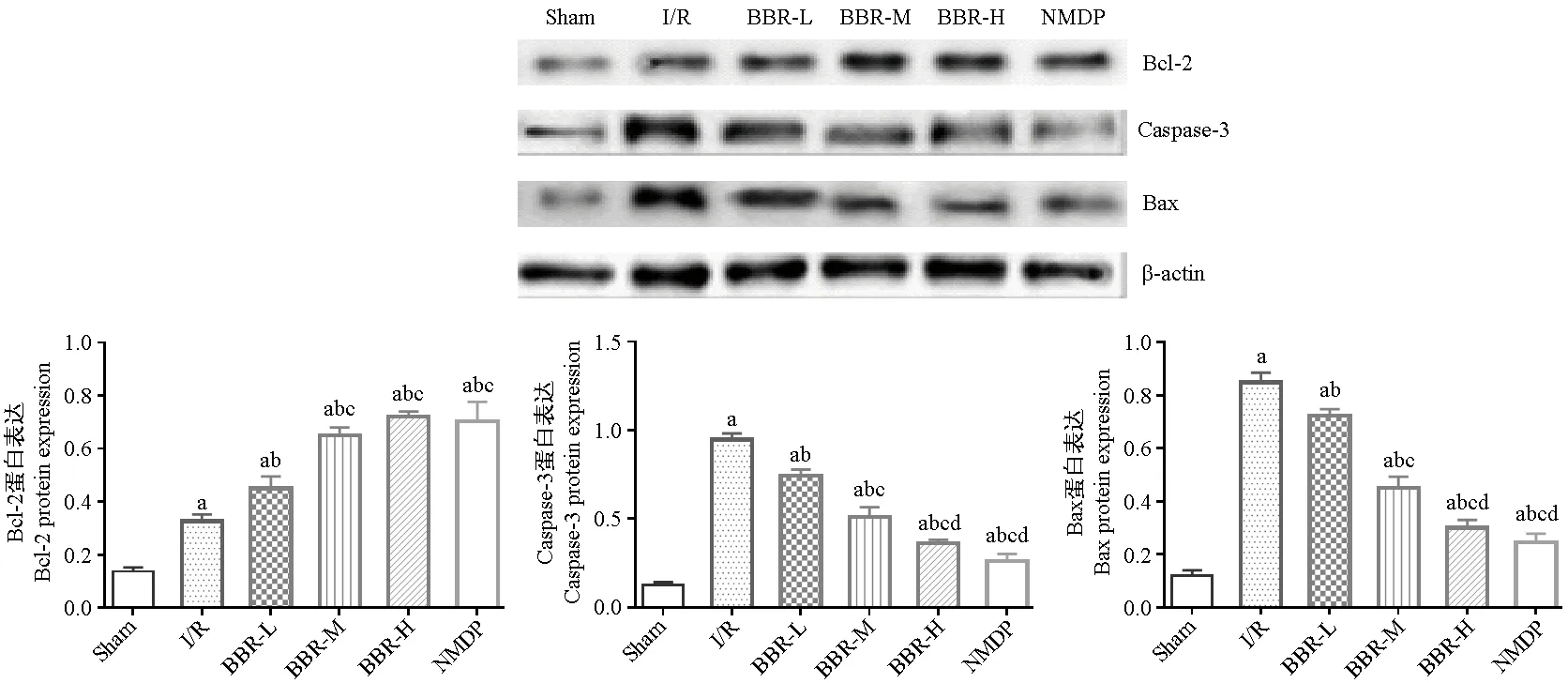
注:与Sham组比较,aP< 0.05;与I/R组比较,bP< 0.05;与BBR-L组比较,cP< 0.05;与BBR-M组比较,dP< 0.05。(下图同)图3 各组大鼠凋亡蛋白表达比较Note. Compared with the sham group, aP< 0.05. Compared with the I/R group, bP< 0.05. Compared with the BBR-L group, cP< 0.05. Compared with the BBR-M group, dP< 0.05.(The same in the following figure)Figure 3 Comparison of the expression of apoptotic proteins in the rats of each group
2.7 Western blot检测黄连素对各组大鼠脑组织自噬蛋白Beclin-1及Bcl-2/Beclin-1比值的影响
Western blot检测结果显示,与Sham 组比较,I/R组Beclin-1蛋白水平升高(P< 0.05);与I/R组比较,BBR组和NMDP组Beclin-1蛋白水平显著升高(P< 0.05)。Bcl-2/Beclin-1比值显示,与Sham组比较,I/R组Bcl-2/Beclin-1蛋白水平升高(P< 0.05);与I/R组比较,BBR组和NMDP组Bcl-2/Beclin-1比值均降低,且BBR-M组、BBR-H组、NMDP组Bcl-2/Beclin-1无显著差异(P> 0.05)。见图4。
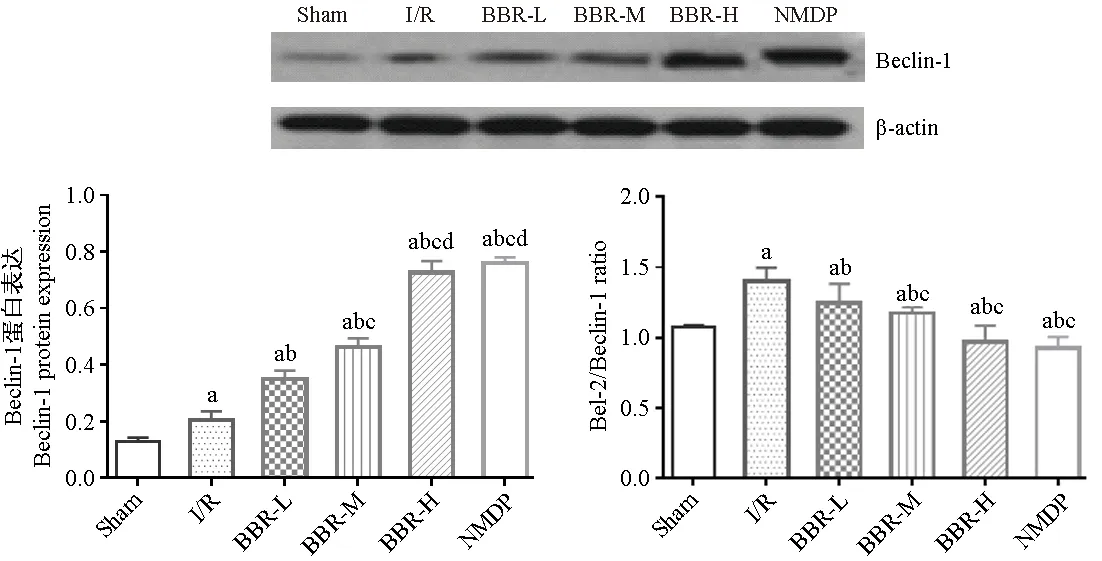
图4 各组大鼠Beclin-1蛋白及Bcl-2/Beclin-1比值比较Figure 4 Comparison of Beclin-1 protein and Bcl-2/Beclin-1 ratio in the rats of different groups
3 讨论
缺血性脑卒中是我国居民死亡率和致残率最高的脑血管疾病,以往治疗脑缺血主要采用溶栓的方法,但易引发缺血再灌注损伤,加重病情的发展,因此探究缺血再灌注损伤的病理机制,寻找更有效的治疗方法是目前的首要任务。研究报道,脑缺血再灌注损伤涉及多种病理过程,如细胞自噬、凋亡、炎症反应等[9]。缺血再灌注损伤中Beclin、Bcl-2在细胞凋亡和自噬过程中发挥重要作用,但关于黄连素对脑缺血再灌注的保护作用是否涉及Beclin、Bcl-2的研究较少,故本研究分析黄连素对脑缺血再灌注大鼠模型基于Bcl-2/Beclin的保护作用,以期为脑缺血再灌注损伤的治疗提供一定的理论基础。
细胞凋亡是细胞程序性死亡的一种,主要是清除体内损伤细胞,维持机体存活。脑缺血再灌注后可同时激活体内凋亡与抗凋亡过程,其中caspase-3、Bax发挥促凋亡作用,Bcl-2发挥抗凋亡作用[10]。caspase-3在正常组织中以无活性的形式存在,在脑组织损伤时去磷酸化转变为有活性的caspase-3,促进神经细胞的凋亡[11]。Bcl-2可通过减少凋亡诱导因子、与促凋亡因子Bax结合、拮抗凋亡蛋白酶等发挥抑制凋亡作用。研究报道,Bcl-2可通过抑制caspase的激活阻止细胞的凋亡[12]。Bcl-2、Bax均属Bcl-2家族,研究显示Bcl-2/Bax比值对凋亡有决定作用,Bax降低、Bcl-2增强,Bcl-2/Bax比值增加,可抑制大鼠缺血再灌注心肌细胞凋亡[13]。本研究显示黄连素治疗组Bcl-2表达增加,caspase-3和Bax的表达降低,Bcl-2/Bax比值增加,提示黄连素可减少细胞的凋亡,对神经细胞具有保护作用。张童等[14]报道,黄连素预处理可减轻心肌损伤大鼠的心肌梗死面积,使心肌损伤得到明显改善。本研究中黄连素治疗后,大鼠脑梗死面积显著减少,神经细胞凋亡减少,提示黄连素对缺血再灌注脑组织具有保护作用,高浓度黄连素效果与尼莫地平效果相似。
细胞损伤过程可同时促进细胞的凋亡与自噬过程,细胞自噬的发生可延迟或者对抗细胞凋亡。Beclin-1也称为自噬相关蛋白-6(autophagy-related gene-6,ATG-6),可以引导自噬蛋白定位于自噬小体[15]。研究表明,缺血条件下,Bcl-2、Bcl-xL等也可诱导自噬的发生,Bcl-2/Bax比值增加,促进自噬的激活[16]。抗凋亡蛋白Bcl-2在调控Beclin-1中发挥重要作用,Beclin-1存在BH3结构域,Bcl-2、Bcl-xL、Bcl-w等能够与Beclin-1蛋白的BH3结构域结合抑制Beclin-1诱导的过度自噬作用[17]。研究报道,大鼠心肌缺血时可激活自噬,再灌注阶段过度自噬会损伤心肌,适当抑制自噬可保护心肌,因此可通过调节自噬水平发挥心肌保护作用[18]。研究报道,自噬与凋亡具有密切联系,Bcl-2与Beclin-1之间的平衡对细胞的存亡具有重要作用,Bcl-2/Beclin-1复合体是评价自噬的重要指标,可通过维持适当的自噬水平,阻滞因自噬引起的细胞死亡[19]。研究报道,Bcl-2/Beclin-1复合体水平减低可对脑梗死大鼠具有神经保护作用[20]。本研究显示应用黄连素治疗后,Beclin-1表达量升高,提示黄连素可增强神经细胞自噬蛋白的表达,减少神经细胞凋亡,BBR-H组和NMDP组的Beclin-1水平处于一定范围,使得自噬作用维持一定范围,以免过度自噬引起细胞死亡,且治疗组Bcl-2/Beclin-1比值降低,提示黄连素对神经细胞具有保护作用,与上述研究结果一致。
综上所述,本研究结果提示姜黄素可激活缺血再灌注大鼠的神经细胞自噬作用,且可维持Bcl-2/Beclin-1水平,减轻过度自噬对细胞的损伤,为临床治疗提供一定的理论基础,但本研究也存在一定的不足之处,未对自噬的具体作用机制进行研究,还有待进一步深入研究。

