空洞型肺癌的PET-CT影像特点分析
王秋虎 张淮 王书中
空洞型肺癌是肺癌的一种特殊形式,多数患者在就诊时已丧失治疗的最佳时机[1-2]。因此,提高空洞型肺癌早期诊断的准确性,对治疗及预后具有重要意义,但肺结核、肺脓肿等病变均可形成空洞,且有些征象与癌性空洞相互重叠,易相互混淆,从而给诊断带来一定的困难。18F-脱氧葡萄糖(18F-FDG)PET-CT是一种鉴别病变良恶性的影像学方法,在肺癌的诊断、分期、治疗效果评估等方面,有着良好的临床价值。本文回顾性分析35例空洞型肺癌患者的PET-CT表现,加深对空洞型肺癌的认识,提高诊断的准确性。
资料与方法
一、临床资料
回顾性分析自2014年6月至2019年3月收治于我院的空洞型肺癌患者35例,其中男性26例,女性9例,年龄44~87岁,平均63.9 ± 10.01岁。所有患者经纤维支气管镜、穿刺活检、手术等手段证实并明确病理类型。患者行18F-FDG PET-CT检查前未行任何抗肿瘤治疗。该研究经医院伦理委员会批准。
二、显像方法
所有检查均于德国Siemens Biograph mCT X-128型PET-CT上进行,18F-FDG由南京江原安迪科正电子研究发展有限公司提供,放化纯>95%。受检者在检查前需禁食6 h以上,注药前血糖控制<11.0 mmol/L。患者经肘静脉注射18F-FDG并于安静状态下休息40~60 min后行PET-CT检查。体部CT扫描,管电压120 kV,管电流80 mA,扫描层厚5 mm;体部PET扫描采集5~6个床位,2.0 min/床。所有患者均加做胸部高分辨率CT(high-resolution CT,HRCT)扫描,管电压100 kV,管电流120 mA,扫描时间0.8 S,重建层厚1 mm。
三、图像分析
扫描完成后,将所获数据导入后处理工作站进行处理。由2位经验丰富的核医学科医师独立阅片,意见不同时以两者讨论一致后结果为准。选取PET-CT图像中病灶FDG代谢最高层面,采用ROI技术勾画病灶轮廓,由计算机自动计算最大标准摄取值(maximum standardized uptake value,SUVmax)。根据HRCT图像测量空洞壁厚度最大径、肿瘤最大径及空洞最大径,多次测量取平均值。
四、统计学方法

结 果
35例空洞型肺癌患者中,鳞癌15例,腺癌20例。所有病灶均可见放射性异常浓聚灶,SUVmax为10.64 ± 5.00,其中鳞癌组SUVmax显著大于腺癌组(P<0.05)(表1)。所有病灶空洞壁厚度最大径均大于3 mm,且鳞癌组空洞壁厚度最大径大于腺癌组,两者比较差异有统计学意义(P<0.05);此外,鳞癌组肿瘤最大径亦大于腺癌组,差异有统计学意义(P<0.05),而两者之间空洞最大径差异无统计学意义(P>0.05)(图1)。
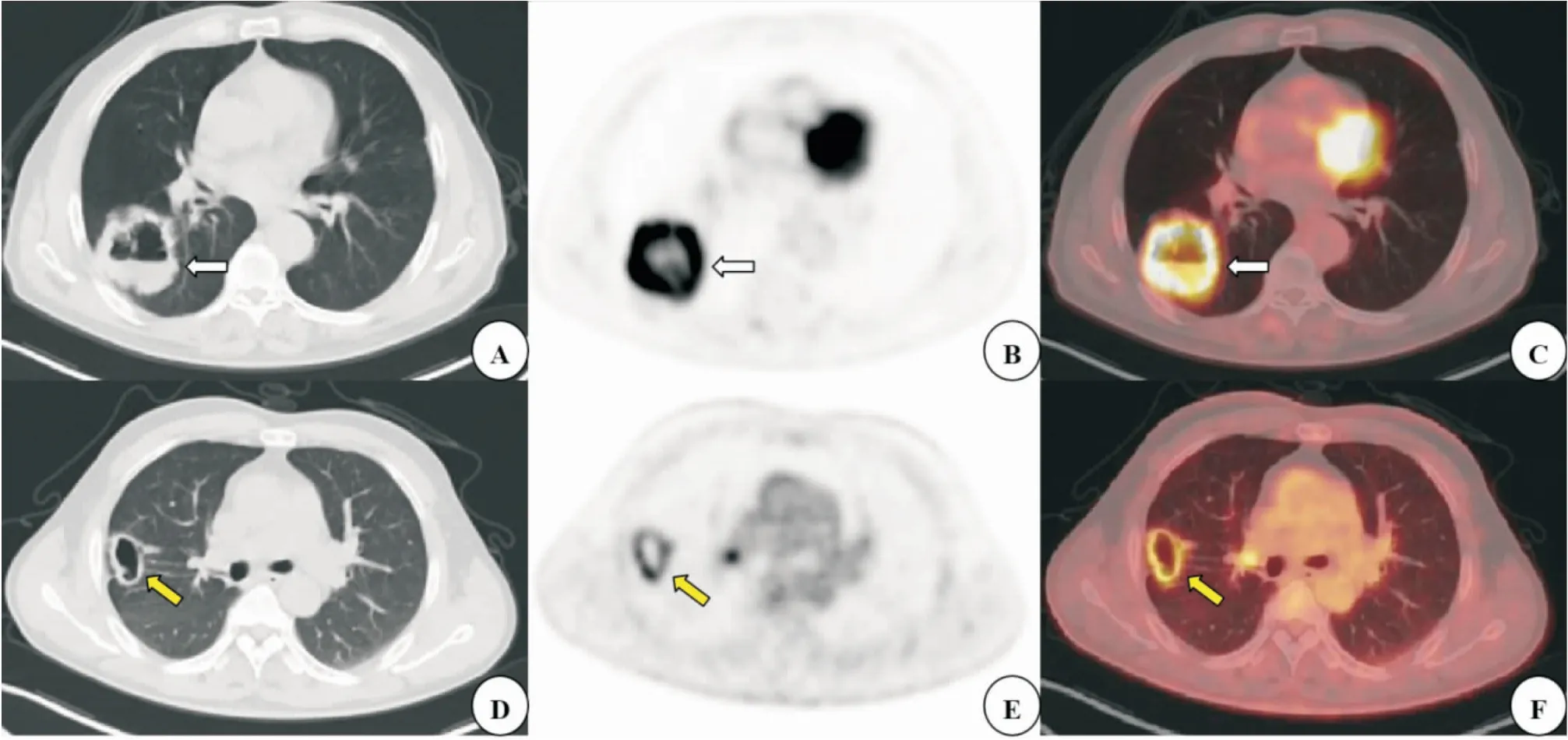
图1 A~C:男性患者,73岁,右肺下叶空洞型鳞癌,PET-CT示右肺下叶空洞型软组织肿块(白箭),边缘分叶状,内壁凹凸不平,肿瘤最大径约为5.20 cm,空洞壁最大径约为1.55 cm,FDG代谢增高,SUVmax=18.64;D~F:男性患者,56岁,右肺上叶空洞型腺癌,PET-CT示右肺上叶空洞型占位(黄箭),内壁光滑,可见壁结节,肿瘤最大径约为2.93 cm,空洞壁最大径约为0.75 cm,FDG代谢增高,SUVmax=6.93。

表1 空洞型肺鳞癌与空洞型肺腺癌间差异比较
注:P<0.05为差异有统计学意义。
按空洞壁最大径大小分为<0.5 cm,0.5~1.5 cm,>1.5 cm组,SUVmax分别为6.16 ± 2.66、10.07 ± 4.20、16.30 ± 4.45,单因素方差分析显示3组差异有统计学意义(F=10.735,P=0.000),LSD法两两比较发现<0.5 cm组SUVmax显著低于其它两组(P均<0.05),而0.5~1.5 cm组SUVmax低于>1.5 cm组,差异有统计学意义(P=0.01);同样,按肿瘤最大径大小分为<3 cm、3~5 cm,>5 cm组,单因素方差分析显示3组差异有统计学意义(F=6.568,P=0.004),进一步两两比较显示,<3 cm组SUVmax显著低于3~5 cm及>5 cm组(P均<0.05),而3~5 cm组与>5 cm组间差异无统计学意义(P=0.723)。(表2)。
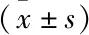
表2 空洞壁厚度及肿瘤大小对SUVmax的影响
注:P<0.05为差异有统计学意义。
讨 论
空洞型肺癌是肿瘤组织发生液化坏死后经引流支气管排出,并吸入空气而成,可发生于肺内任何部位,其典型CT征象为偏心空洞,外壁形态不规则,内壁凹凸不平或呈结节状,壁厚常大于8 mm且壁厚薄不均,伴有分叶征、毛刺征、胸膜凹陷征等[3-4]。有研究表明,当洞壁厚度小于4 mm时,92%病灶为良性,洞壁厚度介于5~15 mm之间时,恶性比例为49%,而当洞壁大于15 mm时,95%病灶为恶性,提示洞壁厚薄是鉴别肺部空洞病变良恶性的重要依据[5]。在本研究中,所有空洞型肺癌均为厚壁空洞,与文献报道相符。但干酪物质尚未完全排出的结核性空洞或急性期肺脓肿等病变,也可表现为内壁不规则的厚壁空洞,易与空洞型肺癌CT征象相互混淆[6]。此外,空洞型肺癌虽多为厚壁空洞,但薄壁空洞肺癌也有相关报道[7-8],可见仅仅通过洞壁厚薄鉴别空洞性病变良恶性,还有一定局限性。
18FDG PET-CT显像能够同时提供病灶的代谢信息及解剖学信息,对肺癌的早期诊断、分期及预后评估具有重要意义。最大标准摄取值(SUVmax)是PET-CT显像最常用的代谢活性参数,可准确反映肿瘤葡萄糖代谢的活跃程度,是鉴别病变良恶性的重要指标[9]。多数学者将SUVmax=2.5作为鉴别肺部病灶良恶性的临界值[10-11]。在本研究中,35例空洞型肺癌患者病灶SUVmax平均值为10.64 ± 5.00,显著大于2.5。但也有学者认为鉴别病灶良恶性的SUVmax临界值不应局限于2.5。Grgic等[12]将SUV max值定为4.0时,诊断孤立性肺结节良恶性的准确性最高。王少雁的研究则显示,当SUVmax为2.99时,PET-CT诊断肺癌的假阳性及假阴性率最低,而当SUVmax为2.50时,假阴性率增高,较SUVmax为2.99时诊断一致性降低[13]。因此,关于诊断肺部病灶良恶性的SUVmax最佳临界值还有待进一步研究。
有研究显示SUVmax与肺癌病理类型相关,即鳞癌的SUVmax要高于腺癌,而腺癌高于肺泡细胞癌[14]。在本研究中,鳞癌组病灶SUVmax显著大于腺癌组(P<0.05),与文献报道一致。Ong等研究表明,肺癌的FDG摄取与葡萄糖转运蛋白表达有关,鳞癌细胞的葡萄糖转运蛋白表达要高于腺癌,从而导致肺鳞癌SUVmax高于腺癌[15]。同时,本研究还发现2组病变在大小上存在明显差异,即空洞型鳞癌的肿瘤最大径及空洞壁厚度最大径,均显著大于空洞型腺癌。有学者认为,肺鳞癌肿瘤倍增时间短,呈浸润性生长,故病灶一般较大,形成的空洞壁相对较厚,而腺癌倍增时间相对较长,且较小的肿瘤即可形成空洞,因此病灶发现时常相对较小且洞壁较薄[16]。此外,多项研究还表明SUVmax与肿瘤大小存在一定关联。刘芳蕾等研究显示肺部病灶SUVmax与其直径呈正相关,即直径>2 cm病灶SUVmax显著大于直径≤2 cm的病灶[17]。同样,张静等通过Pearson相关分析亦发现PET-CT SUVmax与肿瘤大小呈明显正相关(r=0.339,P<0.01)[18]。本研究将病灶按大小进行分组,结果显示<3 cm病灶的SUVmax显著低于≥3 cm的病灶(P<0.05),提示病灶大者,其FDG浓聚程度也高。
空洞型肺癌主要与肺结核及肺脓肿空洞鉴别诊断。与癌性空洞相比,结核空洞外缘清晰,内壁光滑,壁厚薄均匀,有时病灶边缘亦可见毛刺;肺脓肿空洞边缘模糊,内壁光整,一般可见液平面,周围见炎性渗出。在PET-CT显像中,由于活动性肺结核、肺脓肿,葡萄糖代谢高于正常,致其空洞壁FDG代谢增高,表现为高摄取空洞型肿块,有时与空洞型肺癌难以鉴别[19]。此外,有病案报道IgG4相关性肺疾病在PET-CT上也可表现为高代谢厚壁空洞肿块,与空洞型肺癌征象相似[20]。有研究显示,将PET-CT与肿瘤标志物联合能显著提高对肺癌诊断的准确性及灵敏性,有效降低假阳性及假阴性[21-22]。因此,如果能将PET-CT与血清肿瘤标志物联合,则可能进一步提高对空洞型肺癌诊断的准确性。

