玉米||大豆间作对AMF时空变化的影响*
赵德强, 元晋川, 侯玉婷, 李 彤, 廖允成
玉米||大豆间作对AMF时空变化的影响*
赵德强, 元晋川, 侯玉婷, 李 彤, 廖允成**
(西北农林科技大学农学院 杨凌 712100)
为探究农田生态系统中不同种植模式下丛枝菌根真菌(AMF)生长发育及产生孢子和球囊霉素状况, 本试验设置两种结构的间作模式(6M6S: 6行玉米与6行大豆间作; 3M3S: 3行玉米与3行大豆间作)以及单作玉米(CKM)和单作大豆(CKS)4个处理, 分析不同种植模式对AMF生长时空变化的影响。结果表明: 菌根侵染率、侵染密度和菌丝密度随着AMF与作物共生期延长逐渐增加,丛枝丰度呈现先增加后减少的趋势。两年试验中, 玉米乳熟期(大豆鼓粒期), 3M3S处理的菌根侵染率、侵染密度和丛枝丰度, 土壤孢子密度、易提取球囊霉素含量和总球囊霉素含量均显著高于单作。在作物生育期内, AMF的孢子密度从269.40个·(100g)-1增加至1 484.20个·(100g)-1, 易提取球囊霉素含量从430.88 μg·g-1增加至600.78 μg·g-1, 总球囊霉素含量从942.59 μg·g-1增加至1 304.03 μg·g-1。玉米乳熟期, 间作边行玉米的菌丝密度、孢子密度、易提取球囊霉素和总球囊霉素含量最高; 大豆鼓粒期, 间作边行大豆的菌丝密度和易提取球囊霉素含量最高, 孢子密度最低。相关性分析表明, 总球囊霉素和易提取球囊霉素与菌丝密度呈极显著正相关, 相关系数分别达0.71和0.73; 孢子密度和菌丝密度与侵染率呈极显著正相关, 相关系数分别达0.72和0.75。因此, 农田生境中AMF能与根系建立良好的共生关系, 并随着季节变化和作物生长呈现周期性变化。间作促进了AMF的侵染, 增加了球囊霉素和孢子的产量, 间作处理中AMF与各行作物共生表现出边际效应。3M3S处理是最有利于AMF生长的种植模式。
玉米||大豆间作; 丛枝菌根真菌; 侵染率; 球囊霉素; 孢子
菌根真菌(AMF)属于专性寄生真菌, 能够与大部分陆生植物建立共生关系。与植物根系相比, AMF纤细的菌丝和更强的分泌有机酸的能力能够深入土壤团聚体中吸收矿质养分, 改善寄主养分状况[1-2]。AMF菌丝构建的菌丝网络在调节植物间相互作用和信息交流等方面具有重要作用, 如促进优势群体和缓解劣势群体[3]。AMF菌丝和孢子壁上有球囊霉素蛋白, 随菌丝腐解和孢子壁脱落进入土壤后黏结土壤颗粒, 在提高土壤质量方面有重要作用[4]。AMF以外来者身份侵入植物根系, 其生长发育受到自身、植物和土壤等多方面影响。前人研究发现, 随着四季交替AMF生长发生明显的周期性变化, 如侵染率和丛枝结构在夏季达最高, 春秋季则较低[5-6]; 还发现寄主植物生长和衰老也会影响AMF生长, 如菌丝密度随着植物生长和衰老在晚春和初秋形成两次高峰[7]。前人关于球囊霉素的研究认为, 由于AMF种类不同或生长状况不同, 分泌的球囊霉素蛋白的量有差异[8]; 受人为因素影响, 球囊霉素含量在原始林中较高, 在人工林和农田中较低[9]; 此外由于球囊霉素蛋白进入土壤前附着于AMF菌丝上, 因此与菌丝生长和分解有密切联系[10]。前人集中于非人工生态系统的研究在AMF调节植物群落[11-12]、抵御外来入侵植物[13]等方面得出了重要理论, 但关于农田生态系统中AMF生长周期性变化的研究罕见报道; 此外关于球囊霉素的研究多集中于性质和功能等方面[14-17], 而对于土壤球囊霉素含量的周期性变化及与AMF生长相关性的研究较少。
玉米()和大豆()是我国重要的粮食和油料作物, 在间作种植模式下可以提高农田生态系统稳定性和土地生产效率[18]。玉米和大豆是AMF良好的寄主[19], 在不同种植模式下作物会对AMF生长产生影响[20]。因此, 本研究设置玉米和大豆两个单作处理以及两个不同结构的间作处理, 揭示农田生境中AMF与作物的共生规律, 结合土壤AMF孢子数量和球囊霉素含量的变化, 探明不同种植模式农田生态系统中AMF生长发育和土壤球囊霉素的周期性变化规律及相关性, 为AMF菌肥生产和使用提供理论指导。
1 材料与方法
1.1 试验地概况

1.2 试验设计
如图1所示, 试验设置4个处理: 6行玉米6行大豆间作(6M6S)、3行玉米3行大豆间作(3M3S)、单作玉米(CKM)和单作大豆(CKS), 重复3次, 小区面积为22 m´6 m=132 m2。间作处理中, 玉米带和大豆带相邻各行依次记为边行、中行和内行。
供试品种为‘陕单609’(玉米)和‘陕豆125’(大豆), 两种作物同时于2017年6月18日和2018年6月15日播种, 于2017年9月22日和2018年9月22日收获, 共生期在两年分别为96 d和99 d。采用穴播的方式, 玉米和大豆的行距均为60 cm、株距均为15 cm, 玉米带和大豆带之间的距离为60 cm。供试肥料为尿素、磷酸二铵、硫酸钾, 于整地前撒施, 施肥量为180 kg(N)·hm-2、58 kg(P2O5)·hm-2和30 kg(K2O)·hm-2。试验小区种植按照玉米大豆自西向东依次安排, 保证大豆的光照条件。
1.3 测定项目和方法
于玉米(大豆)的拔节期(分枝期)、吐丝期(盛花期)和乳熟期(鼓粒期)取样。间作处理的每行选取4株植株, 单作处理共选取4株植株, 在离植株15 cm处打土钻(取样位置见图1), 取0~20 cm土壤用于测定菌丝密度和孢子密度; 将植株根系挖出, 选取≤2 mm的根系30根, 洗净后保存于FAA中用于测定侵染率、侵染密度和丛枝丰度。
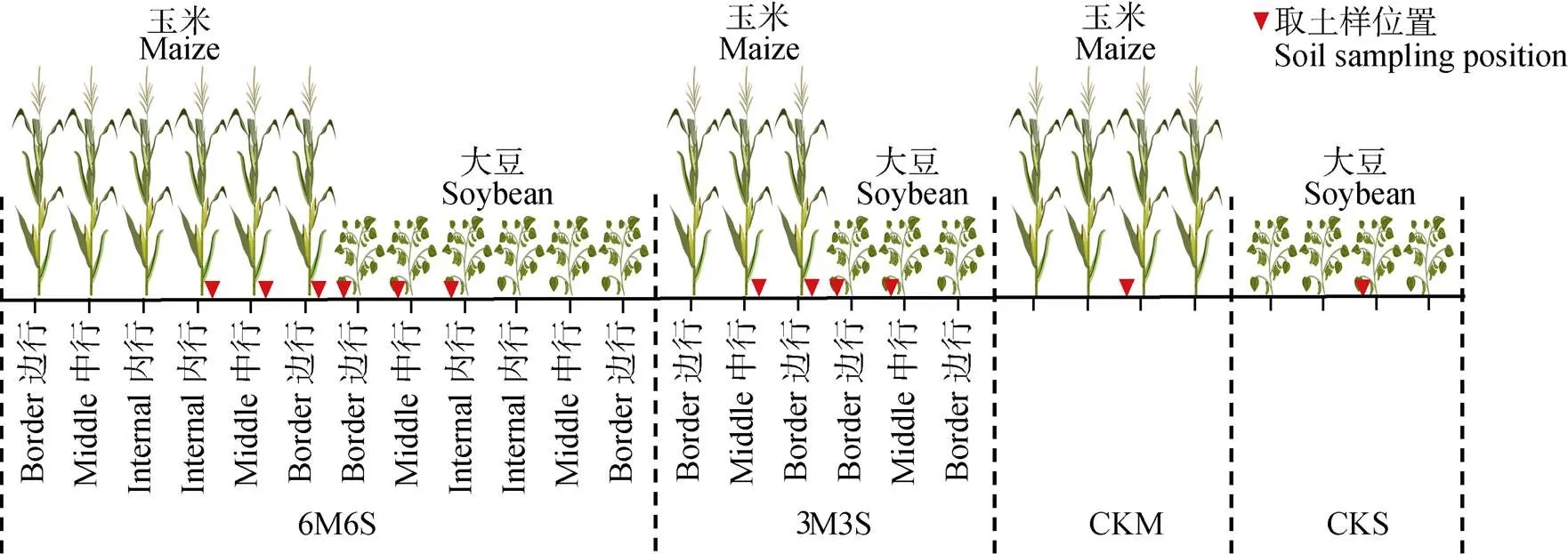
图1 不同处理玉米、大豆间作及单作种植和取样示意图
6M6S: 6行玉米与6行大豆间作; 3M3S: 3行玉米与3行大豆间作; CKM: 单作玉米; CKS: 单作大豆。6M6S: 6 rows of maize intercropped with 6 rows of soybean; 3M3S: 3 rows of maize intercropped with 3 rows of soybean; CKM: monoculture of maize crop; CKS: monoculture of soybean.
按照Trouvelot等[21]建立的侵染强度分级法将被侵染的根段分为5级, 再根据是否有丛枝结构将每一级细分为4级, 将数据输入MYCOCALC软件计算得到侵染率、侵染密度和丛枝丰度。侵染率为所有含AMF的根数与整个根系根数的比值, 表示AMF的侵染能力; 侵染密度为整个根系被AMF侵染的程度, 表示AMF在根系内的发育情况; 丛枝丰度为整个根系丛枝结构的丰富度, 表示AMF与寄主物质交换能力。
用网格交叉法[22]测定土壤中的菌丝密度, 用湿筛倾柱法[23]测定土壤中的孢子密度。用Wright等[24]的方法提取易提取球囊霉素和总球囊霉素, 用Wright等[10]的方法测定其含量。
1.4 数据分析
用Excel 2017进行数据整理, 用MYCOCALC软件计算AMF侵染的各项参数, 用SPSS 19进行数据方差分析和相关性分析, 用Excel 2017和Origin 8绘图。
2 结果与分析
2.1 玉米大豆间作条件下AMF侵染规律
玉米和大豆的侵染率随着生育期推进逐渐增加(图2), 在乳熟期和鼓粒期时两年均值分别达68.97%和61.89%。两年结果均表明间作提高了根系侵染率, 其中3M3S处理最高, 乳熟期和鼓粒期时玉米和大豆分别比单作高27.24%和25.69%, 差异达显著水平。与2017年相比, 2018年玉米乳熟期和大豆鼓粒期时的侵染率分别提高10.57%和5.72%。两年试验中, 玉米的侵染率均高于大豆, 拔节期、吐丝期和乳熟期时两年均值分别平均高14.57%、11.39%和11.44%。
玉米和大豆的菌根丛枝丰度表现为先升高后下降的趋势, 在吐丝期和盛花期时两年均值分别达27.10%和17.15%(图3)。两年试验中, 与CKM相比, 间作提高了玉米根系的丛枝丰度, 其中与3M3S处理之间的差异达显著水平; 与CKS相比, 在盛花期和鼓粒期时, 3M3S处理显著提高了大豆根系的丛枝丰度, 6M6S处理则表现为降低, 但差异不显著。与2017年相比, 2018年玉米乳熟期和大豆鼓粒期时的菌根丛枝丰度分别提高13.27%和12.85%。玉米的侵染率均高于大豆, 拔节期、吐丝期和乳熟期时两年均值分别高25.34%、50.87%和25.59%。
玉米和大豆的侵染密度在吐丝期和盛花期时增长较快, 在乳熟期和鼓粒期增长较慢(图4)。两年结果均表明, 间作提高了两种作物根系的侵染密度, 其中3M3S处理最高, 显著高于CKM。与2017年相比, 2018年玉米乳熟期和大豆鼓粒期时的侵染密度分别提高22.11%和5.81%。玉米的侵染密度均高于大豆, 拔节期、吐丝期和乳熟期时两年均值分别高15.07%、25.10%和25.56%。
2.2 农田生境中玉米||大豆间作下AMF菌丝密度和孢子密度的时空变化
玉米带和大豆带的菌丝密度随着生育期推进逐渐增加(图5), 在乳熟期和鼓粒期两年均值分别为25.11 m·g-1和19.98 m·g-1。间作提高了玉米带的菌丝密度, 其中3M3S处理最高, 乳熟期时两年均值比CKM处理显著提高54.28%, 比6M6S处理玉米带提高15.16%, 但差异不显著。2017年, 间作大豆带菌丝密度与CKS差异不显著, 其中只有3M3S处理高于CKS; 2018年, 盛花期和鼓粒期间作处理大豆带菌丝密度均高于CKS, 其中3M3S处理与CKS之间差异显著。与2017年相比, 2018年玉米乳熟期和大豆鼓粒期的菌丝密度分别提高34.23%和28.87%。玉米带菌丝密度均高于大豆带, 拔节期、吐丝期和乳熟期两年均值分别高34.80%、28.16%和25.68%。
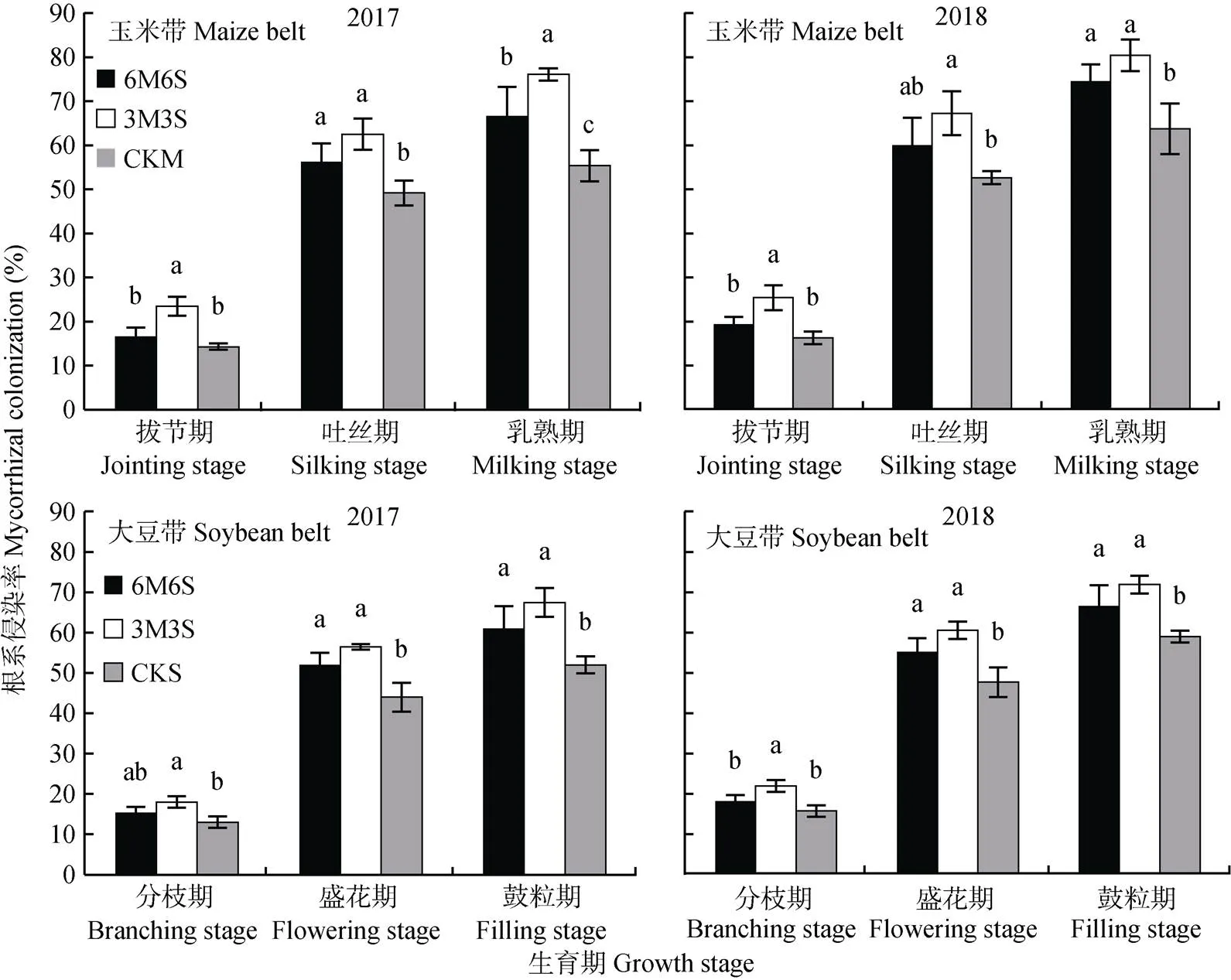
图2 2017年和2018年玉米||大豆间作系统的AMF侵染状况
不同小写字母表示同一生育期不同种植模式间<0.05水平差异显著。6M6S: 6行玉米与6行大豆间作; 3M3S: 3行玉米与3行大豆间作; CKM: 单作玉米; CKS: 单作大豆。Different lowercase letters mean significant differences at< 0.05. 6M6S: 6 rows of maize intercropped with 6 rows of soybean; 3M3S: 3 rows of maize intercropped with 3 rows of soybean; CKM: monoculture of maize; CKS: monoculture of soybean.

图3 2017年和2018年玉米||大豆间作系统的AMF菌根丛枝丰度
不同小写字母表示同一生育期不同种植模式间<0.05水平差异显著。6M6S: 6行玉米与6行大豆间作; 3M3S: 3行玉米与3行大豆间作; CKM: 单作玉米; CKS: 单作大豆。Different lowercase letters mean significant differences at< 0.05. 6M6S: 6 rows of maize intercropped with 6 rows of soybean; 3M3S: 3 rows of maize intercropped with 3 rows of soybean; CKM: monoculture of maize; CKS: monoculture of soybean.

图4 2017年和2018年玉米||大豆间作系统的AMF侵染密度
不同小写字母表示同一生育期不同种植模式间<0.05水平差异显著。6M6S: 6行玉米与6行大豆间作; 3M3S: 3行玉米与3行大豆间作; CKM: 单作玉米; CKS: 单作大豆。Different lowercase letters mean significant differences at< 0.05. 6M6S: 6 rows of maize intercropped with 6 rows of soybean; 3M3S: 3 rows of maize intercropped with 3 rows of soybean; CKM: monoculture of maize; CKS: monoculture of soybean.
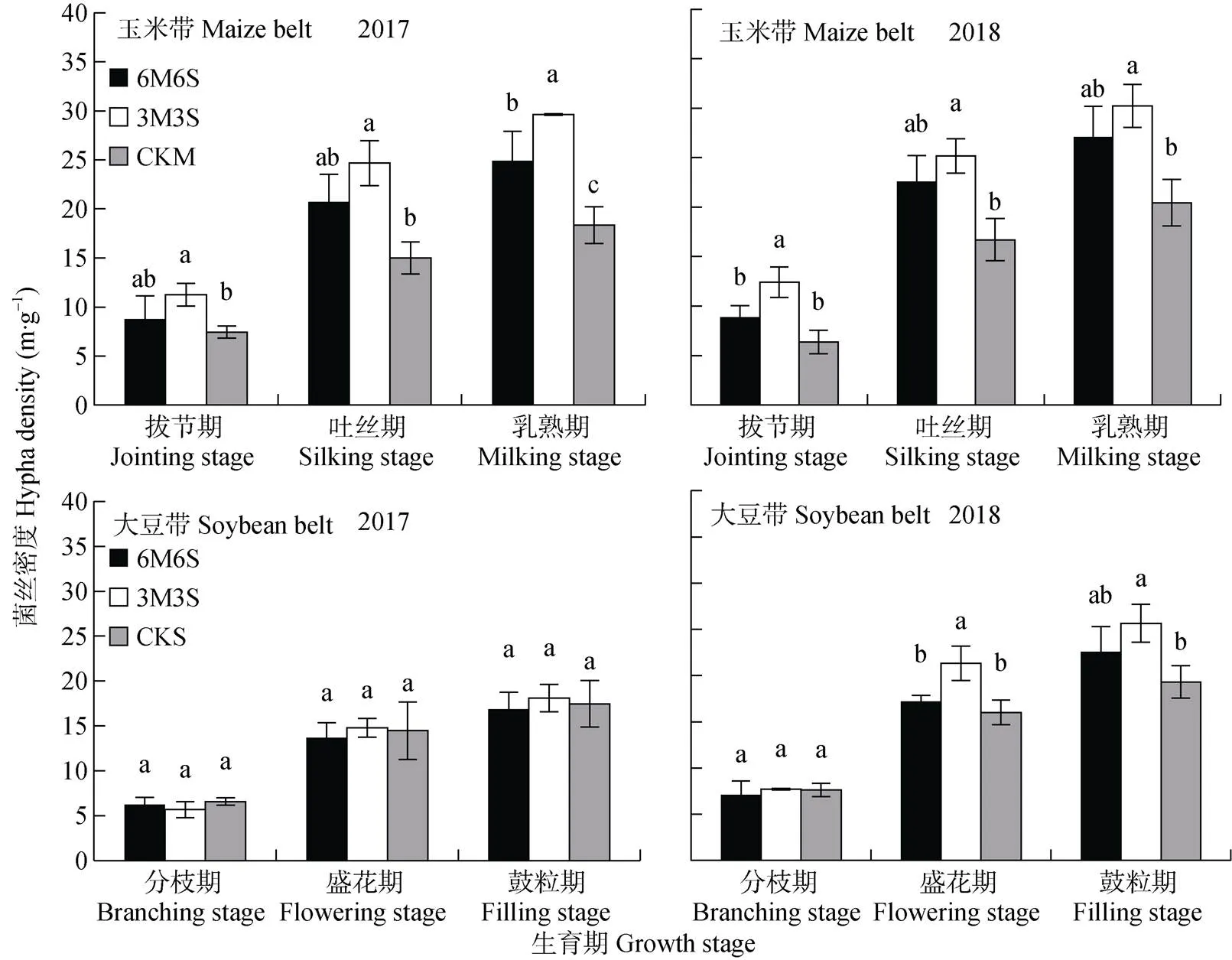
图5 2017年和2018年玉米||大豆间作系统的AMF菌丝密度
不同小写字母表示同一生育期不同种植模式间<0.05水平差异显著。6M6S: 6行玉米与6行大豆间作, 3M3S: 3行玉米与3行大豆间作; CKM: 单作玉米; CKS: 单作大豆。Different lowercase letters mean significant differences at< 0.05. 6M6S: 6 rows of maize intercropped with 6 rows of soybean; 3M3S: 3 rows of maize intercropped with 3 rows of soybean; CKM: monoculture of maize; CKS: monoculture of soybean.
两年结果均表明, 全生育期内, 间作玉米带各行菌丝密度均高于CKM, 且表现为距离大豆带越远, 菌丝密度越小的趋势(图6); 3M3S处理的边行和中行分别比CKM高54.42%和46.43%, 6M6S处理的边行、中行和内行分别比CKM高48.44%、31.01%和12.41%。两年试验中, 大豆分枝期间作大豆带表现为距离玉米带越远, 菌丝密度越大的趋势(图6), 其中6M6S处理的边行和中行低于CKS; 而大豆鼓粒期, 间作大豆带表现为距离玉米带越远, 菌丝密度越小的趋势; 3M3S处理的边行和中行两年均值分别比CKS高34.60%和21.82%, 6M6S处理的边行、中行和内行两年均值分别比CKS高31.28%、10.39%和7.02%。
玉米带和大豆带的孢子密度随着AMF与作物共生期延长逐渐增加(图7), 各处理变化规律与菌丝密度(图5)基本一致, 玉米乳熟期和大豆鼓粒期两年平均达1 519.20个×(100g)-1和1 389.98个×(100g)-1。玉米乳熟期, 3M3S处理的孢子密度最高, 两年结果均显著高于CKM, 但只在2017年显著高于6M6S处理; 大豆鼓粒期, 3M3S处理的孢子密度也表现为最高, 两年结果均显著高于CKS, 但与6M6S处理未达到显著。与2017年相比, 2018年玉米乳熟期和大豆鼓粒期的孢子密度两年均值分别提高13.03%和9.76%。两年试验中, 玉米带的孢子密度均高于大豆带, 拔节期、吐丝期和乳熟期时两年均值分别高19.67%、8.37%和9.30%。
全生育期内间作玉米各行孢子密度均高于CKM, 且呈现随距离大豆带越远, 孢子密度越小的趋势(图8)。玉米乳熟期, 3M3S处理玉米边行和中行的孢子密度两年均值分别比CKM高32.83%和27.54%, 6M6S处理玉米的边行、中行和内行两年均值分别比CKM高26.48%、16.94%和10.06%。两年试验中, 分枝期和盛花期间作大豆各行呈现距离玉米带越远, 孢子密度越大的趋势(图8)。鼓粒期, 3M3S处理的边行和中行两年均值比CKS高10.04%和27.73%, 6M6S处理的边行、中行和内行, 两年均值分别比CKS高10.99%、23.88%和15.38%。
2.3 玉米大豆间作条件下球囊霉素的时空变化
如图9所示, 2017年和2018年乳熟期(鼓粒期)较拔节期(分枝期)玉米带易提取球囊霉素含量分别平均增加161.22 μg×g-1和180.31 μg×g-1, 大豆带易提取球囊霉素含量分别增加117.16 μg×g-1和195.48 μg×g-1; 玉米带和大豆带2018年比2017年分别增加21.43 μg×g-1和37.71 μg×g-1。两年试验中, 在全生育期内玉米带和大豆带的易提取球囊霉素含量均表现为3M3S>6M6S>单作; 且玉米带易提取球囊霉素含量均高于大豆带, 拔节期、吐丝期和乳熟期两年均值分别高28.47%、29.78%和22.75%。
全生育期内间作玉米呈距离大豆带越远土壤易提取球囊霉素含量越低的趋势, 且均高于单作(图10)。乳熟期时, 3M3S处理玉米边行和中行的易提取球囊霉素含量两年均值分别比CKM高49.36%和33.26%, 6M6S处理玉米的边行、中行和内行两年均值分别比CKM高35.60%、24.78%和8.55%。两年试验中, 6M6S处理的大豆带在分枝期和盛花期呈随距离玉米带越远, 易提取球囊霉素含量越高的趋势, 其中边行大豆易提取球囊霉素含量低于CKS; 在鼓粒期, 中行大豆易提取球囊霉素含量低于边行和内行, 但均高于CKS。两年试验中, 3M3S处理的大豆带在分枝期呈随距离玉米带越远易提取球囊霉素含量越高的趋势, 其中2017年边行大豆低于CKS; 盛花期和鼓粒期则相反, 呈现随与玉米带距离增加, 易提取球囊霉素含量逐渐降低的趋势, 各行易提取球囊霉素含量均高于CKS。
各处理的土壤总球囊霉素含量的变化规律(图11), 与易提取球囊霉素含量(图9)的变化基本相同。2017年和2018年, 乳熟期(鼓粒期)较拔节期(分枝期)玉米带总球囊霉素含量分别增加430.04 μg×g-1和410.58 μg×g-1, 大豆带总球囊霉素含量分别增加309.64 μg×g-1和299.47 μg×g-1; 玉米带和大豆带2018年比2017年分别增加94.63 μg×g-1和60.57 μg×g-1。玉米带总球囊霉素含量均高于大豆带, 拔节期、吐丝期和乳熟期两年均值分别高13.38%、13.52%和16.79%。
间作处理玉米带总球囊霉素含量均表现为距离大豆带越远, 含量越低的趋势(图12), 且间作均高于单作。2017年和2018年最高的边行在乳熟期分别比CKM高37.27%和43.24%。两年试验中, 6M6S处理的大豆在分枝期和鼓粒期时总球囊霉素含量表现为中行>内行>边行; 3M3S处理的大豆带, 2017年盛花期和鼓粒期总球囊霉素含量表现为边行>中行, 2018年则表现为中行>边行。
2.4 AMF生长与土壤球囊霉素含量和孢子密度的相关性
AMF侵染根系形成丛枝结构与寄主交换营养物质, 向根外延伸菌丝吸收土壤矿质养分, 产生繁殖体厚垣孢子, 附着于菌丝上的球囊霉素蛋白随腐解释放于土壤, 它们之间关系密切(表1)。总球囊霉素、易提取球囊霉素、孢子密度、菌丝密度与菌根侵染率、侵染密度、丛枝丰度均呈正相关, 除孢子密度与丛枝丰度外, 其他相关性均达到显著。总球囊霉素和易提取球囊霉素与菌丝密度的相关性最高, 孢子密度和菌丝密度与侵染率的相关性最高。

图6 2017年和2018年玉米||大豆间作系统中AMF菌丝密度的时空变化
6M6S: 6行玉米与6行大豆间作; 3M3S: 3行玉米与3行大豆间作; CKM: 单作玉米; CKS: 单作大豆。6M6S: 6 rows of maize intercropped with 6 rows of soybean; 3M3S: 3 rows of maize intercropped with 3 rows of soybean; CKM: monoculture of maize; CKS: monoculture of soybean.
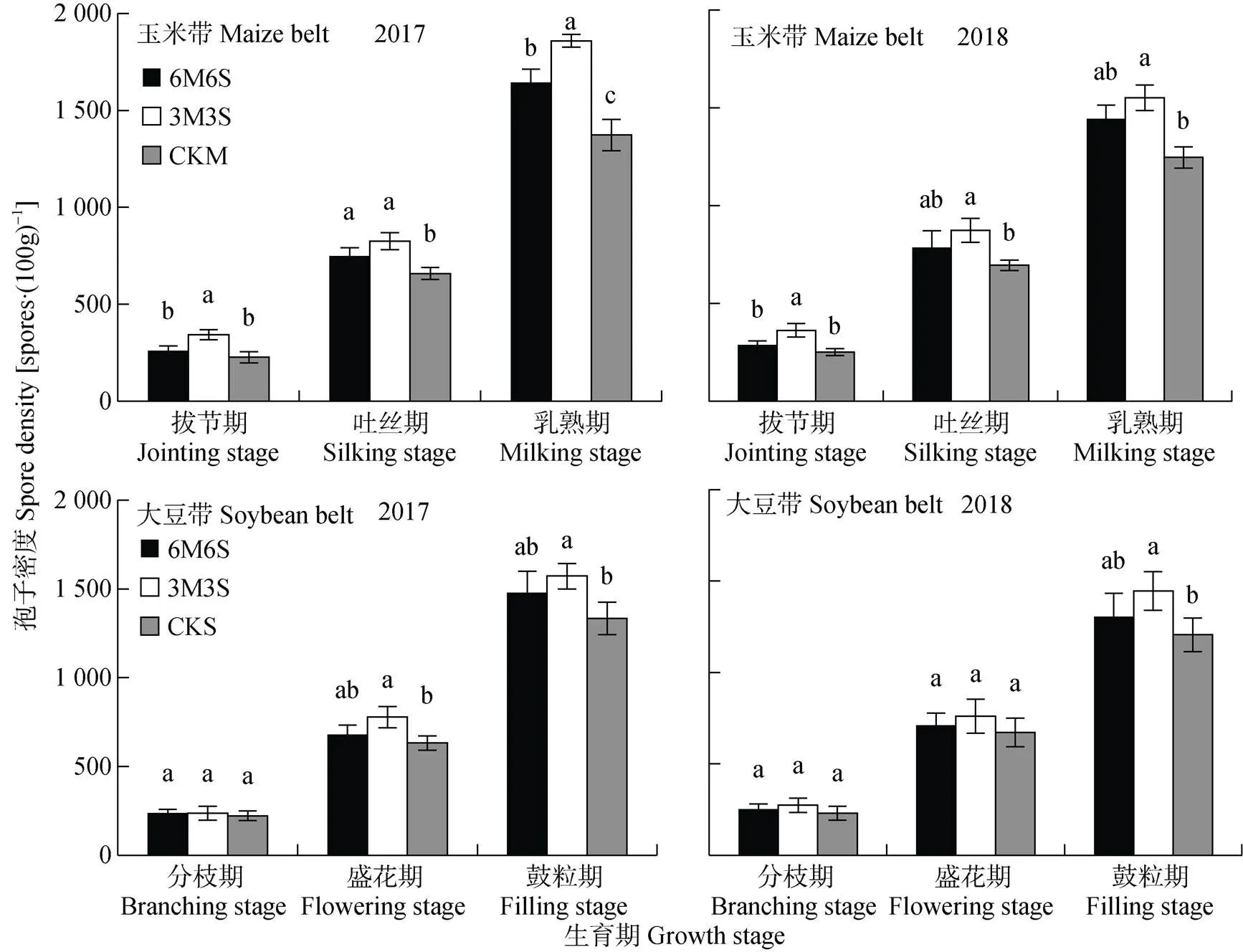
图7 2017年和2018年玉米||大豆间作系统的AMF孢子密度
不同小写字母表示同一生育期不同种植模式间<0.05水平差异显著。6M6S: 6行玉米与6行大豆间作, 3M3S: 3行玉米与3行大豆间作; CKM: 单作玉米; CKS: 单作大豆。Different lowercase letters mean significant differences at< 0.05. M6S: 6 rows of maize intercropped with 6 rows of soybean; 3M3S: 3 rows of maize intercropped with 3 rows of soybean; CKM: monoculture of maize; CKS: monoculture of soybean.

图8 2017年和2018年玉米||大豆间作系统AMF孢子密度的时空变化
6M6S: 6行玉米与6行大豆间作; 3M3S: 3行玉米与3行大豆间作; CKM: 单作玉米; CKS: 单作大豆。6M6S: 6 rows of maize intercropped with 6 rows of soybean; 3M3S: 3 rows of maize intercropped with 3 rows of soybean; CKM: monoculture of maize; CKS: monoculture of soybean.
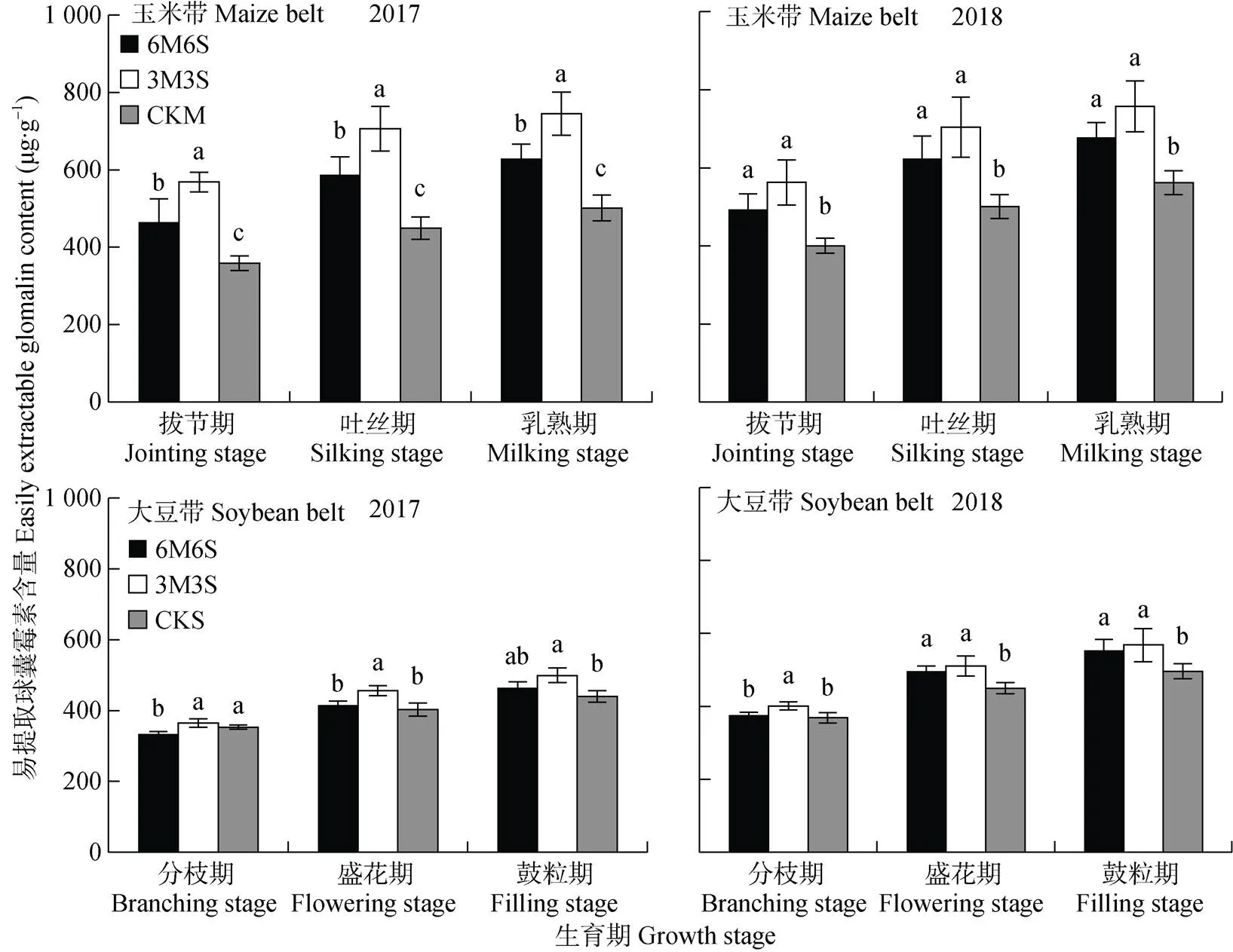
图9 2017年和2018年玉米||大豆间作系统的土壤易提取球囊霉素含量
不同小写字母表示同一生育期不同种植模式间<0.05水平差异显著。6M6S: 6行玉米与6行大豆间作; 3M3S: 3行玉米与3行大豆间作; CKM: 单作玉米; CKS: 单作大豆。Different lowercase letters mean significant differences at< 0.05. 6M6S: 6 rows of maize intercropped with 6 rows of soybean; 3M3S: 3 rows of maize intercropped with 3 rows of soybean; CKM: monoculture of maize; CKS: monoculture of soybean.
3 讨论与结论
3.1 农田生境中AMF生长变化规律
本研究中AMF与根系建立了良好的共生关系, 随着与作物共生期延长, AMF的侵染率、侵染密度和菌丝密度逐渐提高, 这与李媛媛等[19]研究结果一致, 且在玉米拔节期至吐丝期(大豆分枝期至盛花期)的增加量高于玉米吐丝期至乳熟期(大豆盛花期至鼓粒期)。AMF的丛枝丰度则表现为在玉米吐丝期(大豆盛花期)迅速增加, 之后缓慢降低。在玉米和大豆的吐丝期和盛花期, 迅速增加的根系生物量[25]以及AMF侵染率和侵染密度表明AMF与作物建立了良好的共生关系且生长旺盛; AMF的丛枝结构是其与根系养分交换的场所[26], 此时期达到最高, 表明AMF与作物根系发生密集的养分交换; 作物后期菌根丛枝丰度下降并且侵染率、侵染密度和菌丝密度增长缓慢, 暗示了作物生长后期AMF与作物的交流减弱。
本研究中AMF侵染率在作物生长期呈现出一直增加的趋势, 这与Mandyam等[7]在草地的研究发现多年生植物的AMF侵染率随着四季呈现周期性变化的规律不同。这是由于农田生态环境中植物多为1年生农作物, 本研究只探究了作物生长旺盛时期, 根系活力较高时的共生状况, 作物乳熟期以后, 植株逐渐枯死, 根系逐渐失去活力, AMF营养体势必逐渐凋亡。本研究中根系侵染率小于李媛媛等[19]的盆栽试验, 这可能是由于农田生境中, 部分土壤生物以AMF孢子和菌丝为食, 破坏了AMF繁殖体和营养器官[27]; 此外盆栽试验中土壤经过高温或辐射灭菌, 部分试验还额外接种AMF繁殖体。这也暗示农田生境中作物侵染率有望继续增加, 为作物养分吸收提供支持。2018年试验中, AMF的侵染率、侵染密度和丛枝丰度较高, 可能是由于降雨量多造成的, Candido等[28]研究发现土壤含水量较高有利于AMF的侵染和生长。
3.2 农田生境中玉米||大豆间作对AMF生长的影响
作为AMF优良的寄主作物, 本研究中玉米和大豆均与AMF形成了良好的共生关系, 且与单作相比, 间作提高了AMF的侵染率, 这是由于不同作物相间种植丰富了农田生态系统物种丰富度, 有利于AMF对寄主的选择和寄生[29]。Hiiesalu等[30]的研究结果也表明, 在物种更丰富的草地和森林生态系统中, AMF侵染率更高。AMF的丛枝结构和根外菌丝是其获取养分的器官[31], 本研究中间作处理的丛枝丰度和菌丝密度均高于单作处理, 这可能是由于间作条件下作物生长旺盛、根系发达, 能将更多的碳水化合物供给AMF生长发育。
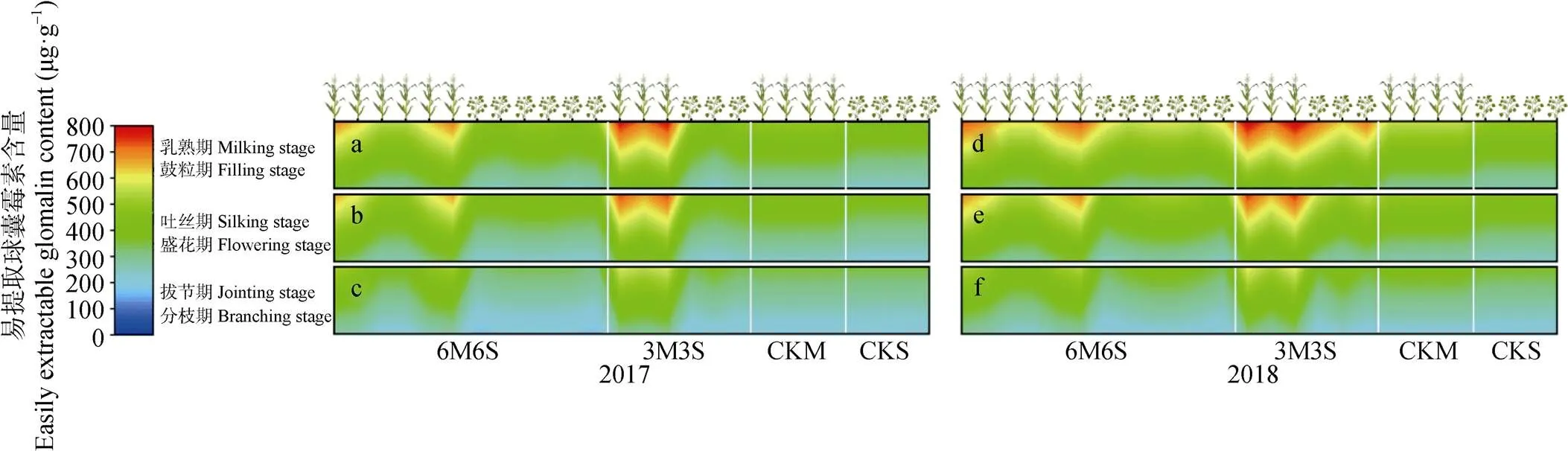
图10 2017年和2018年玉米||大豆间作系统土壤易提取球囊霉素含量的时空变化
6M6S: 6行玉米与6行大豆间作; 3M3S: 3行玉米与3行大豆间作; CKM: 单作玉米; CKS: 单作大豆。6M6S: 6 rows of maize intercropped with 6 rows of soybean; 3M3S: 3 rows of maize intercropped with 3 rows of soybean; CKM: monoculture of maize; CKS: monoculture of soybean.
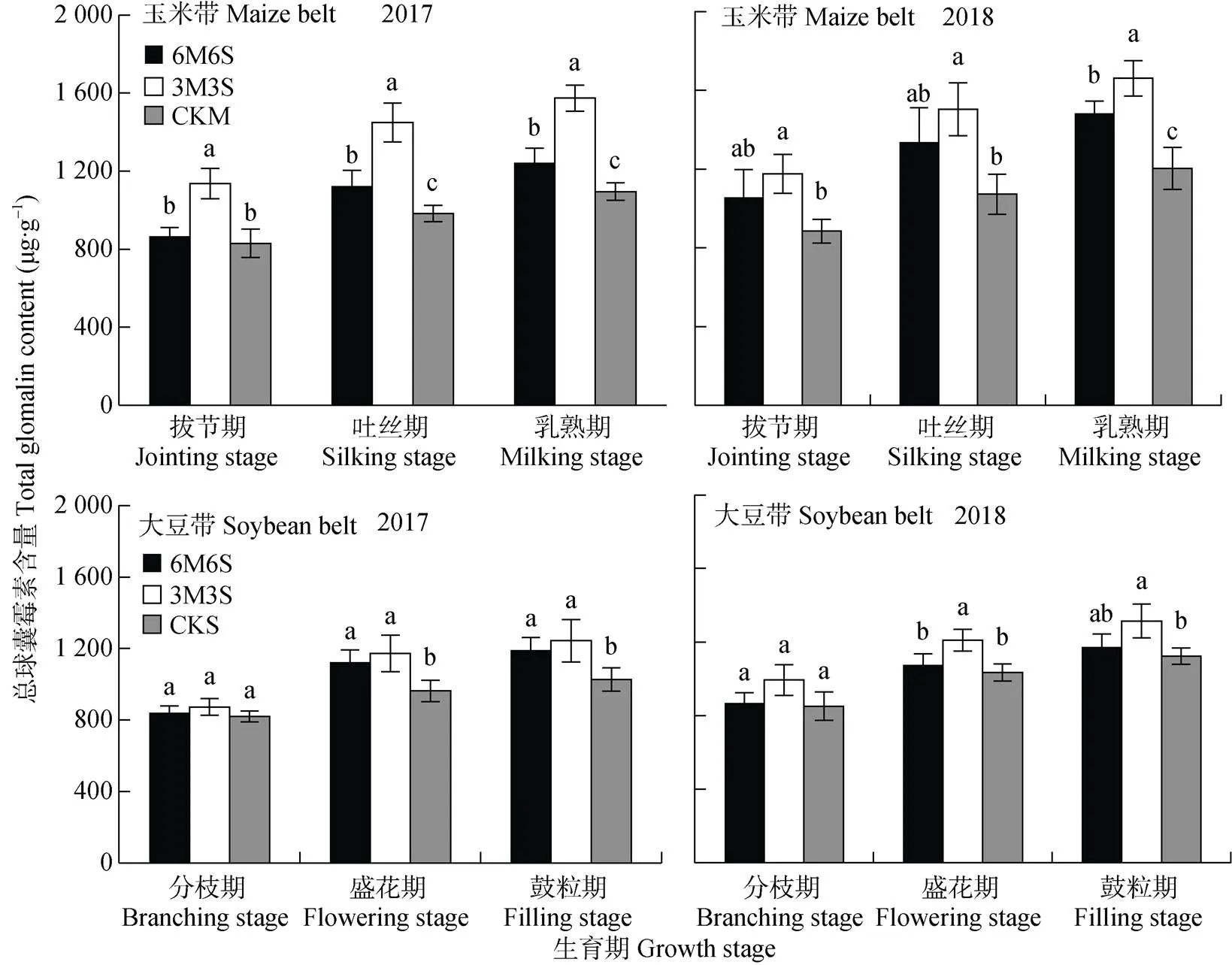
图11 2017年和2018年玉米||大豆间作系统的土壤总球囊霉素含量
不同小写字母表示同一生育期不同种植模式间<0.05水平差异显著。6M6S: 6行玉米与6行大豆间作; 3M3S: 3行玉米与3行大豆间作; CKM: 单作玉米; CKS: 单作大豆。Different lowercase letters mean significant differences at< 0.05. 6M6S: 6 rows of maize intercropped with 6 rows of soybean; 3M3S: 3 rows of maize intercropped with 3 rows of soybean; CKM: monoculture of maize; CKS: monoculture of soybean.

图12 2017年和2018年玉米||大豆间作系统中土壤总球囊霉素含量的时空变化
6M6S: 6行玉米与6行大豆间作; 3M3S: 3行玉米与3行大豆间作; CKM: 单作玉米; CKS: 单作大豆。6M6S: 6 rows of maize intercropped with 6 rows of soybean; 3M3S: 3 rows of maize intercropped with 3 rows of soybean; CKM: monoculture of maize; CKS: monoculture of soybean.
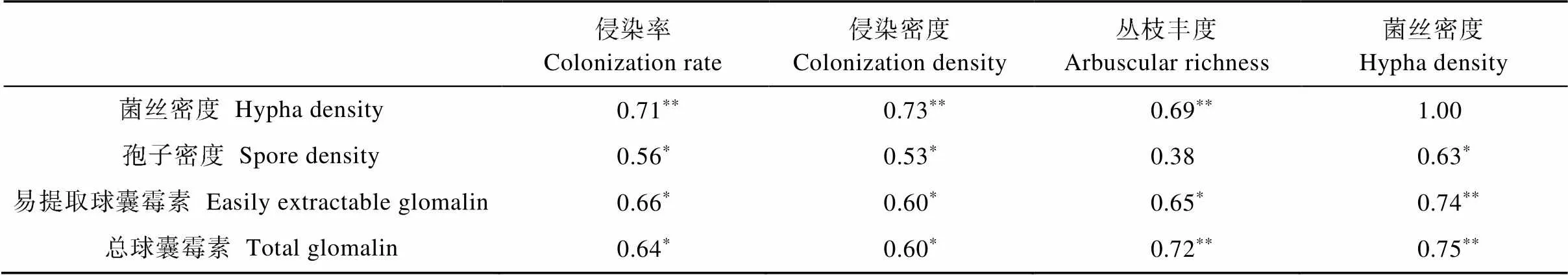
表1 AMF生长与球囊霉素的相关性分析
表中数据为相关系数, *和**分别表示<0.05和<0.01水平显著相关。Data in the table is correlation coefficient. * and ** mean signficant correlation at< 0.05 and< 0.01, respectively.
本研究中, 间作玉米具有较高的侵染率、侵染密度、丛枝丰度和菌丝密度, 这与Mcgonigle等[32]的研究结果一致。这主要是由于玉米发达的根系提高了寄主与萌发孢子接触的效率[33], 此外AMF最初侵染的位置是幼嫩的细根[19], 玉米的须根系有利于AMF侵染。分枝期时边行大豆较低的菌丝密度可能是由于间作减少了大豆根系供给AMF赖以生存的碳水化合物导致的[34]; 而盛花期和鼓粒期时边行大豆较高的菌丝密度是边行玉米菌根的菌丝延伸所导致, 因为根外菌丝可向外延伸120 cm[35], 玉米带较高的菌丝势必会伸长至大豆带。
3.3 农田生境中玉米||大豆间作对AMF产生孢子的影响
AMF生活史包括植物根系分泌独脚金内酯等萌发因子促进孢子萌发, 侵入根系后形成丛枝结构, 再向根外延伸菌丝, 菌丝发育产生孢子[36]。Li等[37]研究发现只有不到6%的孢子有机会发育成菌根, 定植的启动孢子密度为500个×(100g)-1。本研究中玉米拔节期和大豆分枝期孢子密度小于此值, 是由于此时孢子大部分已经萌发, 玉米乳熟期和大豆鼓粒期孢子密度远远高于此值。本研究中孢子密度与侵染率和菌丝密度的相关系数分别达0.88和0.84, 表明它们密切相关, Li等[37]研究结果与之类似。但Cardoso等[38]的研究认为孢子密度与侵染率和菌丝密度没有很强的相关性, 这可能是由于本试验中玉米和大豆是AMF很好的寄主, 有利于AMF生长和产生孢子。
农田生境中, 随着AMF与作物共生时间推进, 孢子数量呈增加趋势, 尤其是作物生长后期(吐丝期至乳熟期或盛花期至鼓粒期)增加迅速, 这与Fontenla等[39]在森林中的研究结果一致。这是由于随着作物进入衰老或休眠期, 会刺激AMF形成更多的孢子。本研究中玉米带的孢子密度总是高于大豆带, 李媛媛等[19]研究也发现, 用玉米作为寄主植物扩繁AMF, 会比豆科植物产生更多的孢子, 这与玉米根生物量大密切相关。两个间作处理中, 玉米带孢子密度呈现随与大豆带距离增加, 密度降低的趋势, 这与Ren等[40]对玉米||大豆间作系统中玉米干物质积累的规律一致, 因此认为AMF孢子产生受寄主植物生长状况影响, 寄主玉米生长旺盛, 将更多的光合产物运输至AMF, 有利于产生更多的孢子。
3.4 农田生境中玉米||大豆间作对AMF产生球囊霉素的影响
球囊霉素为AMF菌丝特异性产生的一类热激蛋白, 结构稳定[20], 对提高土壤质量有重要意义。玉米||大豆间作提高了土壤球囊霉素含量, 其中玉米带含量远高于大豆带含量, 这与间作提高作物生物量, 有利于AMF获取更多光合产物密不可分。Rillig等[41]认为易提取球囊霉素附着于菌丝和孢子上, 未与土壤颗粒紧密结合, 其含量与菌丝生长状况密切相关。本研究中各行易提取球囊霉素含量变化规律与菌丝密度一致, 鼓粒期边行大豆土壤易提取球囊霉素含量高于中行和内行, 是由于邻近的玉米菌根菌丝延伸释放球囊霉素蛋白所致。
本研究中易提取球囊霉素和总球囊霉素与侵染率和菌丝密度密切相关, 相关系数达0.51以上, 这与Driver等[4]的研究结果一致。农田生境中, 易提取球囊霉素含量和总球囊霉素含量保持增加, 但是年际间只增长29.57 μg×g-1和77.60 μg×g-1, 这与Rillig等[42]发现球囊霉素在土壤中稳定存在6~42年的结果相差较大, 这可能是由于不同于室内培养试验, 农田生境中土壤动物会取食球囊霉素, 造成球囊霉素年际保存率较低; 也可能是由于提取方法缺陷, 提取的球囊霉素上清液包含其他杂质蛋白质, 造成球囊霉素测定值偏高, 只适用于相同试验条件下相对含量的比较, 不适用于绝对含量比较[43]。
综上所述, 农田生境中AMF能够与作物形成良好的共生关系, 菌根的侵染率、侵染密度和丛枝丰度随着共生期延长呈上升趋势, 此外玉米由于根系生物量大, 质地柔软, 更有利于AMF寄生。土壤菌丝密度、孢子密度、球囊霉素含量与AMF生长状况密切相关, 并随着作物生长和环境变化具有明显的周期性规律, 在间作条件下还表现出边际效应。玉米||大豆间作促进了AMF与作物共生, AMF生长受寄主作物生长状况影响, 寄主植物生长旺盛有利于AMF菌丝延伸和孢子的产生, 增加易提取球囊霉素和总球囊霉素的产量。
[1] Hodge A, Helgason T, Fitter A H. Nutritional ecology of arbuscular mycorrhizal fungi[J]. Fungal Ecology, 2010, 3(4): 267–273
[2] Parniske M. Arbuscular mycorrhiza: The mother of plant root endosymbioses[J]. Nature Reviews Microbiology, 2008, 6(10): 763–775
[3] Workman R E, Cruzan M B. Common mycelial networks impact competition in an invasive grass[J]. American Journal of Botany, 2016, 103(6): 1041–1049
[4] Driver J D, Holben W E, Rillig M C. Characterization of glomalin as a hyphal wall component of arbuscular mycorrhizal fungi[J]. Soil Biology and Biochemistry, 2005, 37(1): 101–106
[5] Reinhardt D R, Miller R M. Size classes of root diameter and mycorrhizal fungal colonization in two temperate grassland communities[J]. New Phytologist, 1990, 116(1): 129–136
[6] Sanders I R, Fitter A H. The ecology and functioning of vesicular — arbuscular mycorrhizas in co-existing grassland species: I. Seasonal patterns of mycorrhizal occurrence and morphology[J]. New Phytologist, 1992, 120(4): 517–524
[7] Mandyam K, Jumpponen A. Seasonal and temporal dynamics of arbuscular mycorrhizal and dark septate endophytic fungi in a tallgrass prairie ecosystem are minimally affected by nitrogen enrichment[J]. Mycorrhiza, 2008, 18(3): 145–155
[8] 唐宏亮, 刘龙, 王莉, 等. 土地利用方式对球囊霉素土层分布的影响[J]. 中国生态农业学报, 2009, 17(6): 1137–1142Tang H L, Liu L, Wang L, et al. Effect of land use type on profile distribution of glomalin[J]. Chinese Journal of Eco-Agriculture, 2009, 17(6): 1137–1142
[9] Wang Q, Wang W j, He X y, et al. Role and variation of the amount and composition of glomalin in soil properties in farmland and adjacent plantations with reference to a primary forest in North-Eastern China[J]. PLoS One, 2015, 10(10): e0139623
[10] Wright S F, Upadhyaya A. A survey of soils for aggregate stability and glomalin, a glycoprotein produced by hyphae of arbuscular mycorrhizal fungi[J]. Plant and Soil, 1998, 198(1): 97–107
[11] Hart M M, Reader R J, Klironomos J N. Plant coexistence mediated by arbuscular mycorrhizal fungi[J]. Trends in Ecology & Evolution, 2003, 18(8): 418–423
[12] Courty P E, Buée M, Diedhiou A G, et al. The role of ectomycorrhizal communities in forest ecosystem processes: New perspectives and emerging concepts[J]. Soil Biology and Biochemistry, 2010, 42(5): 679–698
[13] Zhang Q, Yang R Y, Tang J J, et al. Positive feedback between mycorrhizal fungi and plants influences plant invasion success and resistance to invasion[J]. PLoS One, 2010, 5(8): e12380
[14] Bedini S, Pellegrino E, Avio L, et al. Changes in soil aggregation and glomalin-related soil protein content as affected by the arbuscular mycorrhizal fungal speciesand[J]. Soil Biology and Biochemistry, 2009, 41(7): 1491–1496
[15] Chern E C, Tsai D W, Ogunseitan O A. Deposition of glomalin-related soil protein and sequestered toxic metals into watersheds[J]. Environmental Science & Technology, 2007, 41(10): 3566–3572
[16] Hammer E C, Rillig M C, Kirsten N. The influence of different stresses on glomalin levels in an arbuscular mycorrhizal fungus — salinity increases glomalin content[J]. PLoS One, 2011, 6(12): e28426
[17] Bedini S, Turrini A, Rigo C, et al. Molecular characterization and glomalin production of arbuscular mycorrhizal fungi colonizing a heavy metal polluted ash disposal island, downtown Venice[J]. Soil Biology and Biochemistry, 2010, 42(5): 758–765
[18] Addo-Quaye A A, Darkwa A A, Ocloo G K. Yield and productivity of component crops in a maize-soybean intercropping system as affected by time of planting and spatial arrangement[J]. Journal of Agricultural and Biological Science, 2011, 6(9): 50–57
[19] 李媛媛, 王晓娟, 豆存艳, 等. 四种宿主植物及其不同栽培密度对AM真菌扩繁的影响[J]. 草业学报, 2013, 22(5): 128–135Li Y Y, Wang X J, Dou C Y, et al. Effects of four host plants and different cultivation densities on the propagation of arbuscular mycorrhizal fungi[J]. Acta Prataculturae Sinica, 2013, 22(5): 128–135
[20] Meng L B, Zhang A Y, Wang F, et al. Arbuscular mycorrhizal fungi and rhizobium facilitate nitrogen uptake and transfer in soybean/maize intercropping system[J]. Frontiers in Plant Science, 2015, 6: 339
[21] Trouvelot A, Kough J L, Gianinazzi-Pearson V. Mesure du taux de mycorhization VA d'un système radiculaire. Recherche de méthodes d'estimation ayant une signification fonctionnelle[M]//GIANINAZZI-PEARSON V, GIANINAZZI S. Physiological and Genetical Aspects of Mycorrhizae. Paris: INRA, 1986: 217–221
[22] Abbott L K, Robson A D, De Boer G. The effect of phosphorus on the formation of hyphae in soil by the vesicular-arbuscular mycorrhizal fungus,[J]. New Phytologist, 1984, 97(3): 437–446
[23] Ianson D C, Allen M F. The effects of soil texture on extraction of vesicular-arbuscular mycorrhizal fungal spores from arid sites[J]. Mycologia, 1986, 78(2): 164–168
[24] Wright S F, Upadhyaya A. Extraction of an abundant and unusual protein from soil and comparison with hyphal protein of arbuscular mycorrhizal fungi[J]. Soil Science, 1996, 161(9): 575–586
[25] Li L, Sun J H, Zhang F S, et al. Root distribution and interactions between intercropped species[J]. Oecologia, 2006, 147(2): 280–290
[26] GIaninazzi-Pearson V. Plant cell responses to arbuscular mycorrhizal fungi: Getting to the roots of the symbiosis[J]. The Plant Cell, 1996, 8(10): 1871–1883
[27] Hodge A, Campbell C D, Fitter A H. An arbuscular mycorrhizal fungus accelerates decomposition and acquires nitrogen directly from organic material[J]. Nature, 2001, 413(6853): 297–299
[28] Candido V, Campanelli G, D’ADDABBOT, et al. Growth and yield promoting effect of artificial mycorrhization on field tomato at different irrigation regimes[J]. Scientia Horticulturae, 2015, 187: 35–43
[29] YANG H S, ZANG Y Y, YUAN Y G, et al. Selectivity by host plants affects the distribution of arbuscular mycorrhizal fungi: Evidence from ITS rDNA sequence metadata[J]. BMC Evolutionary Biology, 2012, 12: 50
[30] Hiiesalu I, Pärtel M, Davison J, et al. Species richness of arbuscular mycorrhizal fungi: Associations with grassland plant richness and biomass[J]. New Phytologist, 2014, 203(1): 233–244
[31] Smith S E, Smith F A. Structure and function of the interfaces in biotrophic symbioses as they relate to nutrient transport[J]. New Phytologist, 1990, 114(1): 1–38
[32] Mcgonigle T P, Miller M H, Young D. Mycorrhizae, crop growth, and crop phosphorus nutrition in maize-soybean rotations given various tillage treatments[J]. Plant and Soil, 1999, 210(1): 33–42
[33] Koltai H, Kapulnik Y. Arbuscular Mycorrhizas: Physiology and Function[M]. 2nd ed. Dordrecht: Springer, 2010: 47–68
[34] Prasad R B, Brook R M. Effect of varying maize densities on intercropped maize and soybean in nepal[J]. Experimental Agriculture, 2005, 41(3): 365–382
[35] Gao Y, Duan A W, Qiu X Q, et al. Distribution of roots and root length density in a maize/soybean strip intercropping system[J]. Agricultural Water Management, 2010, 98(1): 199–212
[36] Friese C F, Allen M F. The spread of VA mycorrhizal fungal hyphae in the soil: Inoculum types and external hyphal architecture[J]. Mycologia, 1991, 83(4): 409–418
[37] Li L F, Zhang Y, Zhao Z W. Arbuscular mycorrhizal colonization and spore density across different land-use types in a hot and arid ecosystem, Southwest China[J]. Journal of Plant Nutrition and Soil Science, 2007, 170(3): 419–425
[38] Cardoso I M, Boddington C, Janssen B H, et al. Distribution of mycorrhizal fungal spores in soils under agroforestry and monocultural coffee systems in Brazil[J]. Agroforestry Systems, 2003, 58(1): 33–43
[39] Fontenla S, Godoy R, Rosso P, et al. Root associations inforests and seasonal dynamics of arbuscular mycorrhizas[J]. Mycorrhiza, 1998, 8(1): 29–33
[40] Ren Y Y, Liu J J, Wang Z L, et al. Planting density and sowing proportions of maize-soybean intercrops affected competitive interactions and water-use efficiencies on the Loess Plateau, China[J]. European Journal of Agronomy, 2016, 72: 70–79
[41] Rillig M C, Mummey D L. Mycorrhizas and soil structure[J]. The New Phytologist, 2006, 171(1): 41–53
[42] Rillig M C, Wright S F, Nichols K A, et al. Large contribution of arbuscular mycorrhizal fungi to soil carbon pools in tropical forest soils[J]. Plant and Soil, 2001, 233(2): 167–177
[43] Janos D P, Garamszegi S, Beltran B. Glomalin extraction and measurement[J]. Soil Biology and Biochemistry, 2008, 40(3): 728–739
Tempo-spatial dynamics of AMF under maize soybean intercropping*
ZHAO Deqiang, YUAN Jinchuan, HOU Yuting, LI Tong, LIAO Yuncheng**
(College of Agronomy, Northwest Agriculture and Forestry University, Yangling 712100, China)
A field experiment was conducted to investigate whether AMF growth and yield of spores and glomalin were influenced by planting patterns. Four systems consisting of 6 rows of maize intercropped with 6 rows of soybean (6M6S), 3 rows of maize intercropped with 3 rows of soybean (3M3S), sole maize crop (CKM), and sole soybean crop (CKS) were used to examine spatial and temporal dynamics of AMF. The results showed that mycorrhizal colonization, colonization density, and hypha density increased gradually with the symbiotic period between AMF and crops; and mycorrhizal arbuscular richness at first showed an increase, then decreased. In the milking stage of maize (the filling stage of soybean), two-year results showed that mycorrhizal colonization, colonization density, arbuscular richness of mycorrhiza, soil spore density, and glomalin content of 3M3S were significantly higher than those of monoculture. With the growth of crops, the spore density of AMF increased from 269.40 spores·(100g)-1to 1 484.20 spores·(100g)-1, the content of easily extractable glomalin increased from 430.88 µg·g-1to 600.78 µg·g-1, and the content of total glomalin increased from 942.59 µg·g-1to 1 304.03 µg·g-1. In the milking stage of maize, the border row of intercropped maize had the highest hypha density, spore density, easily extractable glomalin, and total glomalin. In the filling stage of soybean, the border row of intercropped soybean had the highest hypha density and easily extractable glomalin, and the lowest spore density. Correlation analysis indicated that contents of easily extractable glomalin and total glomalin were significantly positively correlated with hypha density, with coefficients up to 0.71 and 0.73, respectively. The spore density and hypha density were significantly positively correlated with colonization, with coefficients up to 0.72 and 0.75, respectively. Therefore, this study showed that AMF could establish a good symbiotic relationship with crops on agricultural land and showed periodical variation with both the change of seasons and the growth of crops. Intercropping promoted the colonization of AMF and increased the production of glomalin and spores, and the symbiosis between AMF and crops showed marginal effect. The 3M3S treatment was the most lucrative planting system for AMF.
Maize and soybean intercropping; Arbuscular mycorrhizal fungi; Colonization; Glomalin; Spore
, E-mail: yunchengliao@163.com
Oct. 23, 2019;
Q945.79
10.13930/j.cnki.cjea.190720
赵德强, 元晋川, 侯玉婷, 李彤, 廖允成. 玉米||大豆间作对AMF时空变化的影响[J]. 中国生态农业学报(中英文), 2020, 28(5): 631-642
ZHAO D Q, YUAN J C, HOU Y T, LI T, LIAO Y C. Tempo-spatial dynamics of AMF under maize soybean intercropping[J]. Chinese Journal of Eco-Agriculture, 2020, 28(5): 631-642
* 国际(地区)合作与交流项目(31761143003)资助
廖允成, 主要研究方向为作物栽培与耕作和农田生态。E-mail: yunchengliao@163.com
赵德强, 主要研究方向为作物高产栽培与农田生态。E-mail: zhaodeqiang@nwafu.edu.cn
2019-10-23
2020-01-08
* This study was supported by the International (regional) Cooperation and Exchange Project of China (31761143003).
Jan. 8, 2020

