胸腺上皮肿瘤WHO分型与系统性免疫炎症指数的相关性
刘勇 赵亮 徐家行 付珺 赵轲 陈宝钧
胸腺肿瘤临床相对少见,在中国的发病率约为3.93/100万人,大致是肺癌发病率的1/100[1]。胸腺上皮性肿瘤是最常见的胸腺肿瘤,占前纵隔肿瘤的47%[2],分为胸腺瘤和胸腺癌[3]。WHO (20l5版)胸腺肿瘤组织学分类在原有的基础上对其分类进行调整,主要包括将原先肿瘤学国际疾病分类 (ICD-O)编码为1的常见类型胸腺瘤全部改为编码3。认为目前除了极少数的胸腺瘤(如微小胸腺瘤、脂肪纤维腺瘤,生物学行为编码为0,代表良性),其余类型的胸腺上皮性肿瘤的生物学行为均为恶性,编码均为3[4]。既往临床上通常认为的 A型、AB型和B1型胸腺瘤为良性的说法已经被淘汰,各类型胸腺瘤、胸腺癌均需要按胸腺恶性肿瘤进行临床诊断、治疗和长期随访。
迄今为止,包括WHO分型、Masaoka分期、TNM 分期系统的多个胸腺上皮性肿瘤评价系统是评估此类患者预后的主要手段,但并未得到统一。有研究和荟萃分析发现,与B2和B3型胸腺瘤亚型相比,A型、AB型和B1型患者的预后更好[5],而部分数据并不支持该观点[6]。这些争议主要是由于这些组织学复杂肿瘤的相对罕见,且由于来自世界不同地区的相对较小的已发表病例系列之间的差异所致。Weis等[7]通过对国际胸腺恶性肿瘤兴趣组织(International Thymic Malignancy Interest Group, ITMIG)数据库内4 221例胸腺瘤的研究发现,在调整年龄、分期和切除状态后,WHO组织学分型与生存率无显著相关性(P=0.4),但与复发率显著相关(P<0.05)。因此,我们仍需更多可靠的预后指标来协助判断胸腺上皮性肿瘤患者的预后情况以及制订临床治疗策略。
已有大量的文献证实系统性炎症反应与多种肿瘤的发生、发展和转移有着密切联系,系统性免疫性炎症指数(systemic immune-inflammation index,SII)是基于中性粒细胞、淋巴细胞和血小板数量的系统性炎症生物标志物,与机体免疫应答反应密切相关[4]。恶性肿瘤患者多出现SII水平升高,而异常升高的 SII 已经证实是多种肿瘤患者预后不良的独立危险因素[8-9]。
本研究拟探讨术前外周血SII与WHO胸腺上皮性肿瘤分型间的相关性,以期为胸腺上皮性肿瘤的治疗和预后分析提供临床帮助。
资料与方法
一、 资料和分组
1. 病例来源:收集2017年 1月至2019年12月于华中科技大学同济医学院附属武汉中心医院胸外科经手术治疗的胸腺上皮性肿瘤患者的临床资料。纳入标准:①在我院初诊并完成胸腺肿瘤切除术;②术后有明确的病理学诊断;③病历资料完善。排除标准:①患有其他感染性、免疫缺陷或血液系统疾病等可能影响炎症指标的患者;②术后复发的患者;③合并其他恶性肿瘤患者。
2. 分组:胸腺上皮性肿瘤按WHO(2015版)组织学分型,依据恶性程度分为低危组(包含A型、AB型、B1型)、高危组(包含B2型、B3型)和胸腺癌组。对照组为同期接受手术治疗的胸腺良性肿物患者。
二、 研究方法
本研究经华中科技大学同济医学院附属武汉中心医院伦理委员会批准并备案。收集所有患者术前4 d内外周静脉血常规检验结果,包括血小板计数、中性粒细胞计数和淋巴细胞计数。SII依据血小板计数×中性粒细胞计数/淋巴细胞计数进行计算。胸腺上皮性肿瘤的诊断与分型及分期均由本院病理科高级别医师完成。
三、 统计学方法
结 果
一、 一般资料
共纳入46例胸腺上皮性肿瘤患者,其中低危组20例,高危组19例,胸腺癌组7例;男性19例,女性27例;年龄20~78岁,平均年龄(56.18±12.48)岁;有5例合并重症肌无力(B2型2例,B3型3例)。对照组34例,其中胸腺囊肿28例,胸腺良性增生5例(均合并重症肌无力),胸腺脂肪瘤1例;男性12例,女性22例;年龄21~75岁,平均年龄(54.00±13.67)岁。各组一般资料详见表1。统计学分析表明:四组患者性别构成及年龄的差异均无统计学意义 (P>0.05),具有可比性。在三组胸腺上皮性肿瘤患者间,肿瘤直径和Masaoka分期的差异均无统计学意义(P>0.05)。
二、 相关指标的比较
各组测得中性粒细胞、血小板及淋巴细胞计数的数据资料详见表2。统计学分析表明:胸腺癌组,SII显著高于其他三组(P<0.05),血小板计数显著高于低危组和对照组(P<0.05),中性粒细胞计数显著高于对照组(P<0.05)。四组间淋巴细胞计数的差异无统计学意义(P>0.05)。
三、 相关性分析
Spearman秩相关检验结果表明:SII与胸腺上皮性肿瘤的恶性程度呈显著正相关(r=0.244,P=0.032)。
讨 论
本研究基于WHO组织学分型,将胸腺上皮性肿瘤分为低危组、高危组和胸腺癌组,并以良性胸腺肿物为对照组。比较各组间术前外周血的血小板、中性粒细胞、淋巴细胞计数以及计算所得的SII的差异,分析SII与胸腺上皮性肿瘤恶性程度的相关性。研究结果显示:胸腺癌组SII显著高于其他三组,血小板计数显著高于低危组和对照组,中性粒细胞计数显著高于对照组;提示SII与胸腺上皮性肿瘤的恶性程度显著相关。
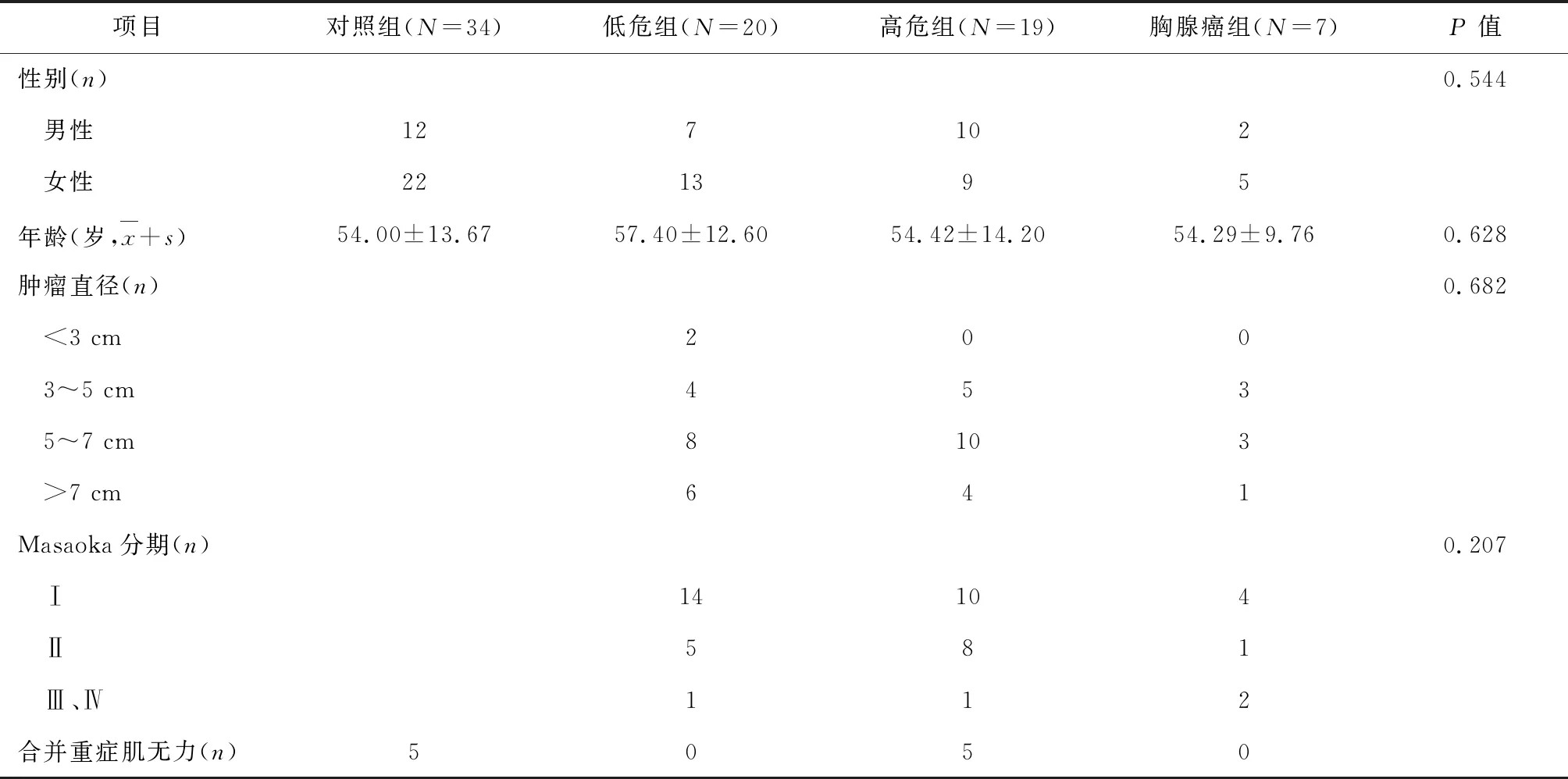
表1 一般临床资料分析

表2 四组间相关指标的比较
注:血小板计数的数据符合正态分布,采用单因素方差分析;其余数据不符合正态分布,采用Kruskal-WillisH检验。与胸腺癌组比较,a∶P=0.026,b∶P=0.019,c∶P=0.052;d∶P=0.025;e∶P=0.009,f∶P=0.007,g∶P=0.047
胸腺上皮性肿瘤临床罕见,以至于目前没有大型前瞻性随机临床试验提供关于这些患者治疗的循证依据[10]。WHO组织学分型临床已经应用多年,虽历经数次修改,其分型结果仍然是判断预后和决定进一步治疗与否的重要依据。有研究[7]显示,在胸腺瘤患者中,年龄、Masaoka分期和是否完整切除与生存和复发相关,而WHO病理分型对复发有显著影响。因此WHO分型对预后具有重要意义。除WHO分型外,Masaoka分期、TNM分期系统均已应用于胸腺上皮性肿瘤的临床研究,但并未得到统一结论,对此类疾病的预后也就没有确切结论。
炎症反应在肿瘤进展中具有重要作用,参与肿瘤的启动、恶变、组织浸润和转移等[10]。炎症细胞可直接或通过释放炎性介质等间接方式诱使正常组织细胞发生癌变,促进肿瘤增殖、迁移和血管生成以及抑制抗肿瘤免疫。血小板可释放血管内皮生长因子(vascular endothelial growth factor,VEGF)、转化生长因子-β(transforming growth factor-β,TGF-β)和血小板源性生长因子(platelet-derived growth factor,PDGF)等,促进肿瘤血管生成、细胞外基质降解,从而促进肿瘤的生长和转移[11]。中性粒细胞可抑制自然杀伤细胞的活性,并且通过释放VEGF和基质金属蛋白酶促进肿瘤血管生成[12]。淋巴细胞可通过刺激自然杀伤细胞和巨噬细胞杀伤肿瘤细胞,它的减少会导致机体的免疫监视和抗肿瘤能力下降,为肿瘤生长提供良好的环境[13]。
血小板和中性粒细胞的升高往往预示肿瘤的恶性程度更高,血小板、中性粒细胞、淋巴细胞三者之间的联系可以通过SII、中性粒细胞与淋巴细胞比值(neutrophil-lymphocyte ratio,NLR)、血小板与淋巴细胞比值(platelet-lymphocyte ratio,PLR)等免疫炎症指标反应出来。NLR和PLR升高已被证明是几种恶性肿瘤的不良预后因素[14-17]。SII 是近年来才被提出的基于中性粒细胞、血小板、淋巴细胞计数的一个新的炎症指数,已被证明是小细胞肺癌、肝细胞癌和食管鳞癌、食管胃交界性肿瘤等的负向预后指标[18-19]。
本研究结果表明,单纯炎症细胞计数比较中,胸腺癌组血小板计数显著高于对照组和低危组;胸腺癌组中性粒细胞计数显著高于对照组,与胸腺瘤两组之间无显著差异。比较SII发现,胸腺癌组显著高于其他三组。相关性分析结果显示SII与恶性程度分组显著相关。说明胸腺上皮性肿瘤的发生和发展过程中,同样有炎症细胞参与其中并发挥重要作用。SII数值越高,预示着胸腺上皮肿瘤的恶性程度越高,需要临床更积极的对待。
本研究不足之处在于:作为单中心的回顾性研究,本研究样本量相对偏小。研究中发现合并重症肌无力病例数不足以进行统计分型。且根据Masaoka分期,属于Ⅲ~Ⅳ期者病例数少,亦不足以进行Masaoka分期与炎症指数的相关性分析。未来还需要更好地设计和更大规模或者多中心的前瞻性研究来证实炎症细胞及相关免疫炎症指数,包括SII、NLR、PLR 作为胸腺上皮性肿瘤标志物的应用价值,以便广泛用于临床实践中。

