有益菌降解霉菌毒素及抗菌产酶效果研究
辛瑞祥 张勇 曹阳 王秀云 牛星 王辉 牛钟相③*
试验研究
有益菌降解霉菌毒素及抗菌产酶效果研究
辛瑞祥①张勇①曹阳①王秀云①牛星②王辉①牛钟相①③*
(①潍坊华英生物科技有限公司 山东 潍坊 261000 ②山东力明科技职业学院 山东 泰安 ③山东农业大学动物科技学院 山东 泰安)
为了探索有益菌降解霉菌毒素、抵抗病原菌、分泌消化酶的效能。采用微生物培养技术、酶联免疫(ELISA)检测技术、药敏试验及常规酶类检测方法,对初步筛选的8株有益菌(其中2株乳酸菌,编号R-2、R-3;4株芽胞菌,编号Y-1、Y-2、Y-3、Y-4和2株酵母菌,编号J-4、J-6)进行了系统的试验。结果表明,8株不同类型的有益菌对黄曲霉毒素均有一定的降解作用,其中降解率较高的菌株R-3为54.5%、Y-2为58.72%、J-4和J-6分别为90.57%和73.21%;对呕吐毒素降解率最高的是Y-2 (51.57%);对玉米赤霉烯酮降解率效果最好的是Y-1和Y-2,分别为56.57%和70.70%。在抑菌方面,乳酸菌R-2、R-3菌株和芽胞菌Y-1、Y-2菌株对致病性大肠杆菌、沙门氏菌和金黄色葡萄球菌均具有很强的抑制杀灭作用;芽胞菌Y-1、Y-2菌株还具有分泌蛋白酶、淀粉酶及纤维素酶的能力。结论:8株有益菌不但能够降解霉菌毒素,而且还具有抗菌和产酶能力。
霉菌毒素 降解 有益菌 抗菌 产酶
霉菌毒素(Mycotoxin)是指霉菌在其所污染的谷物或饲料中所产生的一类有毒的次级代谢产物,主要有曲霉菌、青霉菌和镰刀菌产生[1, 2]。霉菌毒素不仅降低饲料的营养价值,影响适口性,导致畜禽采食量下降,而且还会造成动物生长停滞、免疫力降低、生产性能下降,甚至中毒死亡,造成巨大的经济损失[3]。
科学工作者不断地进行霉菌毒素的预防和祛除方面的研究,取得了许多经验和方法。目前,霉菌毒素的去除方法主要有物理去除法、化学去除法及生物去除法。综合比较各种方法,现在市场上常用的霉菌毒素去除方法主要为物理吸附法和生物降解法[4]。传统的物理祛除霉菌毒素的方法存在效果不稳定、营养成分损失大、影响饲料适口性且难以规模化生产等缺点;化学处理法容易造成最终产物在机体内的残留以及对营养物质的破坏,其安全性还需要进行更多的研究。生物降解法,即利用自然界存在的微生物或其代谢产生的代谢物质,在其自然生长繁殖过程中将霉菌毒素的毒性基团破坏,生成无毒代谢产物的一种方法。该技术具有解毒效率高、特异性强、对饲料和环境没有污染等优势,备受研究者的关注[5]。另外,有益菌除能祛毒外,还有维持肠道微生态平衡、提高机体免疫力、抗菌防病、营养保健等功能。因而,此类型的微生态制剂推广应用的前景十分广阔。
本研究成功筛选到了多株降解霉菌毒素效果好、杀菌能力强、产酶量高的有益菌株,为研制具有降解霉菌毒毒素、抗菌促生长等功能的新型微生态制剂提供了菌种保证和技术支持。
1 材料与方法
1.1 材料
1.1.1 仪器设备 Bio-Radimark酶标仪,美国伯乐生产;高压灭菌锅、恒温培养箱等,均由本公司研发中心提供。
1.1.2 试剂 黄曲霉毒素、呕吐毒素和玉米赤霉烯酮ELISA检测试剂盒,均购自江苏伯克生物技术有限公司。MRS培养基、LB培养基、YPD培养基、营养琼脂、纤维素酶测定培养基、淀粉酶测定培养基、蛋白酶测定培养基,均购自潍坊市化学试剂商店。
1.1.3 菌种 2株乳酸菌(R-2、R-3)、4株芽胞菌(Y-1、Y-2、Y-3、Y-4)和2株酵母菌(J-4、J-6)菌种;6株病原菌,其中1株致病性大肠杆菌(O2),4株沙门氏菌(编号10、78、132、135)和1株金黄色葡萄球菌菌种,均由潍坊华英生物科技有限公司研发中心提供。
1.2 方法
1.2.1 菌株活化 取乳酸菌株(R-2、R-3)、芽胞菌株(Y-1、Y-2、Y-3、Y-4)和酵母菌株(J-4、J-6)菌种,分别接种MRS液体培养基,LB液体培养基和YPD培养基,分别于37℃厌氧培养24h、37℃需氧培养24h和30℃需氧培养48h活化,放4℃备用。取4株沙门氏菌、1株致病性大肠杆菌和金黄色葡萄球菌菌种分别接种LB液体培养基,于37℃需氧培养18h活化,放4℃备用。
1.2.2 霉菌毒素的降解实验 将培养活化的各株乳酸菌、芽胞菌、酵母菌菌液分别离心,然后分别取离心上清与霉菌毒素标准品(黄曲霉毒素标准品浓度为0.54ng/ml、呕吐毒素浓度为27ng/ml和玉米赤霉烯酮浓度为8.1ng/ml)一定量混合,另外按一定比例分别取MRS、LB和YPD液体培养基和霉菌毒素标准品混合(做空白对照),37℃作用18h。按三种霉菌毒素ELISA检测试剂盒说明书方法分别检测各种毒素降解后残留量;计算霉菌毒素降解率。霉菌毒素降解率(%)=(培养基空白对照中霉菌毒素浓度-降解后霉菌毒素浓度)/培养基空白对照中霉菌毒素浓度×100。
1.2.3 有益菌抗菌(抑菌)力实验 将致病性大肠杆菌O2株,4株沙门氏菌和金黄色葡萄球菌菌液分别用灭菌生理盐水稀释至1.0×107CFU/ml浓度,分别吸取100μl稀释菌液于营养琼脂平板上,均匀涂布。然后分别在涂布不同病原菌的营养琼脂板上放置8个牛津杯,牛津杯内分别加入各株有益菌的过滤培养上清液,将平板水平放置于37℃培养箱18h,观察、记录抑菌圈直径。
1.2.4 有益菌产酶效果实验 在分别含有一定量蛋白质、淀粉、纤维素的特殊琼脂培养基板上打孔,8孔/每板;在每种培养基板孔内分别加入8株有益菌的过滤培养上清液一定量,将平板放置于37℃孵育,观察测量(蛋白酶圈可直接测量,淀粉酶采用革兰氏碘液染色后观察测量,纤维素酶平板先用刚果红染色,再用醋酸液固定后测量酶解圈)、记录结果。
2 结果
2.1 不同有益菌株对霉菌毒素降解效果
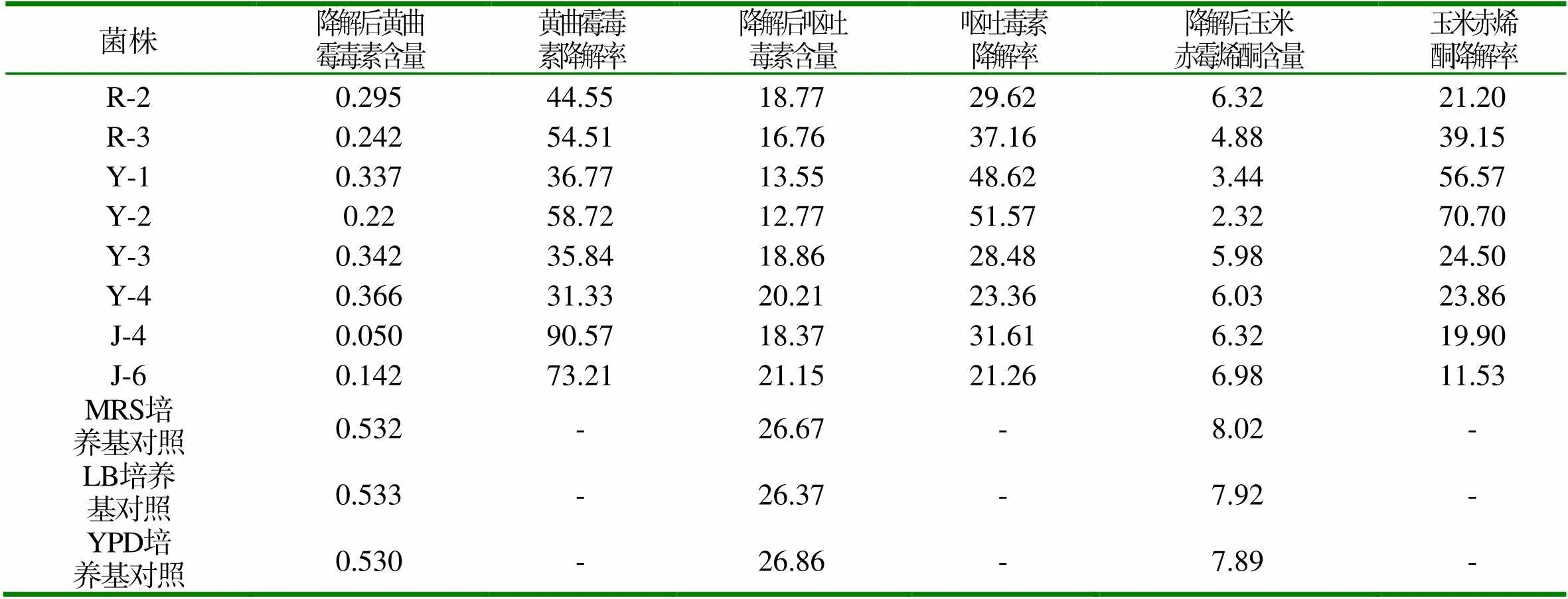
表1 各株有益菌对三种霉菌毒素的降解效果(ng/ml、%)
由表1可知,对黄曲霉毒素降解效果最好的菌株为J-4和J-6,降解率分别达90.57%和73.21%,其次是Y-2、R-3和R-2,分别为58.72%和54.51%和44.55%;对呕吐毒素降解效果较好的菌株为Y-2(51.57%)和Y-1(48.62%);对玉米赤霉烯酮降解效果较好的菌株是Y-2(70.70%)和Y-1 (56.57%);其中Y-2对三种霉菌毒素均有较好的降解作用。
2.2 有益乳酸菌对病原菌的抑制效果

表2 乳酸菌对病原菌的抑菌圈直径 (mm)
由表2结果显示,2株乳酸菌对致病性大肠杆菌、沙门氏菌和金黄色葡萄球菌均具有一定的抑制作用,R-3株乳酸菌效果较好。
2.3 有益芽胞菌和酵母菌对病原菌的杀灭效果
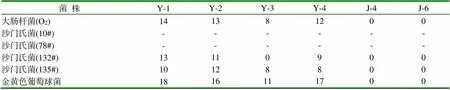
表3 芽胞菌和酵母菌对病原菌的抑菌圈直径 (mm)
由表3结果可见,芽胞菌Y-1和Y-2株对大肠杆菌和沙门氏菌均有较好的抑制、杀灭作用,Y-3、Y-4株效果最差。4株芽胞菌对金黄色葡萄球菌均具有较好的杀灭作用,2株酵母菌对各病原菌均没有抑制作用。
2.4 有益菌的产酶效果
由表4结果显示,芽胞菌具有一定的产酶能力,其中Y-1、Y-2株芽胞菌可分泌蛋白酶、淀粉酶和纤维素酶三种酶,Y-3和Y-4株芽胞菌仅分泌一定量的纤维素酶;而2株乳酸菌和2株酵母菌对三种酶均不分泌。

表4 有益菌产酶圈直径 (mm)
3 讨论
3.1 霉菌毒素降解菌的筛选
霉菌毒素在地球上的存在年限甚至比人类的历史还要悠久,虽然其性质稳定,但并未因毒素的积累而造成灾害,故推断自然界本身存在可降解霉菌毒素的微生物或其它因素[6, 7]。近年来,已发现许多有益菌及其代谢产生的酶能够降解霉菌毒素。李冰等[8]筛选到的黑曲霉菌,对黄曲霉毒素B1的降解率高达93.28%,研究发现降解黄曲霉毒素B1的活性成分主要是胞外酶。关心[9]用香豆素作为黄曲霉毒素B1的替代物成功到一株芽孢杆菌(菌株F6),其对黄曲霉毒素B1降解率高达83.2%。王燕等[10]用香豆素为唯一碳源和能源筛选得到一株甲基营养型芽孢杆菌(菌株WZ-4),其对黄曲霉毒素B1降解率为75.25%。左瑞雨等[11]采用黄曲霉毒素B1作为唯一能源和碳源的方法进行初筛,然后通过分离、富集培养,筛选得到对黄曲霉毒素B1降解率高达77.05%的真菌Y8,真菌 26S rDNA菌种鉴定和同源序列分析结果显示,真菌Y8为米曲霉。本研究采用先进的霉菌毒素微量残留检测技术,对初选的多株有益菌的降解霉菌毒素效果进行了研究,结果发现,芽胞菌Y-2株对黄曲霉毒素、呕吐毒素和玉米赤霉烯酮均有较好的降解作用(降解率分别达58.72%、51.57%和70.70%),还有抑菌功能的乳酸菌R-3株对黄曲霉毒素的降解率达54.5%,另外,酵母菌J-4株和J-6株对黄曲霉毒素的降解率也分别达到90.57%和73.21%。
3.2 霉菌毒素降解菌的抑菌作用
益生菌不但能够调节肠道菌群平衡,而且其在生长时产生的代谢产物中含有抗菌肽,具有广谱抗菌活性,对多种有害菌均有抑制作用。细菌中已发现的抗菌肽有杆菌肽(Bacitracin)、短杆菌肽S(Gramicidin S)、多粘菌素E(Polymyxin E)和乳链菌肽(Nisin)4种类型。田召芳等[12]从健康鸡、兔、仔猪肠道内容物及新鲜粪便中分离筛选出5株有明显抑菌活性代谢产物的乳酸菌,其中4株属于乳杆菌属,1株属于链球菌属,并通过试验证明抑菌物质中含有蛋白质类细菌素。张辉华等[13]从鸡粪便中分离到6株乳酸菌,采用牛津杯法与单层琼脂扩散法对乳酸菌的体外抑菌能力进行了研究,发现其对鸡大肠杆菌O78、鸡白痢沙门氏菌、金黄色葡萄球菌均有不同程度的抑制作用,其中,LHCK菌株对鸡大肠杆菌O78的抑菌圈直径达17.96mm,O2株对鸡白痢沙门氏菌抑菌圈直径达22.94mm,IF15菌株对金黄色葡萄球菌的抑菌圈直径为17.70mm。潘文杰等[14]从健康成年猪粪便中分离到一株产淀粉酶的芽胞杆菌(SY200),采用滤纸片法和牛津杯法研究该菌对动物病原菌的生物拮抗作用,结果显示,该菌的全菌培养液和培养上清液对产肠毒素大肠杆菌、鸡白痢沙门菌、金黄色葡萄球菌均有较强的生物拮抗作用,其上清液对产肠毒素大肠杆菌、鸡白痢沙门氏菌、金黄色葡萄球菌的抑菌圈直径分别为17.14、18.03和20.03mm。本研究中筛选的两株酵母菌(J-4、J-6)对有害菌均没有抑制能力,可能由于这两株菌生长过程中不能代谢产生有机酸、抗菌肽、过氧化氢等对病原菌有抑制作用的物质有关。本研究所筛选的2株乳酸菌和4株芽胞菌对致病性大肠杆菌、沙门氏菌和金黄色葡萄球菌均具有一定的杀菌效果,其中R-3株乳酸菌对致病性大肠杆菌、沙门氏菌和金黄色葡萄球的最大抑菌圈直径分别为15、15、18mm;Y-1株芽胞菌对致病性大肠杆菌、沙门氏菌和金黄色葡萄球的最大抑菌圈直径分别为14、13、18mm。
3.3 霉菌毒素降解菌的产酶性能
益生菌代谢产物中含有蛋白酶、淀粉酶、纤维素酶、脂肪酶等酶类,能够促进动物机体对影响物质的吸收,提高生产性能。张韵等[15]从健康仔猪粪便中分离筛选到4株凝结芽孢杆菌,通过试验证明均具有一定的产生蛋白酶、淀粉酶及纤维素酶的能力。郭政宏等[16]从藏绵羊粪便中分离到了一株既能产蛋白酶、又能产纤维素酶的短小芽胞杆菌。本研究成功筛选到能够同时产生蛋白酶、淀粉酶、纤维素酶的两株芽孢菌(Y-1、Y-2),其中Y-1菌产蛋白酶能力好于Y-2,酶解圈直径为13mm;Y-2菌产淀粉酶和纤维素酶的能力好于Y-1,淀粉酶和纤维素酶的酶解圈直径分别为14mm和11mm;试验筛选的两株酵母菌、两株乳酸菌均没有产生三种消化酶的能力。
[1] 龚阿琼, 邓娟娟, 郑豆豆等. 2018年上半年原料及饲料毒素检测分析[J]. 中国饲料, 2018(17): 90-92.
[2] Sforzas S, Dall’asta C, Marchelli R. Recent advances in mycotoxin determination in dood and feed by hy-phenated chromatographic techniques /mass spectrometry[J]. Mass Spectrometry Reviews, 2006, 25(1): 54-76.
[3] 杨玉婷, 赵世娇, 程永超. 霉菌毒素危害及其防除[J].青海畜牧兽医杂志, 2017, 47(6): 60-64.
[4] 戎晓平. 霉菌毒素生物降解技术与传统吸附剂区别[J]. 广东饲料, 2017, 26(12): 15-17.
[5] 计成. 饲料中霉菌毒素生物降解的研究进展[J]. 中国农业科学, 2012, 45(1): 153-158.
[6] Alberts J F, Engelbrecht Y, Steyn P S, et al. Biological degradation of aflatoxin B1 by Rhodococus erythropolis cultures[J]. International Journal of Food Microbiology, 2006, 109(12): 121-126.
[7] Pitt J I, Basílico J C, Abarca M L, et al. Mycotoxins and toxigenic fungi[J]. Medical Mycology, 2000, 38(1): 41-46.
[8] 李冰, 董征英, 常维山. 黑曲霉对黄曲霉毒素B1的降解与应用研究[J]. 饲料博览, 2012(11): 6-10.
[9] 关心. 黄曲霉毒素B1降解菌株的筛选鉴定、降解优化与特性研究[D]. 沈阳农业大学: 沈阳, 2016.
[10] 王燕, 张美丽, 毛勇等. 黄曲霉毒素B1降解菌的分离鉴定及培养条件优化[J]. 河南农业科学, 2015, 44(4): 139-143.
[11] 左瑞雨, 尹清强, 常娟等. 降解黄曲霉毒素B1菌株的筛选及毒素降解酶的分离[J]. 河南农业科学, 2018, 47(8): 128-133.
[12] 田召芳, 常维山, 唐珂心等. 产细菌素乳酸菌的筛选及体外抑菌试验[J]. 中国微生态学杂志, 2003, 25(2): 87-88.
[13] 张辉华, 曹永长, 毕英佐等. 6株乳酸菌体外抑菌试验[J]. 中国兽医杂志, 2001, 37(7): 8-10.
[14] 潘文杰, 冯杰, 杨帆. 一株产淀粉酶芽胞杆菌SY200的鉴定及其对动物病原菌的生物拮抗试验[J]. 中国微生态学杂志, 2017, 29(8): 891-895.
[15] 张韵, 赵丽娜, 曹琳等. 益生凝结芽胞杆菌的筛选及生物学特性研究[J]. 中国畜牧杂志, 2017, 53(1): 109-114.
[16] 郭政宏, 周彪, 严亨秀. 一株藏绵羊源短小芽胞杆菌的分离鉴定及生物学特性研究[J]. 中国畜牧兽医, 2016, 43(6): 1610-1617.
(2020–05–06)
S816.76
A
1007-1733(2020)07-0001-04

