腔内分流栓在大鼠腹腔异位心脏移植中的应用
郑伟锋米 睿郭书栋罗志强王成蕊李 彤
(1.天津医科大学三中心临床学院,天津 300170; 2.天津市第三中心医院,天津 300170;3.天津市人工细胞重点实验室,天津 300170)
建立大鼠腹腔异位心脏移植模型是研究心脏移植相关问题的重要手段[1]。1964 年,Abbott 等[2]首先完成了大鼠异位心脏移植。1969 年,Ono 等[3]将其改进为端侧吻合后使之成为经典术式。然而,在操作中,长时间阻断腹主动脉造成了远端组织器官缺血,增加了受体血栓形成、截瘫、组织坏死的风险,导致手术失败率增加[4]。同样,在血管外科、神经外科及心脏外科中也面临着类似的问题。Trapp等[5]率先报道了分流技术应用于非停跳冠脉旁路移植术中可减轻了远端心肌组织的缺血。目前,血管腔内分流栓经过不断改进已普遍应用于非停跳冠状动脉旁路移植术中。所以,本研究尝试将此项技术应用于大鼠腹腔异位心脏移植术中比较其与传统方法的受体保护方面的作用。
1 材料和方法
1.1 实验动物
雄性 SPF 级 SD 大鼠,月龄为 2 ~4 月,体重 250~450 g,共40 只。由中国食品药品检定研究院(大兴)提供[SCXK(京)2017-0005],本研究在实验动物饲养和实验过程均在天津市中西医结合医院(天津南开医院)的屏蔽设备中进行[SYXK(津)2015-0007]中完成,饲养环境中的温度(24±2)℃、相对湿度(50±5)%、换气次数、明暗周期等均符合中华人民共和国国家标准(GB14925-2010)。实验动物使用“减少、替代和优化”3R 原则给予人道的关怀,并经天津医科大学动物伦理委员会批准实验(DWLL-20191015)。将实验大鼠随机分成传统组及改进组。传统组供体及受体各10 只,改进组供体及受体各10 只。
1.2 主要试剂与仪器
戊巴比妥钠粉末(天津中西医结合医院实验动物中心,天津);肝素钠注射液(每支12500 U,天津生物化学制药有限公司,国药准字H12020505);0.9%氯化钠注射液( 上海百特,国药准字H10964996);HTK 心脏液500 mL(赫特金TM福州海王福药制药有限公司,国食药监械(准)字2014 第3450187 号);中性福尔马林固定液(河北同和生物制品有限公司);大鼠血浆乳酸脱氢酶(Lactate Dehydrogenase,LDH)ELISA 试剂盒、大鼠 M 型肌酸激酶(CKM)(Creatine Kinase M,CKM)ELISA 试剂盒(上海酶联生物科技有限公司);苏木素尹红(HE)染色试剂盒(上海威奥生物科技有限公司)。
手术器械包、腹腔撑开器及血管外科显微器械(上海金钟);15°Stab 刀(上海晶明);9-0 医用无损伤带针尼龙缝合线数根;3-0 及4-0 慕丝缝合线(强生爱惜康 美国);1 mL、5 mL 及10 mL 空针(BD Emerald TM 美国);20G 钝性灌注针头 1 枚、TOPOTM传统型动物呼吸机(Kent Scientific 美国);尼康体视变焦显微镜SMZ745T(Nikon 日本);全自动病理脱水机系统(Leica 德国);石蜡切片机(Leica 德国);BX-51 显微镜(OLYMPUS 日本);自制分流栓(由材质为环氧乙烷,内径为1.1 mm,流量为60 mL/min的20GA BD 动脉穿刺套管制成,其长度分别为8 mm、10 mm、12 mm 及 15 mm)见图1。
1.3 实验方法
大鼠于术前12 h 禁食,自由饮水。给予2%戊巴比妥钠(40 mg/Kg)腹腔注射麻醉后仰卧固定于带加热板的手术台上,备胸、腹部皮肤,碘伏消毒后铺无菌巾单。
1.3.1 获取供体心脏
经口插入自制气管插管。分离右侧颈总动脉,结扎远心端并夹闭近心端后插入20G 灌注针头。正中开胸后迅速接呼吸机机械通气(10 mL/kg,每分钟60 次)[6]。去除胸腺组织,充分暴露心脏及大血管。经右颈总动脉插管缓慢推注4℃HTK 液约10 mL 致心脏停搏[7]。游离升主动脉至左侧锁骨下动脉处,结扎其主要分支。结扎并切断左、右上腔静脉及下腔静脉。分离并结扎双侧肺门组织及心底部组织。由近左侧锁骨下动脉处横断主动脉,摘取心脏。由主动脉弓再次缓慢推注4℃HTK 至心腔内无明显血液。小心分离主肺间隔,肺动脉主干应尽可能留长。将供心置于 4℃HTK 液中恒温保存[8]。

图1 自制分流栓样品Figure 1 Self-made intraluminal shunts
1.3.2 改进组手术方法
将受体大鼠麻醉、固定及消毒。上腹部正中切口3~5 cm,开腹后将小肠轻推至左上腹并用生理盐水湿纱布覆盖。于右肾动脉至髂总静脉间游离腹主动脉及下腔静脉并去除部分脂肪及结缔组织,小心分离并结扎部分下腔静脉背部属支。分离血管最好由头至尾方向进行[9]。经右侧髂腰静脉注射肝素(500 U/kg)后将其结扎。用小血管夹将分离出的下腔静脉分别于右肾静脉下端水平及髂总静脉上端水平夹闭。在其中部正中用15°Stab 刀切开一纵行小口[10],精细剪刀沿切口上、下极做长3 ~4 mm 切口。肝素盐水充腔后,将自制分流栓轻柔置入下腔静脉内,再次排气充腔,分流栓两端用4-0丝线结扎固定。开放远心端血管夹确认无出血后开放近心端血管夹,可见分流栓内血液流动。腹主动脉切口的中点与下腔静脉切口上极平齐。根据腹主动脉长度选取适当长度的分流栓,分流栓过长在置入和取出时较困难,而过短则会影响吻合。置入和固定分流栓的方法同前,开放血管夹次序相反。血管吻合于尼康体视变焦显微镜下进行。将供体心脏放置于受体右下腹内,盐水纱布包裹,间断4℃盐水降温[4,9]。用9-0 尼龙线将主肺动脉与下腔静脉做吻合,再将供心的升主动脉与受体的腹主动脉吻合[11-12],吻合后暂不收线打结。再次夹闭下腔静脉及腹主动脉,剪开结扎线并轻柔取出分流栓,再次注入肝素盐水排气。收紧下腔静脉吻合口缝线,轻轻开放远心端血管夹确认无明显出血后打结后开放近心端血管夹。然后,收紧腹主动脉吻合口缝线轻轻开放近心端血管夹,无明显出血后打结,开放远心端血管夹。见图2。
1.3.3 传统组手术方法
参照经典腹腔异位心脏移植方法,打开腹腔后游离腹主动脉和下腔静脉并阻断,血管前壁做切口与供心升主动脉和肺动脉吻合,待吻合完毕后统一开放[13]。
恢复血流后,供体心脏颜色逐渐转为粉红色,并在1~2 min 恢复规律心跳。记录两次阻断腹主动脉。逐层关腹,背部皮下注射温生理盐水2 mL 补液。受体大鼠术后分笼饲养并予以保温促进受体的复苏。术后3 d 可给予正常饲料及糖盐水喂养,观察腹部切口情况,每日触诊腹部心脏搏动情况。两组均记录从开腹至关腹完成的总手术时间及阻断腹主动脉的总缺血时间。
1.3.4 下肢肌肉组织病理
供体心脏开放前,经左侧下肢皮肤切口采集约2×3 mm 长度肌肉组织后止血缝合,中性福尔马林固定保存。制作成病理切片,HE 染色显微镜下观察。
1.3.5 血清肌酸激酶(CKM)和乳酸脱氢酶(LDH)含量
关腹后,经受体大鼠尾静脉采集血液标本,抗凝后离心,取上清液,-80℃保存。按照试剂盒提供使用说明书测定血浆CKM 和LDH 含量。
1.4 统计学方法
采用SPSS 22.0 软件分析数据,计量资料以平均数±标准差(±s)表示,检验正态性,两组数据符合正态分布采用t检验,不符合正态分布则使用秩和检验;P<0.05 差异有统计学差异。
2 结果
2.1 两组手术总时间及下肢总缺血时间比较
改进组手术成功10 只,供心存活72 h 以上,无下肢缺血及截瘫发生,未发现吻合口出血。传统组手术成功9 只,1 只死于术后吻合口出血。
传统组的总手术时间及总缺血时间的均数及分别为(86.9±6.3)min、(59.5±7.2)min;改进组的总手术时间及总缺血时间均数分别为(82.4±9.3)min、(21.7±4.7)min。两组总手术时间比较无统计学差异(P=0.225),而两组下肢总缺血时间有统计学差异(P<0.05),见表1。
2.2 病理表现
通过比较两组受体下肢肌肉组织病理切片显示,改进组下肢肌肉组织细胞基本正常,横切面未见明显细胞水肿改变,纵切面可见肌肉组织排列规则,未见明显排列紊乱及肌丝断裂表现,血管内未见明显血细胞堆积和淤滞,见图3A、3C、3E。传统组下肢肌肉出现明显异常,横切面可见明显细胞肿胀、饱满、细胞间隙狭窄;纵切面可见肌肉组织排列不规则,横纹紊乱及肌丝断裂,动静脉内大量血细胞堆积,符合肌肉损伤表现,见图3B、3D、3F。
2.3 CKM 和 LDH 比较
传统组中 CKM(32.8±6.5)U/L,LDH(49.5±10.0)U/L,改进组中 CKM(12.8±4.8)U/L,LDH(25.6±9.2)U/L。传统组中 CKM 及 LDH 水平均升高,两组比较均有统计学差异(P<0.05),见表2。
3 讨论
大鼠异位心脏移植按部位不同主要分为颈部异位心脏移植及腹部异位心脏移植两种,两者在手术时间、手术成功率及术后的免疫反应等方面无明显差别[14]。由于腹腔异位心脏移植有以下优点:血管不易痉挛;腹腔内空间较大,对供心压迫较小;供心不易受外部环境影响,方便喂养并且能长期存活等,因此其仍然是研究大鼠心脏移植的重要模型。但是,该方法在实施中对术者的操作技术要求高且学习周期较长,所以学者们在不断尝试对其改进。例如邵孟平等[15]将供体右肺动脉与受体的下腔静脉做吻合,王晓亮等[16]采用套管法将供心的升主动脉及主肺动脉与供体的左肾动、静脉相吻合。这些改进措施使其技术难度相对有所降低,对于供心及受体也起到了一定的保护作用。

图2 分流栓置入及取出Figure 2 Placement and removal of intraluminal shunts
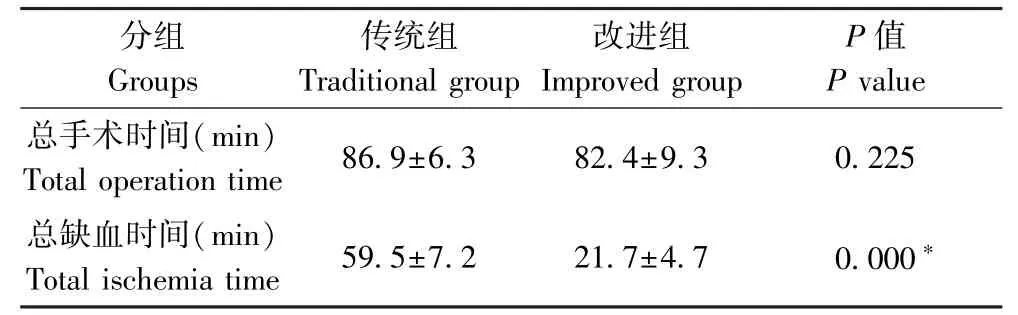
表1 两组手术总时间及下肢总缺血时间比较(n=10)Table 1 Comparison of total operation time and total ischemia time of lower limbs between the two groups

表2 两组中CKM 和LDH 的比较(n=10)Table 2 Comparison of CKM and LDH in two groups
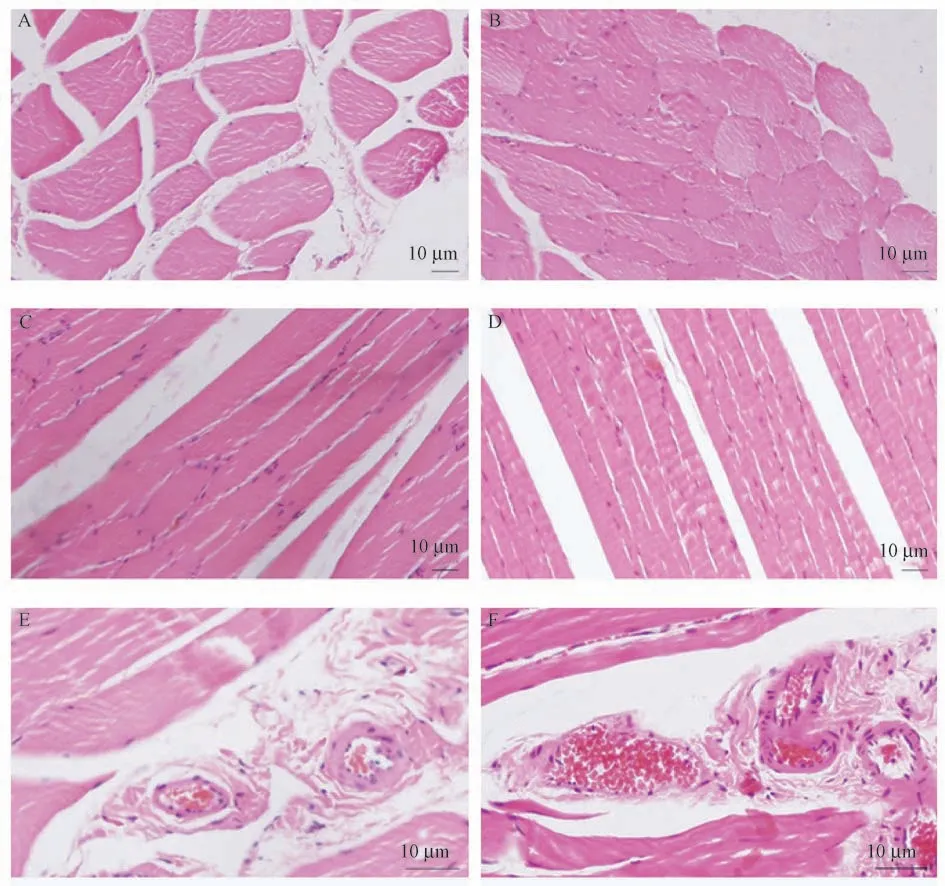
图3 两组下肢肌肉组织病理表现Figure 3 Pathological features of lower limb muscle in two groups
然而在建立大鼠腹腔异位心脏移植的模型过程中,受体仍会发生一些并发症如:截瘫、肢体麻痹、下肢血栓形成、肠坏死及酸中毒等。这些并发症很大程度上是由长时间夹闭腹主动脉所致。采用传统方法,吻合血管时间长短决定了夹闭腹部大血管时间。但是,被切开的血管壁会发生塌陷,增加了吻合难度使得吻合时间延长。所以,如何缩短夹闭血管时间成为减少并发症发生的关键。
Rivetti 等[17]报道了在非体外循环冠脉旁路移植术中将一段光滑、透明、外抛光的医用硅胶管作为分流栓放置于切开的冠脉内能够减轻心肌缺血的程度。许多研究报道了术中应用分流栓可降低术后cTNI 水平,改善左心功能同时还增加吻合口的通畅率[18-22]。目前,经过改进的各种形式的分流栓已普遍的应用心脏外科、血管外科及神经外科中[23-26]。因此,本研究首次尝试将腔内分流技术应用于大鼠腹腔异位心脏中。研究结果表明,与大多数文献中报道相符,传统组完全阻断腹主动脉的时间为60 min 左右[4],改进组在应用分流栓后可见缺血时间缩短为20 min 左右,并且将一次长阻断血管时间分割为数次较短的阻断时间,这不仅降低了缺血损伤的程度,还提高了下肢肌肉组织对缺血的耐受能力[25]。肌红蛋白作为骨骼肌和心肌组织损伤的标志物之一,其敏感性较高,但特异性不高。本研究中,移植心脏因缺血再灌注损伤而出现肌红蛋白升高,这可能与受体骨骼肌因缺血再灌注损伤导致肌红蛋白升高发生混淆。本研究中检验大鼠CKM 及LDH,主要分布于骨骼肌,其升高显示骨骼肌受损的特异性较高。相较于传统组,由于改进组缩短了腹主动脉阻断时间,其远端组织缺血时间显著减少,下肢肌肉细胞损伤明显减少,血清中的损伤标志物显著降低。
在本研究中,从右肾动脉水平至髂总静脉分叉处分离大鼠腹主动脉及下腔静脉,根据所分离血管的长度选取不同长度的分流栓。由于术中夹闭了右肾动脉水平的腹主动脉,所以置入分流栓的上端是无法超越此水平面的,更无法到达腹腔干的水平。因此,不存在影响双侧肾动脉和腹腔干血流的问题。
本研究中,结扎固定分流栓的两端能有效控制吻合口出血并保持术野清晰,这也是应用分流栓的重要优势之一。血管腔内分流栓还发挥着支撑管壁、保持良好的血管立体形态的作用,不仅降低了吻合血管的难度,还可避免误伤血管后壁[8]。对于操作者而言,我们改进了技术后可以赢得更多宝贵时间来吻合血管,不仅提高了手术的成功率,而且缩短了操作者的学习曲线。
本研究予以适量的肝素可预防分流栓内及远端血管内血栓形成,还可以减低吻合口血栓形成的风险,这一点可从肌肉组织的病理切片中得到部分证实。传统方法不仅存在静脉淤血和动脉充血情况,而且长时间的缺血还可能破坏血管内皮结构,从而诱发局部严重的血栓形成事件。虽然肝素抗凝会增加手术出血量,但是较快的吻合速度及良好的吻合质量足以抵消其带来的不良影响[27]。
本研究也存在着一些局限性。例如,由于没有专门的血管分流栓,自制分流栓在直径上与血管腔不能完全匹配;分流栓在置入及取出过程中可能出现吻合口撕裂;也有报道说血管腔内分流栓可导致血管内皮损伤[28-30]。
总之,在大鼠腹腔异位心脏移植术中,应用血管内分流技术可以使血管阻断的时间缩短,吻合血管的难度下降,手术的成功率增加。

