头针疗法联合重复经颅磁刺激对脑卒中大鼠神经功能的改善作用及对PKA/CREB信号通路的影响
戈 蕾邹玉安王晓娜
(1.河北北方学院附属第一医院康复医学科,河北张家口 075000;2.河北北方学院附属第一医院神经内科,河北张家口 075000)
脑卒中是临床常见脑血管疾病,致残率、致死率高,已成为影响人类生存的重大疾病之一[1]。脑组织对氧敏感性高,供血供氧不足可引起大量神经元死亡,即使及时恢复血供仍不可避免,因此,如何积极有效改善脑卒中后神经功能的恢复成为研究重点和难点[2]。头针疗法是根据中医脏腑经络理论,头部取穴后进行针刺治疗各种疾病的疗法[3]。重复经颅磁刺激(repetitive transcranial magnetic stimulation,rTMS)是用不同频率磁信号无衰减刺激大脑神经、外周肌肉等部位从而达到治疗目的的一种方法[4]。近年来,临床研究证实,头针疗法及rTMS 对脑卒中后运动、认知等神经功能障碍均改善作用,两者配合应用效果确切,但其具体调控机制仍不明确[5]。本研究通过构建局灶性脑卒中大鼠模型,评估头针疗法联合rTMS 对神经功能损伤的改善情况,并进一步探讨其具体调控机制,为临床治疗局灶性脑卒中提供理论依据。
1 材料和方法
1.1 实验动物
SPF 级雄性 Wistar 大鼠,50 只,8 周龄,体重180~220 g,由河北省实验动物中心提供[SCXK(冀)2018-004],动物饲养在河北省实验动物中心[SYXK(冀)2018-008],实验经河北省实验动物中心动物审批(IACUC20170324),并按实验动物使用的3R 原则给予人道的关怀。
1.2 主要试剂与仪器
BCA 蛋白定量分析试剂盒(批号:23227,美国Thermo 公司);兔抗大鼠蛋白激酶A(protein kinase A,PKA)单抗、环磷腺苷反应元件结合蛋白(cyclic adenosine response element binding protein,CREB)单抗、磷酸化 CREB(phosphorylation-CREB,p-CREB)单抗(一抗,批号:ab38949、ab32515、ab32096)、辣根过氧化物酶标记的 PKA、CREB、p-CREB IgG 抗体(二抗,批号:ab5815、ab32096、ab25417),(美国Abcam 公司);LH202H 韩氏治疗仪(北京华威有限公司);磁刺激器及圆形线圈(丹麦Dantec 公司);Morris 水迷宫及图像自动采集和处理系统(基尔顿生物科技(上海)有限公司);电泳仪、CheniDoc XRS化学发光成像分析系统(美国Bio-Rad 公司)。
1.3 实验方法
1.3.1 模型制备
参考文献[6]应用线栓法制备局灶性脑卒中模型大鼠:腹腔注射0.4%戊巴比妥钠麻醉,颈部消毒备皮,暴露颈总动脉,微小动脉夹夹闭颈总动脉,颈外动脉残端剪一直径0.2 mm 小口,并逆向插入尼龙线约18 mm(尼龙线头部加热使之为球形),结扎颈外动脉残端小口,缝合皮肤,尼龙线总长度约4 cm。缺血2 h 后,轻握大鼠外拉尼龙线,至有阻力感时提示尼龙线已至颈外动脉残口,恢复大脑中动脉血供,剪断体表尼龙线;术后自由饮水、单笼饲养。模型组、头针组、rTMS 组、联合组大鼠按照上述方法制备模型。术后24 h 评估建模情况,0 分:提尾实验前爪伸直,无神经功能缺陷;1 分:提尾实验左前肢屈曲;2 分:行走时向左转圈;3 分:向偏瘫侧倾倒;4分:不能行走、意识昏迷。1 ~3 分大鼠模型制备成功,参与后续实验。假手术组除不插入尼龙线栓外,其余操作同前。
1.3.2 分组及干预方法
50 只大鼠随机分为假手术组、模型组、头针组、rTMS 组、联合组,各 10 只。模型组 9 只、头针组 8 只、rTMS 组 8 只、联合组 9 只建模成功,术后24 h 开始干预。头针组给予头针疗法:大鼠穴位依据华兴邦等[7]编写的大鼠穴位图谱进行定位,依据《头针穴名国际标准化方案》选穴:顶颞后斜线、顶颞前斜线;采用30 号一次性无菌针灸针,进针深度约5 mm,进针后接通韩氏治疗仪(疏密波、频率2/100 Hz、电流强度2 mA),每次20 min,每天 1 次,共10 d。rTMS 组给予 rTMS:圆形线圈紧贴头皮固定于大脑右半球,线圈中心位于右耳前约1 cm,设置磁刺激器刺激频率0.5 Hz,脉冲刺激强度峰值2T,输出强度70%,连续20 次重复刺激为1 组,每天2 组,共10 d。联合组给予头针疗法联合rTMS,方法及疗程同上,首先给予rTMS,然后进行头针疗法,间隔2 h。模型组和假手术组不做处理。
1.3.3 神经功能缺损评分及行为学测试
末次干预后进行大鼠神经功能缺损评分,评分方法同前:0 分:提尾实验前爪伸直,无神经功能缺陷;1 分:提尾实验左前肢屈曲;2 分:行走时向左转圈;3 分:向偏瘫侧倾倒;4 分:不能行走、意识昏迷。神经功能缺损评估结束后进行Morris水迷宫实验,按照文献[8]方法进行操作,实验包括两部分,定位巡航实验(头针、rTMS 干预结束后次日开始,连续5 d)及空间探索实验(定位巡航实验结束后次日,共1 d),记录定位巡航第5天各组大鼠平均逃避潜伏期,记录空间探索实验大鼠在目标象限停留时间,两指标反应大鼠学习及记忆能力。
1.3.4 脑组织标本采集及染色
处死各组大鼠,置于生理盐水冰盘,于颞叶以梗死灶为中心冠状切脑组织(包括梗死灶周围皮质),切 4 刀共 5 片脑组织,间隔 2 mm 左右。其中每只各取1 片置于2% TTC 中避光染色,孵育30 min(37℃),取出脑片放入10%福尔马林中避光保存过夜,拍照观察梗死灶情况。每只另取1 片置于10%中性甲醛中固定,进行常规石蜡包埋,以梗死灶为中心进行冠状位切片,取切片经二甲苯脱蜡、乙醇梯度脱水、步骤,进行常规苏木精-伊红(hematoxylin eosin,HE)染色,中性树胶封片后于光学显微镜下观察梗死灶周围皮质组织病理学改变。
1.3.5 PKA、CREB、p-CREB 蛋白相对表达量检测
取部分梗死灶脑组织(包括梗死灶周围皮质、海马及侧脑室),液氮中研磨转至离心管,加入0.5 mL 细胞裂解液,于冰上孵育裂解20 min,12000 r/min 离心15 min,离心半径12 cm,取离心上清液,进行BCA 蛋白定量,取待测样本进行SDS-PAGE凝胶电泳分离,将分离胶置于电转仪上恒定电压转膜,转膜后加入封闭液室温孵育2 h,加入稀释一抗(1 ∶500),4℃摇床过夜,PBST 洗涤后加入稀释二抗(1 ∶5000),室温继续孵育2 h,PBST 再次洗涤3 次后,于暗室中曝光和显影,凝胶成像系统扫描后,运用图像分析软件分析各条带灰度值,相对表达量以 PKA、CREB、p-CREB 与 β-actin 灰度值表示。
1.4 统计学方法
采用SPSS 20.0 统计软件分析数据,计量资料均以平均数±标准差(±s)表示,计量资料经正态分布和方差齐性检验后,多样本比较采用单因素方差分析(One-way ANOVA),两两之间比较采用LSD检验。P<0.05 为差异有统计学意义。
2 结果
2.1 各组大鼠一般情况
假手术组一般状况正常,模型组造模期间均出现左前肢瘫痪、蜷卧懒动、精神萎靡、消瘦等情况,头针组和rTMS 组干预后精神状态稍有好转,但左前肢仍瘫痪;联合组干预后精神状态较头针组和rTMS 组好转,左前肢瘫痪明显减轻。
2.2 神经功能缺损程度评分比较
神经功能缺损程度评分组间比较,差异有统计学意义(F=137.246,P<0.001);与假手术组比较,模型组、头针组、rTMS 组、联合组神经功能缺损程度评分均升高(P<0.05);与模型组比较,头针组、rTMS 组、联合组神经功能缺损程度评分均降低(P<0.05),且联合组低于头针组、rTMS 组(P<0.05);头针组与rTMS 组神经功能缺损程度评分比较,差异无统计学意义(P>0.05),见表1。
2.3 逃避潜伏期及目标象限停留时间比较
逃避潜伏期、目标象限停留时间组间比较,差异有统计学意义(P<0.05);与假手术组比较,模型组、头针组、rTMS 组及联合组逃避潜伏期均延长,目标象限停留时间均缩短(P<0.05);与模型组比较,头针组、rTMS 组及联合组逃避潜伏期均缩短,目标象限停留时间均延长(P<0.05);与头针组和rTMS组比较,联合组逃避潜伏期缩短,目标象限停留时间延长(P<0.05);头针组与rTMS 组逃避潜伏期、目标象限停留时间比较,差异无统计学意义(P>0.05),见表2。
2.4 各组脑梗死灶TTC 染色观察
假手术组脑组织TTC 染色均匀;模型组缺血侧大脑皮层可见白色梗死灶,并伴有轻度糜烂;头针组、rTMS 组和联合组缺血侧大脑皮层梗死面积缩小,脑组织外观有所改善,联合组改善效果最为明显,见图1。
2.5 梗死灶周围皮质病理组织学观察
HE 染色结果显示,假手术组大脑皮质结构正常,神经元细胞形态正常;模型组脑组织结构疏松,呈现筛网状液化性坏死状态,神经元大量消失,多量小胶质细胞浸润(图2B);头针组和rTMS 组脑组织结构破坏轻于模型组,仍可见部分正常神经元形态,但部分神经元细胞核周围细胞质呈现空泡化、水肿状态;联合组脑组织结构及神经元形态趋于正常,见图2。
表1 神经功能缺损程度评分比较( ±s,分)Table 1 Comparison of neurological deficit scores ( ±s,score)
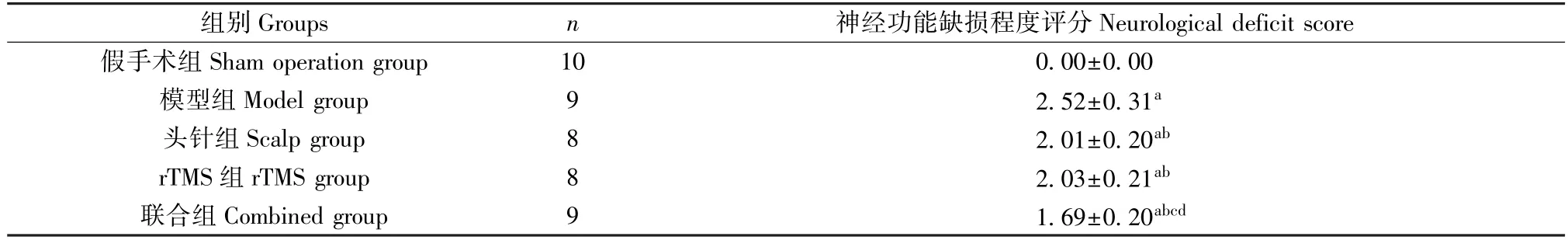
表1 神经功能缺损程度评分比较( ±s,分)Table 1 Comparison of neurological deficit scores ( ±s,score)
注:与假手术组比较,aP<0.05;与模型组比较,bP<0.05;与头针组比较,cP<0.05;与rTMS 组比较,dP<0.05。Note.Compared with sham operation group,aP<0.05.Compared with model group,bP<0.05.Compared with scalp group,cP<0.05.Compared with rTMS group,dP<0.05.
组别Groups n 神经功能缺损程度评分Neurological deficit score假手术组Sham operation group 10 0.00±0.00模型组Model group 9 2.52±0.31a头针组Scalp group 8 2.01±0.20ab rTMS 组 rTMS group 8 2.03±0.21ab联合组Combined group 9 1.69±0.20abcd
表2 逃避潜伏期及目标象限停留时间比较( ±s,s)Table 2 Comparison of escape latency and target quadrant stay time

表2 逃避潜伏期及目标象限停留时间比较( ±s,s)Table 2 Comparison of escape latency and target quadrant stay time
注:与假手术组比较,aP<0.05;与模型组比较,bP<0.05;与头针组比较,cP<0.05;与rTMS 组比较,dP<0.05。Note.Compared with sham operation group,aP<0.05.Compared with model group,bP<0.05.Compared with scalp group,cP<0.05.Compared with rTMS group,dP<0.05.
组别Groups n 逃避潜伏期Escape latency目标象限停留时间Target quadrant stay time假手术组 Sham operation group 10 26.59±3.17 45.11±3.69模型组Model group 9 49.88±4.12a 20.56±2.85a头针组 Scalp group 8 44.30±3.90ab 28.73±2.94ab rTMS 组 rTMS group 8 43.69±3.85ab 29.05±3.07ab联合组 Combined group 9 38.21±3.31abcd 33.24±3.12abcd
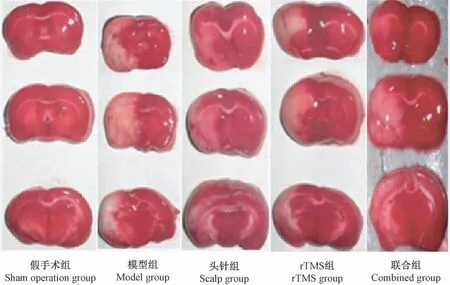
图1 各组脑梗死灶TTC 染色观察Figure 1 General observation of cerebral infarction in each group
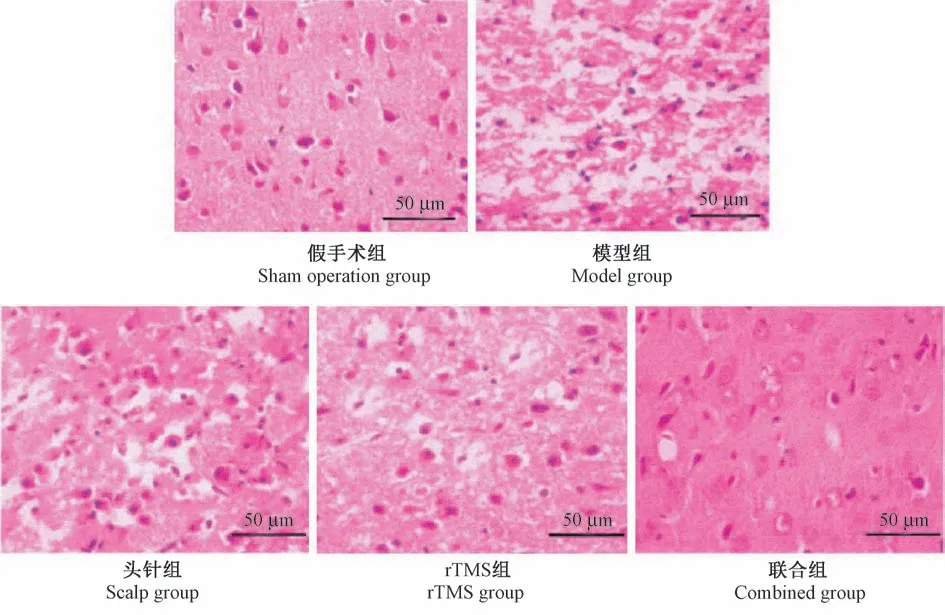
图2 梗死灶周围皮质HE 染色(n=4)Figure 2 HE staining around the infarcted cortex
2.6 脑组织 PKA、CREB、p-CREB 蛋白相对表达量比较
脑组织PKA、p-CREB 蛋白相对表达量组间比较,差异有统计学意义(P<0.05);脑组织CREB 蛋白相对表达量组间比较,差异无统计学意义(P>0.05)。与假手术组比较,模型组、头针组、rTMS 组及联合组PKA、p-CREB 蛋白相对表达量均降低(P<0.05);与模型组比较,头针组、rTMS 组及联合组PKA、p-CREB 蛋白相对表达量均升高(P<0.05);联合组PKA、p-CREB 蛋白相对表达量高于头针组和rTMS 组(P<0.05),而头针组与 rTMS 组比较,差异无统计学意义(P>0.05),见图3A、3B。
3 讨论
近年来我国脑卒中发病率呈升高趋势,其发病原因多种多样,如高血压、糖尿病、心脏病等多种因素均可引起动脉粥样硬化,进而导致脑组织缺血缺氧,神经元结构和功能丧失,致残、致死风险高[9-11]。脑组织血供恢复后的继发性损伤,大量自由基、炎症因子等可继发性引起神经元死亡,影响神经功能的恢复[12]。因此,及时减轻脑卒中后继发性神经功能损伤,同样对疾病的治疗及预后有重要意义。

图3 脑组织PKA、CREB、p-CREB 蛋白表达情况(n=4)Figure 3 Expression of PKA,CREB and p-CREB proteins in brain tissue
头针疗法属中医传统治疗脑卒中方法,现代研究证实,头针疗法可通过促进脑组织海马神经元增殖,改善脑卒中后认知功能障碍[13]。研究显示,头针疗法可通过改善气虚血瘀证脑卒中患者血液流变学指标,进而改善患者认知功能[14]。本研究中头针组大鼠神经功能损伤评分较模型组均升高,逃避潜伏期均缩短,目标象限停留时间均延长,证实头针疗法对脑卒中认知神经功能的改善作用。既往研究发现,rTMS 可有效增加脑卒中大鼠血流量,进一步将该疗法用于临床,取得一定成效[15]。靳静娜等[16]研究显示,rTMS 联合运动训练可有效激活脑组织静息态脑网络,促进运动功能恢复。以上研究说明rTMS 对脑卒中后脑组织活性恢复具有显著恢复作用。本研究中rTMS 组大鼠神经功能损伤评分较模型组均升高,逃避潜伏期均缩短,目标象限停留时间均延长,提示rTMS 具有改善脑卒中大鼠神经功能的作用。此外,本研究将头针疗法和rTMS疗法联合应用后,神经功能损伤评分升高、逃避潜伏期均缩短、目标象限停留时间均延长现象更为显著,HE 染色显示联合组脑组织结构破坏最轻,证实头针疗法联合rTMS 对脑卒中大鼠神经功能的改善具有协同加强作用。
本研究发现,头针组、rTMS 组及联合组PKA、p-CREB 蛋白表达均高于模型组,且联合组高于头针组和rTMS 组,说明头针疗法联合rTMS 可能通过激活PKA/CREB 信号通路发挥改善脑卒中大鼠神经功能作用。PKA 在哺乳动物神经元内表达丰富,既往研究已证实,PKA 是突触可塑性必须因子,对长时记忆有重要作用[17]。CREB 是位于细胞核内的转导因子,可被PKA 磷酸化激活,从而启动下游靶基因转录,刺激腺苷酸环化酶调节细胞内环磷酸腺苷浓度,参与介导神经递质的调控[18-19]。Teng等[20]研究表明,CREB 磷酸化表达增强有助于改善缺血性脑损伤大鼠认知、记忆能力。屈夏夏等[21]证实,PKA/CREB 信号通路在改善阿尔兹海默病小鼠空间学习、记忆能力方面发挥重要调控作用。上述研究均证实PKA/CREB 信号通路在脑神经元损伤修复过程中发挥重要调控作用,本研究应用头针组及rTMS 联合干预后PKA/CREB 信号通路被激活,且大鼠神经功能相应改善,提示联合干预可能通过激活该信号通路发挥调控作用。
综上所述,头针疗法联合rTMS 可有效改善脑卒中大鼠神经功能,其作用机制可能通过激活PKA/CREB 信号通路发挥调控作用,为头针疗法联合rTMS 应用于缺血性脑卒中临床治疗提供理论依据。

