抗痫增智颗粒调控TLR4/HMGB1/p-IκB-α信号通路保护癫痫幼鼠海马神经元的分析
张英英单海军娄元俊郭 鑫
(河南省中医院儿童脑病康复科,郑州 450002)
癫痫是小儿时期常见的神经系统综合征。托吡酯属于一种广谱抗癫痫新药,既往研究证实该药物可显著控制小儿癫痫的发作症状,但综合效果仍有待改进[1]。中医学认为,小儿癫痫可归属于“痫证”范畴,多为胎中受惊、遗传缺陷、产时损伤等所致,应以抗痫增智为治则。已有研究证实抗痫增智颗粒对小儿癫痫的疗效确切[2]。但目前人们关于抗痫增智颗粒治疗小儿癫痫的作用机制认识尚浅。Toll 样受体 4 (TLR4)/高迁移率族蛋白 1(HMGB1)通路可参与海马神经元的生长、增殖和凋亡,是目前公认的小儿癫痫治疗的靶点[3-4]。核因子抑制蛋白 α(IκB-α)是 TLR4/HMGB1 信号通路下游蛋白,磷酸化 IκB-α(p-IκB-α) 可受 TLR4/HMGB1 通路的调控参与小儿癫痫海马神经元病理变化[5]。有研究发现[6]癫痫模型海马区TLR4/HMGB1/p-IκB-α 通路被激活,可导致神经元变性坏死,学习/记忆能力减弱,还可加重海马区组织病理改变,因此可将该通路作为癫痫治疗的靶点。然而抗痫增智颗粒是否可调控该通路减轻小儿癫痫海马神经元病理改变尚未可知。鉴于此,本研究特设计SD 幼鼠对照试验,对比不同浓度抗痫增智颗粒药液与托吡酯对癫痫幼鼠行为学、学习/记忆能力、海马区神经元病理的影响,并探讨前者对TLR4/HMGB1/p-IκB-α 通路是否有调控作用及其具体机制。
1 材料和方法
1.1 实验动物
清洁级SD 幼鼠近交系60 只,雌雄各半,3 周龄,50~70 g,购自北京维通利华实验动物技术有限公司[SCXK(京)2018-0001],动物在郑州大学实验动物中心饲养[SYXK(豫)2018-0003],经郑州大学实验动物中心动物伦理审批(IACUC-20180512-13),并按实验动物使用的3R 原则给予人道的关怀。
1.2 主要试剂与仪器
托吡酯(西安杨森制药有限公司,25 mg,批号:201708001);抗痫增智颗粒(天津中医学院第一附属医院杏林药厂,每克相当于生药含量1.5 g,批号:201710007);戊四氮(PTZ)(上海博顿生物化工有限公司,纯度≥98%,批号:20170415A);4%多聚甲醛磷酸盐缓冲液(北京华科盛精细化工产品贸易有限公 司,批 号: 20170813C); TRIzol 试 剂 ( 美 国Invitrogen 公司,批号:YY17051801A);逆转录试剂盒(北京全式金生物技术,批号:20171104B);蛋白定量检测试剂盒(上海杰美基因医药科技有限公司,批号:170213004);兔抗鼠 TLR4、HMGB1、IκB-α、p-IκB-α 单克隆抗体,山羊抗兔 TLR4、HMGB1、IκB-α、p-IκB-α 多克隆抗体(酶标记)(美国 ACDAM公 司,批 号: 170705001、170528003、170517007、170708006、170530001、170520012)。
水迷宫(直径130 cm、高50 cm、水深30 cm)(美国NatureGene 公司);C1000 型聚合酶链反应(PCR)扩增仪(美国BioRad 公司);DYCZ-20G 基因电泳仪(北京六一仪器厂);LG10 型离心机(北京医用离心机厂);Trans-Blot 型转膜仪(美国 BioRad 公司);DYCZ-24A 型蛋白电泳仪(北京六一仪器厂)。
1.3 实验方法
1.3.1 实验动物分组、建模
于60 只SD 幼鼠中随机取10 只记为正常组,余50 只建立癫痫模型。建模方法:腹腔注射PTZ,60 mg/kg,单次给药。按照Racine 分级标准[7],发作次数≥4 级且持续时间≥30 min 认为建模成功。将建模成功的大鼠随机分组。阳性组予以托吡酯5.9 mg/kg 溶于2 mL/100 g 生理盐水中灌胃,低浓度组、中浓度组、高浓度组予以抗痫增智颗粒药液灌胃,抗痫增智颗粒质量分别是 1.28 g/kg、2.56 g/kg、5.12 g/kg,模型组和正常组予以生理盐水灌胃,均每天1 次,干预4 周。
1.3.2 干预前后行为学、学习/记忆能力评价
采用Racine 分级标准分别于干预前后评价行为学,0 级认为无癫痫发作,1 级认为点头或头部抽搐,2 级认为有全身肌阵挛,3 级认为有头部抽搐加前肢阵挛,4 级认为跌倒,5 级认为全身强直-阵挛性惊厥,分级越高行为学异常越严重;分别于干预前后采用Morris 水迷宫实验评价学习/记忆能力,水温控制(24±2)℃。检测前需进行适应性训练,连续5 d 后测定幼鼠搜索平台时间、在原平台象限探索时间百分比,具体参照说明书检测。
1.3.3 海马区病理变化
干预后以4%多聚甲醛磷酸盐缓冲液灌注固定,迅速取大脑海马区组织,石蜡包埋、连续切片、HE 染色,具体按照试剂盒说明书操作。对神经元损伤程度进行分级,将未见神经元损伤记为0 级;将有散在神经元损伤记为1 级;将有片状神经元损伤记为2 级;将几乎全部神经元损伤记为3 级。
1.3.4 海马区 TLR4、HMGB1 mRNA 表达检测
剥离新鲜的海马区组织,采用逆转录实时定量PCR(qRT-PCR)检测,液氮研磨,加入TRIzol 试剂,提取总核糖核酸,鉴定后采用全式金逆转录试剂盒将其逆转录为cDNA,配置PCR 反应体系。TLR4 上游引物序列: 5’-ACGTGCTAGATCGATATAGCTA GAT-3’,下游引物序列:5’-CTGATAGCTAGATTT AGCTATAGCTAGATCGAT-3’;HMGB1 上游引物序列: 5 ’-TAGGCTGCGCGCGTAGCTAGATCGATGAT-3’; 下 游 引 物 序 列: 5’-AGCTAGATCGATTTT AGCTAGAGCATGAT-3’;内参为 β-actin,上游引物序 列: 5’-TAGCTAGATAGCTATGATCTAGATTAGC TAG-3’,下游引物序列:5’-TAGCTAGATAGCTAT AGCTATATGCATAGCTA-3’。93℃ 2 min,40 个循环:92℃ 1 min、72℃ 1.5 min、54℃ 1 min,最后 72℃5 min。计算相对表达量。
1.3.5 海马区 TLR4、HMGB1、IκB-α 蛋白表达及 p-IκB-α 检测
同上述方法取海马区组织,采用蛋白质免疫印迹法(Western blot)检测。裂解匀浆,抽提离心分离,取蛋白定量检测试剂盒定量。取40 μg 样品加入上样缓冲液加热变性,转膜、封闭。加入一抗,温室过夜,洗膜;加入二抗,37℃杂交2 h。洗膜、显影,计算目的相对表达量。
1.4 统计学方法
采用SPSS 24.0 软件进行统计学分析,计数资料分布采用秩和检验;多样本计量资料以平均数±标准差(±s)单因素方差分析,并以SNK-q检验每2 样本差异。P<0.05 为差异有统计学意义。
2 结果
2.1 干预前后行为学变化
50 只SD 幼鼠中共有43 只建模成功,建模成功率为86.00%,将建模成功的SD 幼鼠随机分为模型组、阳性组、低浓度组、中浓度组和高浓度组,分别有 9 只、8 只、9 只、9 只和 8 只。Racine 分级结果:正常组:干预前0 级有10 只,干预后0 级有10 只;模型组:干预前 4 级 6 只、5 级 3 只,干预后 4 级 7只、5 级 2 只;阳性组:干预前 4 级 4 只、5 级 4 只,干预后 2 级、3 级、4 级、5 级均 2 只;低浓度组:干预前4 级 5 只、5 级 4 只,干预后 3 级 4 只,4 级 3 只,5 级2 只;中浓度组:干预前 4 级 4 只、5 级 5 只,干预后 1级 1 只,2 级、3 级、4 级、5 级均 2 只;高浓度组:干预前 4 级 4 只、5 级 4 只,干预后 1 级 3 只,2 级 4 只,3级1 只。干预前模型组、阳性组、低浓度组、中浓度组和高浓度组Racine 分级与正常组差异均有统计学意义(Z=7.063、7.587、7.412、7.069、7.185,均P=0.000),干预后阳性组、低浓度组、中浓度组和高浓度组Racine 分级与干预前差异均有统计学意义(P<0.05),且与模型组比较差异均有统计学意义(Z= 15.836、11.207、16.309、21.235,均P=0.000),且3 浓度组的作用呈剂量依赖性,中浓度组与阳性组相当。
2.2 干预前后学习/记忆能力变化
干预前后各组幼鼠搜索平台时间差异均有统计学意义(F=38.975、59.303,均P=0.000),在原平台象限探索时间百分比对比差异也均有统计学意义(F=41.202、67.385,均P=0.000)。干预后正常组、模型组均与干预前相近(t=0.268、0.135,P=0.812、0.907;t=0.976、0.803,P=0.101、0.315)。干预后阳性组、低浓度组、中浓度组和高浓度组搜索平台时间均较本组干预前缩短(t= 22.463、17.385、23.209、46.745,均P=0.000),在原平台象限探索时间百分比均较干预前减少(t= 16.975、10.266、18.376、24.253,均P=0.000);干预后与模型组比较,阳性组、低浓度组、中浓度组和高浓度组搜索平台时间均较本组干预前缩短(t= 22.746、18.905、23.204、29.763,均P=0.000),在原平台象限探索时间百分比均较干预前减少(t= 14.482、9.105、15.306、22.478,均P=0.000);干预后阳性组、中浓度组和高浓度组搜索平台时间均短于低浓度组(t=16.989、16.713、25.302,均P=0.000),在原平台象限探索时间百分比均少于低浓度组(t=13.143、13.296、22.478,均P=0.000);干预后高浓度组搜索平台时间短于阳性组和中浓度组(t=10.365、10.926,均P=0.000),在原平台象限探索时间百分比少于阳性组和中浓度组(t= 9.771、9.582,均P=0.000)。见图1。
2.3 海马区神经元病理变化
正常组海马区神经元排列整齐致密、边缘清晰,细胞呈圆形或椭圆形,核仁清晰,染色质均匀,形态正常;模型组海马区神经元排列紊乱,可见变性、坏死,神经元细胞肿胀、细胞核碎裂/溶解,神经元严重缺失,可见严重嗜神经现象;低浓度组海马区神经元排列散乱,有变性,部分神经元坏死、细胞核碎裂,有明显神经元缺失、嗜神经现象;阳性组和中浓度组海马区神经元部分排列紊乱,有变性,少部分神经元坏死,有神经元缺失、轻微嗜神经现象;高浓度组海马区神经元多排列整齐,边缘清晰,部分神经元细胞肿胀,少见变性、坏死。见图2。海马区神经元损伤分级对比差异有统计学意义(P<0.05),与正常组比较,模型组分级升高(t=11.320,P=0.000);与模型组比较,阳性组、低浓度组、中浓度组、高浓度组分级均下降(t= 5.271、2.142、5.283、7.414,P=0.000、0.048、0.000、0.000);阳性组、中浓度组和高浓度组分级均低于低浓度组(t=3.035、2.979、4.920,P=0.008、0.009、0.000);高浓度组分级低于阳性组、中浓度组(t= 2.447、2.681,P=0.027、0.017)。见表1。
2.4 海马区组织 TLR4、HMGB1 mRNA 表达
各组幼鼠海马区组织TLR4、HMGB1 mRNA 表达对比差异均有统计学意义(F=19.878、18.706,均P=0.000);与正常组比较,模型组幼鼠海马区组织TLR4、HMGB1 mRNA 表 达 均 升 高 (t= 36.976、35.803,均P=0.000),阳性组、低浓度组、中浓度组和高浓度组幼鼠海马区组织TLR4、HMGB1 mRNA表达均低于模型组(t= 33.072、46.286、32.716、66.597,均P= 0.000;t= 31.307、44.269、32.026、64.383,均P=0.000);阳性组、中浓度组和高浓度组幼鼠海马区组织TLR4、HMGB1 mRNA 表达均低于低浓度组(t= 22.017、20.185、35.696,均P=0.000;t=21.203、19.875、34.302,均P=0.000);高浓度组幼鼠海马区组织TLR4、HMGB1 mRNA 表达均低于阳性组、中浓度组(t=12.165、11.859,均P=0.000;t=11.312、10.097,均P=0.000)。见图3。

图1 干预前后学习/记忆能力变化柱状图Figure 1 Histogram of learning/memory ability changes before and after intervention
2.5 海马区组织 TLR4、HMGB1、IκB-α 蛋白表达及 p-IκB-α 水平
各组幼鼠海马区组织TLR4、HMGB1 蛋白表达及p-IκB-α 水平对比差异均有统计学意义(F=75.763、71.289、46.315,均P=0.000);与正常组比较,模型组幼鼠海马区组织TLR4、HMGB1 蛋白表达及 p-IκB-α 水平均升高(t=34.312、39.306、41.252,均P=0.000),阳性组、低浓度组、中浓度组和高浓度组幼鼠海马区组织TLR4、HMGB1 蛋白表达及p-IκB-α 水 平 均 低 于 模 型 组 (t= 35.206、41.863、36.704、88.915,均P= 0.000;t= 30.207、40.589、34.302、84.071,均P= 0.000;t= 15.968、14.207、16.806、22.283,均P=0.000);阳性组、中浓度组和高浓度组幼鼠海马区组织TLR4、HMGB1 蛋白表达及 p-IκB-α 水 平 均 低 于 低 浓 度 组 (t= 26.158、19.302、33.187,均P= 0.000;t= 21.289、17.635、31.307,均P=0.000;t=18.163、11.202、22.071,均P= 0.000);高浓度组幼鼠海马区组织 TLR4、HMGB1 蛋白表达及 p-IκB-α 水平均低于阳性组、中浓度组(t=16.985、17.315,均P=0.000;t=15.342、15.038,均P= 0.000;t= 10.313、10.971,均P=0.000);各组幼鼠海马区组织IκB-α 蛋白表达均相近(F=1.206,P=0.414)。见图4、图5。
表1 海马区神经元损伤分级对比( ±s;级)Table 1 Comparison of neuronal injury grades in hippocampus ( ±s; grades)
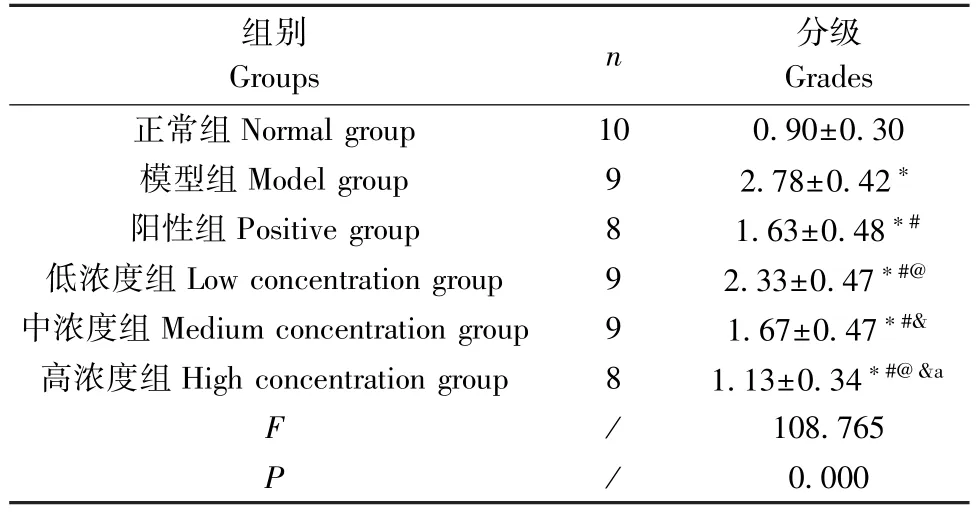
表1 海马区神经元损伤分级对比( ±s;级)Table 1 Comparison of neuronal injury grades in hippocampus ( ±s; grades)
注:与正常组比较,*P<0.05;与模型组比较,#P<0.05;与阳性组比较,@ P < 0.05; 与 低 浓 度 组 比 较,&P < 0.05; 与 中 浓 度 组 比较,aP<0.05。Note.Compared with the Normal group,*P<0.05.Compared with the model group,#P<0.05.Compared with the positive group,@P<0.05.Compared with the low concentration group,&P<0.05.Compared with the medium concentration group,aP<0.05.
组别Groups n 分级Grades正常组Normal group 10 0.90±0.30模型组Model group 9 2.78±0.42*阳性组Positive group 8 1.63±0.48*#低浓度组Low concentration group 9 2.33±0.47*#@中浓度组Medium concentration group 9 1.67±0.47*#&高浓度组High concentration group 8 1.13±0.34*#@&a F/108.765 P/0.000
3 讨论
脑部神经元同步化异常放电是癫痫的基本特征,可损伤神经系统功能[8-9]。目前发现癫痫患儿以海马硬化、神经元丢失、大脑胶质细胞增生为病理基础,且海马神经元变性、凋亡等病理变化可直接影响病情与预后,故减轻小儿癫痫海马神经元病变尤为重要。
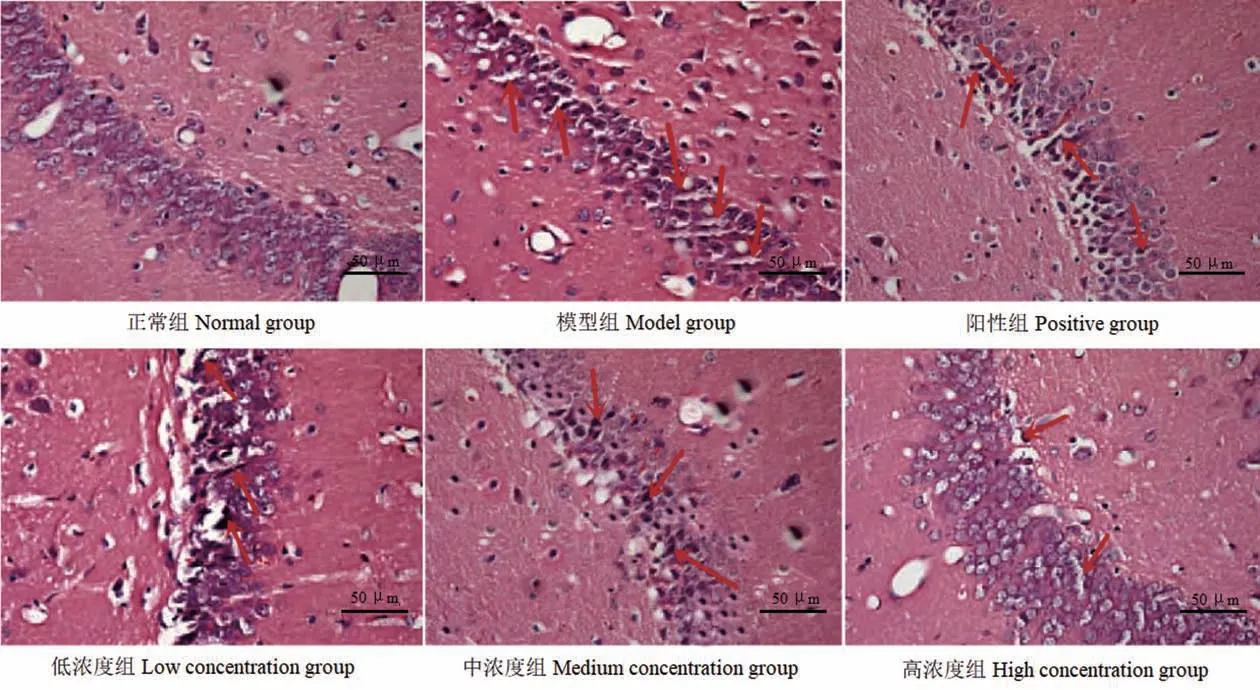
图2 海马区神经元病理变化(HE 染色)Figure 2 pathological changes of hippocampal neurons(HE staining)

图3 海马区组织TLR4、HMGB1 mRNA 表达柱状图Figure 3 Histogram of TLR4 and HMGB1 mRNA expressions in hippocampus
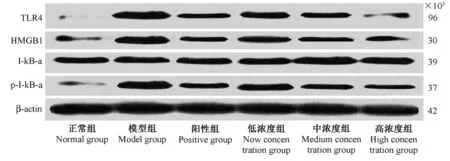
图4 海马区组织 TLR4、HMGB1、IκB-α 蛋白表达及 p-IκB-α 水平Figure 4 TLR4,HMGB1,IκB-α protein expression and P-IκB-α level in hippocampus

图5 海马区组织 TLR4、HMGB1、IκB-α 蛋白表达及 p-IκB-α 水平柱状图Figure 5 Histogram of expressions of TLR4,HMGB1,IκB-α protein and histogram of P-IκB-α level in hippocampus
小儿癫痫可出现行为学改变、学习/记忆能力下降等问题,而此类表现与海马神经元病理变化密切相关。本次研究中,干预后阳性组和3 浓度组行为学Racine 分级、学习/记忆能力均较本组干预前和模型组干预后显著改善,且干预后高浓度组作用最佳,显著优于阳性组,可知抗痫增智颗粒可改善癫痫幼鼠的行为学和学习/记忆能力,且高浓度的抗痫增智颗粒的作用优于托吡酯。抗痫增智颗粒由鹿茸、石菖蒲、菟丝子、胆南星、天麻、茯苓、陈皮、半夏、僵蚕、全蝎、冰片、甘草组成,善用活血通络、行气补血、通脑养神的中药材,可开窍醒脑、醒神益智,兼具祛邪扶正、顾护营卫,可达抗痫益智的功效。有既往报道证实抗痫增智类中成药对癫痫幼鼠有治疗作用[10],与本次研究结果相符。本研究病理检测结果还发现,阳性组和3 浓度组海马神经元病理变化均较模型组减轻,且高浓度组作用最佳,且病理分级对比结果与上述描述相一致,表明抗痫增智颗粒可有效减轻癫痫幼鼠海马神经元病变。
癫痫海马神经元病理变化与脑内炎症反应、免疫应答激活密切相关[11]。TLR4 是识别病原相关分子模式的受体,在诱导癫痫发作的过程中,PTZ 可被机体TLR4 识别引发免疫反应,活化TLR4 基因与蛋白表达,建立癫痫模型[12]。HMGB1 则属于核染色质成分,正常情况下其存在于细胞核,癫痫发作后海马神经元凋亡可释放大量HMGB1,且HMGB1 也可被TLR4 识别并激活,因此HMGB1 的表达水平被认为是衡量细胞凋亡率的重要指标[13-14]。正常生理条件下活化核转录因子κB 可与调节蛋白κB 抑制剂相结合生成IκB-α,以失活状态稳定存在于细胞质中。当细胞受到外源性刺激,TLR4/HMGB1 通路激活,活化核转录因子κB 活化,可转移入细胞核进而促进炎症反应,IκB-α 磷酸化水平增加,且炎症反应可参与海马神经元损伤,诱导癫痫发作[15]。国外 Walker 等[16]研究表明 TLR4/HMGB1/p-IκB-α 通路可作为癫痫治疗的作用靶点,可调控该通路减轻癫痫模型海马组织损伤。本次研究中,模型组TLR4、HMGB1 mRNA、TLR4、HMGB1 蛋白的相对表达量、p-IκB-α 水平均较正常组显著升高,阳性组和3 浓度组均较模型组显著下降,且高浓度组指标均优于阳性组,提示抗痫增智颗粒可能能够通过调控TLR4/HMGB1/p-IκB-α 通路减轻癫痫幼鼠海马神经元病变,且呈剂量依赖性,其中高浓度抗痫增殖颗粒对该信号通路的抑制效果优于托吡酯。
综上,抗痫增智颗粒可改善癫痫幼鼠的行为学、学习/记忆能力,还可减轻海马神经元损伤,其中高浓度药物的作用显著优于托吡酯,推测是通过抑制 TLR4/HMGB1/p-IκB-α 通 路 被 激 活,下 调TLR4、HMGB1 表达,控制 p-IκB-α 水平实现此作用的。

