硫和铜反应实验再探究
马文 孙影 贾卫国 熊言林

摘要: 硫的性质是高中化学元素化合物知识中重要的学习内容之一,针对学生中关于硫和铜反应的某些疑问,改进实验装置,并对反应产物进行X射线多晶衍射(XRD)表征,探讨硫和铜在不同温度和用量比条件下反应的产物,回应并澄清了学生存在的困惑,对网络资料和教科书中的一些表述进行了实验层面的论证与说明。
关键词: 硫和铜反应; X射线多晶衍射; 实验改进; 实验探究
文章编号: 10056629(2020)10007403
中图分类号: G633.8
文献标识码: B
1 问题的提出
硫是一种常见而又重要的非金属单质,化学性质比较活泼,在一定条件下,能够与金属反应生成金属硫化物。高中化学教科书以及百度作业帮等网络资料都显示硫与铜反应生成硫化亚铜。理由是硫单质的氧化性较氯气和氧气而言相对更弱,因此与变价金属反应时只能生成低价金属硫化物,即硫与铜反应生成硫化亚铜。在对芜湖市某普通高中124名高一学生的调查中发现,很多高中生对硫和铜反应产物的认识也有相同的看法。同时有一部分学生认为反应时的温度和反应物量的比例关系可能对产物也会有影响,学生普遍认为高温时易生成CuS,低温时易生成Cu2S,理由是温度越高氧化还原反应进行得越彻底,因此Cu能被氧化成最高价态;对于量比关系对产物的影响,一些学生依据木炭在氧气中燃烧的反应,类比推理得出硫粉少量时会生成Cu2S,过量时则生成CuS。基于对硫和铜反应存在的困惑,笔者改进了实验装置,通过控制反应温度和反应物用量比例进行深入探究,并对反应产物进行X射线多晶衍射(XRD)表征,探讨在不同温度和用量比条件下硫和铜反应的产物。
2 相关文献内容简评
关于硫和铜反应实验的研究资料比较多,大多集中于实验装置的改进,而对反应条件及产物的探讨较少。蒯世定[1]将缠有细铜丝的塑料管直接伸入加热的试管中与硫蒸气反应。杨育民[2]将试管截短,加快硫蒸气与铜丝的接触,但都没有处理好副产物二氧化硫的污染问题。盛锡铭[3]将缠有细铜丝的铁丝固定在大试管的橡皮塞上,将装有湿碱石灰的球形干燥管连接在大试管上端,吸收反应过程中产生的二氧化硫。邓丽娟[4]用回形针将铜丝固定在具支试管的橡皮塞下部,并在具支试管的分支口处连接倒置的漏斗和浓氢氧化钠溶液吸收尾气。二者都是通过加热试管内的硫粉,直至形成硫蒸气与固定在上方的细铜丝接触发生反应。熊言林[5]同样利用具支试管和细铜丝进行实验,并增加了球形干燥管(内含浸有5%氢氧化钠的脱脂棉球)作为尾气处理装置。加热具支试管内的硫粉,待硫粉受热融化后,
立即将缠有多股细铜丝的玻璃棒伸入至具支试管内的硫蒸气区,可观察到细铜丝表面迅速变黑,实验现象明显,但实际操作过程中难度较大。王建芬[6]巧妙地利用安全套和蒸馏瓶设计了一套密闭装置,并在蒸馏瓶的支管处安装了装有干燥脱脂棉和润湿碱石灰的单球干燥管,加热蒸馏瓶内的硫粉,将细铜丝向下推动与硫蒸气接触发生反应。以上的改进实验虽然都考虑到了尾气的处理,但不论细铜丝的位置是固定还是可移动,都难以控制铜丝伸入试管内的深度,难以确保铜丝恰好在高浓度的硫蒸气区发生反应,若是触及到液态硫则会覆盖在铜丝表面,更是阻碍反应的进一步进行。以上研究也均未对产物进行检测。因此,为确保能够准确探寻影响硫和铜反应产物的因素,验证学生的观点正确与否,实验成功的关键在于两点: 一是需要排除氧气的干扰,该实验需要在封闭的环境中进行,且反应前需要排出装置内的空气;二是使装置能够在一个稳定的温度下加热,以保证反应物受热均匀,也便于检测不同温度条件对产物的影响。
3 实验过程与结果分析
3.1 实验装置
已有的改进实验都使用酒精灯加热,但考虑到酒精灯的内外焰温差较大,温度不易控制,且火焰的稳定性较差,加热效率低,因此本研究选择马弗炉作为反应的加热装置。马弗炉是一种实验室常用的加热设备,使用时可自主设定温度和加热时间,具有稳定性强、温度控制精确以及自动化程度高等优点,便于探查温度对产物的影响。我们设计了一种方便在马弗炉内加热的封闭装置。选择一根细长玻璃管,用酒精喷灯灼烧玻璃管的一端,待玻璃逐渐软化后用镊子用力夹住,直至管口完全封住。称取一定比例的硫粉和铜粉于上述冷却的玻璃管中,利用Schlenk操作技术[7]抽真空后,回充氮气,始终保持玻璃管一端与双排管的橡皮管连接,以防止空气进入。双手分别拿着玻璃管两端,用酒精喷灯灼烧玻璃管中部(注意此过程要不断旋转玻璃管,以保证受热均匀)。待灼烧部位稍软化后,双手反方向扭转玻璃管并逐渐向外拉伸,直至玻璃管分成两段且封口。密閉的反应发生装置如图1所示。
3.2 实验设计
通过文献调研发现,硫化铜的热稳定性较差,加热至220℃时分解生成硫化亚铜和硫单质。但也有资料表明硫化铜在507℃时才发生转化[8],为了明确硫化铜的分解温度,本研究尝试选择200℃、 220℃、 250℃和500℃作为反应温度;为了探究反应物的量比关系对产物是否有影响,控制硫和铜物质的量之比分别为0.8∶1、 1∶1和2∶1的比例关系进行实验。为方便实验数据的整理和记录,确保实验结果的准确性与严谨性,整个实验均控制铜粉的物质的量是0.001mol,硫粉的物质的量为0.0008mol、 0.001mol、 0.002mol。
(1) 实验操作步骤: 首先把马弗炉的温度设置为200℃,称取硫粉质量分别为0.0259g、 0.0320g、 0.0643g,铜粉质量分别为0.0642g、 0.0639g、 0.0641g,并混合均匀。将上述装有S、 Cu物质的量之比分别为0.8∶1、 1∶1和2∶1的药品的玻璃管放入马弗炉内加热1.5h,待反应结束后取出玻璃管,冷却至室温。随后再分别将温度设定在220℃、 250℃和500℃进行上述反应。
(2) 反应产物处理: 反应结束后可观察到部分玻璃管内有过量的硫单质凝结附着在内壁上,且由于反应前抽真空,回充氮气,无二氧化硫产生,不必考虑硫蒸气和二氧化硫等有害气体对环境的污染。为除去过量的硫粉,对产物进行如下处理: 将得到的产品放入离心管内,加入一定量的CS2,超声清洗2次后置于离心机内离心,倒去上清液,如此重复3~5次,以确保残余的硫粉能够完全除去;再用少量乙醇洗去CS2;最后将洗涤干净的产品放入烘箱内于50℃干燥2小时。
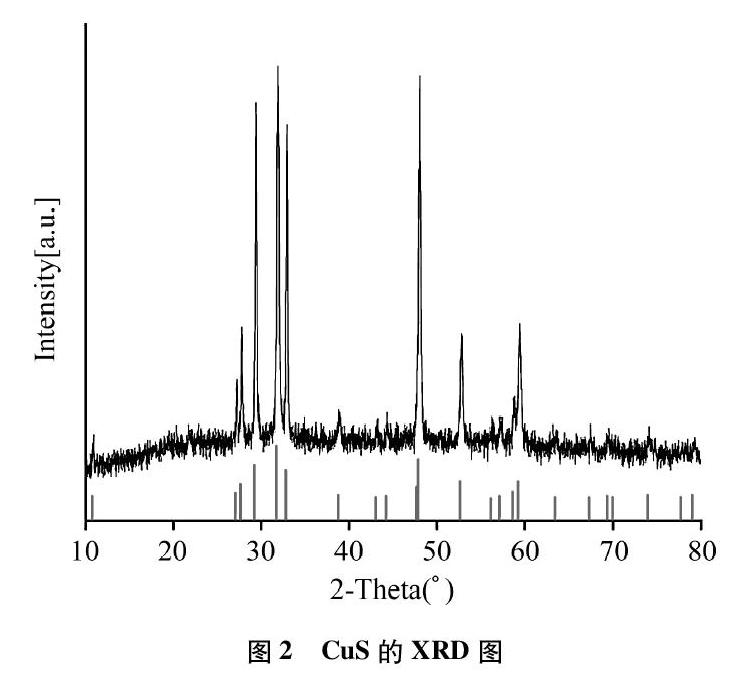
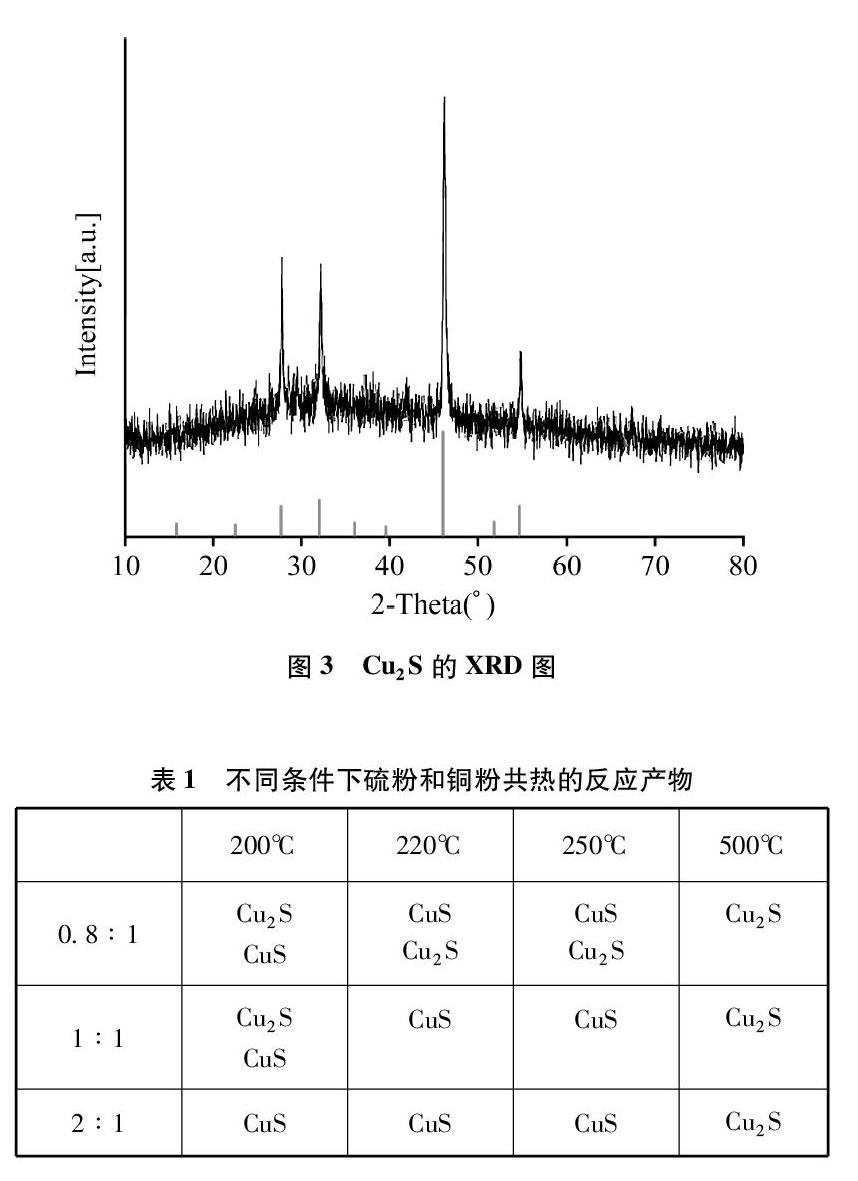
(3) 反应产物检测分析: 分别对不同条件下反应得到的产物进行了XRD表征分析,对照标准卡片,发现所得产物的特征峰与CuS的特征峰一致,确定产物为CuS(见图2)。此外,还有部分条件下反应产物为Cu2S(见图3),以及两者的混合物。
为了明确硫化铜在什么温度下分解,选取了上一步骤中制得的四个纯净的CuS产品,按照上述操作方法将样品封存于四个玻璃管内,设置马弗炉的温度为300℃、 350℃、 400℃和450℃分别进行反应,加热时间仍为1.5h。待反应结束后取出玻璃管得到产物,后续对产品的处理操作同第(2)步。对得到的物质进行XRD表征,与标准卡片对比分析后,发现产品均为CuS,即在上述温度下,CuS并没有发生转化,而《无机化学》(高等教育出版社)(2015年)在附录中,给出CuS分解为Cu2S的温度是507℃[9],结合本实验,我们得到生成Cu2S的实验温度是500℃,因此我们认为CuS的分解温度在500℃左右。
3.3 实验结果讨论
通过对表格中的实验结果进行分析,可以看出:
(1) 即使在没有氧气存在的条件下,硫粉与铜粉共热仍有可能生成硫化铜,说明硫单质可以将单质铜氧化成二价铜。
(2) 温度和反应物的量比关系共同影响产物的生成: 低温时,反应产物受硫粉量的影响较大,硫粉少量时易生成Cu2S,过量时则易生成CuS;高温时,不论硫粉是少量还是过量,硫和铜反应都更倾向于生成Cu2S。
(3)
在本实验条件下,CuS的分解温度在500℃左右。
当然,硫和铜的反应产物受很多因素影响,除了本研究主要探讨的温度和量比关系外,可能还与药品是否混合均匀、使用铜丝还是铜粉等因素有关。由此可知,硫与铜反应因条件不同其产物也不尽相同。
本研究通过多次重复实验,凭借有力的实验证据证明并揭示了硫和铜反应的规律。回应并澄清了学生中存在的种种困惑,从实验的角度对网络资料和教科书进行了补充说明,帮助学生进一步构建化学反应受条件影响的学科观念,培养学生实验探究的兴趣和能力,引领学生深刻感受科学研究的过程与魅力。
参考文献:
[1]蒯世定. 铜与硫反应实验的改进[J]. 化学教育, 1999, (4): 37.
[2]杨育民. 铜和硫反应装置的改进[J]. 实验教学与仪器, 1994, (5): 18.
[3]盛锡铭. 铜与硫反应实验的探讨[J]. 化學教学, 1997, (12): 12~13.
[4]邓丽娟. 铜与硫反应的实验改进[J]. 湖北中小学实验室, 2001, (Z1): 54.
[5]熊言林. 铜跟硫反应封闭式实验的新设计[J]. 中国教育技术装备, 2002, (2): 8.
[6]王建芬, 齐俊林. 铜与硫反应实验的新设计[J]. 化学教学, 2017, (11): 56~58.
[7]路国梁, 宋福全, 王昭煜, 房青岚. 无水无氧实验技术[J]. 化学通报, 1993, (10): 48~53.
[8][9]宋天佑, 徐佳宁, 程功臻. 无机化学(下册)(第3版)[M]. 北京: 高等教育出版社, 2015: 882.

