B16全细胞肿瘤疫苗在C57BL/6小鼠中的免疫效果及肿瘤抑制作用
牟大超 吴沙沙 缪治永 周 轶
早在18世纪末,Edward Jenner就将牛痘疫苗接种于婴幼儿体内,以达到预防天花的目的,开创了疫苗免疫的新纪元[1]。当今,肿瘤的免疫治疗已成为继手术治疗、放化疗后,最具前景的治疗手段[2]。肿瘤免疫疗法包括单克隆抗体治疗、免疫检查点抑制剂治疗(PD-1、CTAL-4等)、嵌合抗原受体T细胞治疗(CAR-T)、肿瘤疫苗等,部分已在临床应用,也不乏药物上市[3-9]。相对来说,肿瘤疫苗的发展比较缓慢,较为成功的当属预防人乳头状瘤病毒(papillomavirus,HPV)感染的宫颈癌疫苗(HPV)[10]。肿瘤疫苗包括全细胞肿瘤疫苗、树突细胞疫苗、多肽疫苗、核酸疫苗等[11-14]。肿瘤疫苗的发展缓慢究其原因可能与肿瘤特异性抗原的发现较难有关,针对肿瘤相关抗原所制备的疫苗在免疫保护中效果不佳[15]。
黑色素瘤是一种恶性程度较高的肿瘤,主要表现为皮肤色素痣的形态和颜色改变,可发生骨转移、肺转移等[16]。B16细胞是小鼠恶性黑色素瘤细胞系,B16细胞肿瘤疫苗的研发在国外有相关报道,但其保护效果存在争议,国内相关研究报道较少[17-19]。本文采用灭活方式,加以弗氏佐剂,制备B16肿瘤细胞疫苗。采用三针免疫程序,对C57小鼠进行免疫。第3次免疫后28天,对小鼠进行B16活细胞攻击,从而观察其保护效果。在第3次免疫后检测抗体滴度,在接受B16活细胞攻击后取小鼠脾脏,分析淋巴细胞CD4+T和CD8+T 细胞,从而判断疫苗的免疫效果。
1 材料与方法
1.1 实验材料
1.1.1 细胞与动物 B16黑色素瘤细胞由四川大学华西医院生物治疗国家重点实验室杨寒朔教授惠赠,本室保种传代。C57BL/6小鼠,清洁级,6~8周,购自四川成都达硕实验动物有限公司[动物生产许可证号:SCXK(川)2015-03]。
1.1.2 主要试剂 细胞培养用DMEM高糖培养基和青霉素链霉素购自Gibco公司,胎牛血清购自阿根廷Natocor公司,弗氏完全佐剂和弗氏不完全佐剂购自德国Sigma公司,HRP标记山羊抗鼠IgG购自杭州华安生物技术有限公司,TMB单组分显色液购自北京索莱宝科技有限公司,CD3流式抗体、CD4流式抗体和CD8流式抗体均购自BD公司。
1.2 实验方法
1.2.1 B16细胞培养 小鼠黑色素瘤细胞B16于含有10% FBS,青霉素(100 U/ml)和链霉素(100 μg/ml)的DMEM高糖培养基中,37 ℃、5% CO2孵箱内培养。
1.2.2 B16肿瘤疫苗制备及小鼠免疫 收集对数生长期B16细胞,用生理盐水调整细胞密度为2×106/ml,在-80 ℃冰箱和37 ℃之间反复冻融5次制得抗原。24只小鼠平均分为3组,每组雌雄各半。A组:接种含弗氏佐剂的B16肿瘤疫苗(1∶1混合),B组:接种不含弗氏佐剂的B16肿瘤疫苗,C组:接种生理盐水对照。每只C57BL/6小鼠的双侧腓肠肌肌肉注射各0.25 ml。采用0、1、2月三针免疫程序,A组中第1次免疫疫苗用弗氏完全佐剂配制,第2次和第3次免疫用弗氏不完全佐剂配制。第3次免疫后第28天,于每只小鼠鼠尾采血,分离血清用于ELISA抗体检测。
1.2.3 ELISA法检测小鼠抗B16抗体 B16细胞抗原用BCA法测浓度,每孔3 μg抗原包被96孔板4 ℃过夜,洗涤后每孔加200 μl 3%BSA封闭液,37 ℃孵育1 h,洗涤后首孔加20倍稀释小鼠血清,2倍稀释度梯度稀释,共11个稀释孔,100 μl/孔,最后一孔作空白对照孔。37 ℃孵育1 h,洗涤后每孔加100 μl TMB,室温放置10 min。加2 M硫酸终止反应,酶标仪450 nm波长测吸光度值。OD值≥2.1倍空白孔则判定为阳性。
1.2.4 B16细胞攻击免疫小鼠 取对数生长的B16细胞,用生理盐水稀释成浓度为2.5×106/ml细胞悬液,每只免疫小鼠背部皮下接种细胞悬液100 μl,从第7天开始,用游标卡尺测量皮下肿瘤的长径和宽径,每隔两天测量1次,直到有小鼠因肿瘤生长而出现死亡。计算肿瘤体积=0.52×长径×宽径2。
1.2.5 荷瘤小鼠脾脏CD3,CD4和CD8流式分析 取B16细胞攻击的免疫小鼠,在最后1次测量肿瘤体积后脱颈处死,无菌取脾脏研磨,过70 μm筛网,裂解红细胞,分别在100 μl的FACS buffer中加CD3,CD4和CD8流式抗体染色,流式分析。
1.3 统计学分析
采用SPSS 21.0分析数据。小鼠肿瘤体积分析均采用单因素重复测量数据的方差分析;流式数据采用单因素方差分析。P<0.05判定为有统计学差异。
2 结果
2.1 免疫小鼠血清抗B16细胞抗原结果
取第3次免疫后小鼠尾静脉血分血清,每个样本血清稀释度分别为1/20,1/40,1/80,1/160,1/320,1/640,1/1280,1/2560,1/5120,1/102400和1/104800共11孔。阴性对照为免疫前各小鼠的尾静脉血20倍稀释血清。结果显示,A组小鼠在第3次免疫后抗体几何平均滴度(GMT)最高,达到1∶6891(P<0.05);B组抗体滴度居中;而C组生理盐水空白对照组抗体滴度最低。见图1。
2.2 免疫小鼠皮下接种B16细胞后肿瘤生长情况
3组小鼠在疫苗第3次免疫后接种B16肿瘤细胞,隔天测量小鼠肿瘤生长情况。结果显示,生理盐水对照组小鼠肿瘤生长较快,在攻击后第16天,肿瘤体积明显大于其余2组(P<0.05);含佐剂的B16疫苗小鼠肿瘤生长最慢,不含佐剂的B16肿瘤疫苗组居中。见图2。

图1 各组小鼠第3次免疫后抗体滴度GMT情况

图2 各组小鼠第3次免疫后接种B16肿瘤细胞后肿瘤生长情况
2.3 免疫小鼠皮下接种B16细胞后脾脏CD3/CD4/CD8流式分析
在各组小鼠接种肿瘤后16天,无菌取脾,制成单细胞悬液,流式抗体CD3、CD4、CD8染色分析细胞群落。结果显示,3组荷瘤小鼠,CD4+T 细胞和CD8+T细胞群比例没有统计学差异。但3组荷瘤小鼠比例CD4+T cell/CD8+T cell(0.78~0.87)与正常小鼠CD4+T cell/CD8+T cell(1.5~2)相比明显降低,3组荷瘤小鼠CD3+CD8+T cell比例上调。见图3。
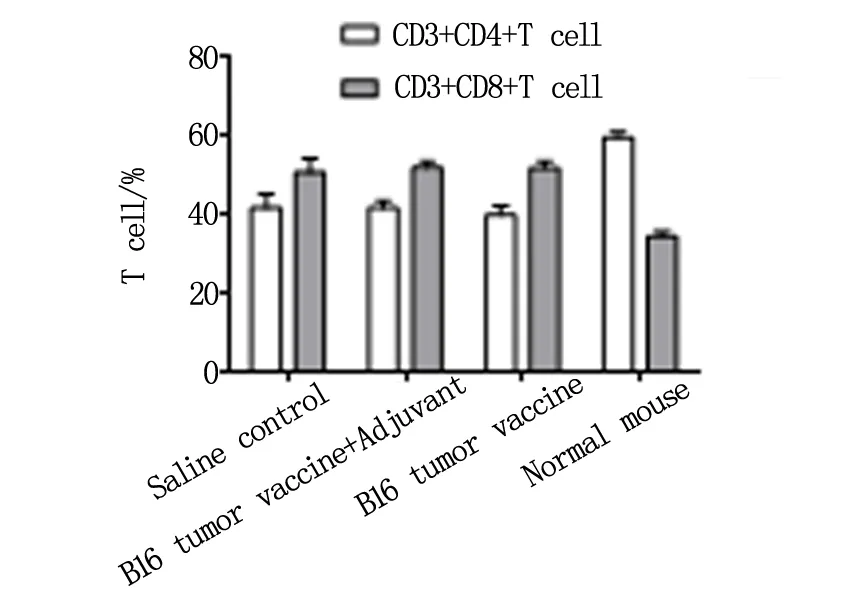
图3 各组小鼠脾脏免疫细胞群流式细胞术分析
3 讨论
肿瘤的免疫疗法至今已有多种,尤为突出的当属免疫检查点抑制剂治疗、嵌合抗原受体T细胞免疫治疗(CAR-T)、单克隆抗体治疗等,并且已有相应药物上市。相对来说,肿瘤细胞疫苗发展较为缓慢,这可能与肿瘤特异性抗原的寻找较难有关。常用作疫苗制备的肿瘤相关抗原,其本身来源于机体正常细胞,缺乏特异性和免疫原性。
本文利用小鼠黑色素瘤B16细胞,制备B16全细胞肿瘤疫苗,其具有抗原种类全的优势,加以弗氏佐剂,又增强其免疫原性。在国外的研究中,已有利用人黑色素瘤细胞株Mich-1和Mich-2制备全细胞肿瘤疫苗,以抑制肿瘤,延长生存率的研究报道[20]。该疫苗添加Hyper-IL-6作为分子佐剂,患者平均总生存期可达到17.3月,且未见严重不良事件,证实了全细胞疫苗的可行性。本文B16肿瘤疫苗与弗氏佐剂1∶1配比(首次免疫用弗氏完全佐剂,第2、3次免疫用弗氏不完全佐剂),能激活小鼠B淋巴细胞产生较高的抗体滴度,具有很好的免疫原性(图1)。3组小鼠中虽然CD4+T细胞和CD8+T细胞比例没有统计学差异,但3组小鼠CD3+CD8+T细胞数明显增加,证实小鼠体内T淋巴细胞也被激活(图3)。A组小鼠B淋巴细胞的大量激活,除产生抗体,引发机体抗体依赖细胞介导的细胞毒性效应(ADCC)外,还能递呈肿瘤抗原,供T细胞识别。两者共同作用有利于对肿瘤生长的抑制(图2)。
肿瘤疫苗的开发仍需大量工作,本文仅探讨使用了肿瘤全细胞开发疫苗,包含了肿瘤细胞的所有抗原种类。在后续的研究中,可对肿瘤疫苗进行优化,分离纯度更高、特异性更强的蛋白作为肿瘤抗原。同时为增强疫苗的免疫原性,可添加高效佐剂或在抗原蛋白上偶联趋化因子等。肿瘤疫苗联合其他治疗方法,对末期肿瘤患者的联合治疗方法也亟待开发。

