肿瘤浸润性淋巴细胞亚群的功能研究及其受体克隆
林晓为 谢云青 黄丽洁 陈雪芳 郑秋红
肿瘤浸润的淋巴细胞(tumor infiltrating lymphocytes,TIL)指的是从肿瘤组织中分离出的浸润性淋巴细胞,在90年代中期由NIH的Rosenberg 发现的,并显示了良好的临床效果[1],是国内外恶性肿瘤细胞免疫治疗的热点之一。寻找肿瘤特异的TIL细胞是提高TIL细胞临床有效率的关键,但是目前还没有特异的表面标志物。有研究显示,对肿瘤抗原起特异性免疫反应的T细胞克隆主要为CD8+效应性T细胞,且CD8+TIL细胞中PD-1+的细胞亚群比PD-1-的细胞亚群对肿瘤细胞的杀伤能力更强[2-3]。
Rosenberg 等利用外显子测序等手段得到可以识别新抗原的T 细胞的TCR序列后,将该TCR 导入到T 细胞中,大量克隆后进行抗肿瘤治疗,该方法可规避由于脱靶效应造成的毒副作用[4]。TCRα、β链基因的可变区(V) 各有3个互补决定区(complementarities determining region,CDR),只有CDR3直接和抗原相互作用。TIL细胞的CDR3区受肿瘤抗原的长期编辑,其基因可能蕴含着丰富的个体化特异性抗原信息,且由于肿瘤抗原激活后的T细胞可得到优势扩增,因此TIL细胞中CDR3区的多样性较正常人明显降低,使利用CDR3区的基因突变信息寻找肿瘤突变的新抗原成为可能。
因此,本研究利用CD8、PD-1抗体分选出肿瘤组织来源的CD8+PD-1+TIL及CD8+PD-1-TIL细胞亚群,在体外对其特异性肿瘤杀伤功能进行验证比较。同时,为了获取肿瘤特异性的TCR信息,本研究尝试建立体外PCR扩增体系,扩增CD8+PD-1+TIL细胞的TCR CDR3区基因,为后续的TIL细胞TCR CDR3区基因测序,寻找个体化肿瘤突变新抗原信息奠定前期研究基础。
1 材料与方法
1.1 肿瘤组织来源TIL细胞的分离培养与表型鉴定
抗人CD3单克隆抗体及GT-T551 H3培养基均购自北京宝日医生物技术有限公司,白介素-2(IL-2)购自北京四环制药有限公司,淋巴细胞分离液购自美国General Electric(GE)公司。0.25%胰酶和胶原蛋白酶、透明质酸酶及DNA酶购自Gibco公司。RPMI1640培养基购自厦门泰京公司。流式细胞仪(Beckman Coulter FC500)及流式检测所用CD3-PC5、CD4-PE、CD8-ECD、PD-1-FITC均购自Beckman公司。
参照[5]的培养方法,无菌条件下获取肺癌肿瘤组织,置于冰盒转运至细胞培养室;将肿瘤组织剪成约1 mm3的小碎块,加入胶原酶、透明质酸酶和DNA酶等消化,4 ℃过夜;室温1 500 r/min离心,5 min,收集细胞;采用淋巴细胞分离液分离单个核细胞(包括肿瘤细胞和淋巴细胞)。将单个核细胞按1×106个/ml重悬于GT-T551 H3培养液中37 ℃,5% CO2条件下过夜,次日,收集上清液,贴壁细胞加入含10%胎牛血清的RPMI1640中培养并扩增。离心收集上清中的细胞,重悬于GT-T551 H3培养液,加入CD3单克隆抗体(5 μg/ml)及IL-2(500 U/ml)诱导TIL细胞的活化和增殖。根据生长情况每 2~3 d 进行一次扩瓶传代培养;在37 ℃,5% CO2条件下培养细胞,当细胞不再呈指数级增长时,收集细胞进行表型鉴定。
大约培养至21 d左右,TIL细胞不再呈指数级增长,1 500 r/min离心5 min收集细胞,细胞沉淀用PBS洗涤3遍后,用PBS调节细胞浓度为2×106,加入鼠抗人CD3-PC5、CD4-PE、CD8-ECD、PD-1-FITC单抗,室温下孵育10 min后,加入1 ml PBS洗涤细胞,1 500 r/min离心5 min后,弃上清,细胞沉淀重悬于500 μl PBS中,上机检测。
1.2 TIL细胞的功能鉴定
流式检测所用CD8-ECD、IFN-γ-PC7、TNF-α-PC5抗体及细胞因子检测试剂盒均为Beckman公司。实时无标记细胞分析(RealTime Cellular Analysis,RTCA)仪及E-Plate检测板由艾森公司提供。
TIL细胞细胞因子分泌水平的检测。收集培养21 d的TIL细胞进行细胞因子分泌水平的检测。调节细胞浓度为2×106于新鲜培养基中,加入PMA(10 ng/ml)和Ionomycin(1 μM)刺激24 h,离心收集细胞,用100 μl PBS调节细胞浓度为2×106,加入10 μl CD8-PC5单抗于管中,孵育10 min后,加入1 ml PBS并离心收集细胞。细胞沉淀加固定剂,室温暗处孵育15 min,离心500 g 5 min,弃上清;再加破膜剂温暗处孵育10 min,加2~3 ml PBS洗液,离心500 g 5 min,弃上清;最后加入IFN-γ-FITC、IL-4-PE抗体,混匀,室温暗处孵育30 min,加入1 ml PBS 洗液,离心500 g 5 min,弃上清,再加入500 μl含1%PFA的溶液重悬细胞沉淀,上机检测。
TIL细胞亚群杀伤功能的检测。应用RTCA分析技术进行TIL细胞亚群杀伤效应的检测。向E-Plate检测板中加入RPMI1640培养基并测定背景阻抗值。收集1.2中贴壁生长的对数期原代肺癌肿瘤细胞并计数,调整细胞悬液浓度,向E-Plate检测板中加入一定体积的细胞,室温超净台内放置30 min。将加入细胞的E-Plate检测板放入检测台上,进行实时动态的细胞增殖检测。过夜检测后,向各培养孔中加入PBMC、未分选TIL细胞、CD8+PD-1-TIL细胞及CD8+PD-1+TIL细胞四种效应细胞进行共同培养,效靶比均为20∶1,并继续进行实时监测,共监测48h,获得实时的细胞效应曲线。
1.3 CD8+PD-1+TIL细胞表面TCR Vɑ1链CDR3基因的扩增
PCR仪为ABI美国应用生物公司,提取细胞总RNA的提取试剂盒、反转录试剂盒及PCR扩增试剂盒均购自美国Promega公司。引物设计:参照Arnold Han等[6],Oligo(dC) adaptor引物序列:5'-ACAGCAGGTCAGTCAAGCAGTAGCAGCAGTTCGATAAGCGGCCGCCATGGACCCCCCCCCCCC(AGT)(ACGT)-3′;Adaptor Primer1序列:5'-ACAGCAGGTCAGTCAAGCAGTA-3′;Adaptor Primer2序列:5′-AGCAGTAGCAGCAGTTCGATAA-3′;TCRVα1first PCR引物:5′-CTGCACGTACCAGACATCTGGGTT-3′;TCRVα1nest PCR引物:5′-CCAGGGTTTTCCCAGTCACGACAGGTCGTTTTTCTTCATTCCTTAGTC-3′。
CD8+PD-1+TIL细胞total RNA的提取及cDNA的合成。参照细胞总RNA的提取试剂盒及反转录试剂盒说明书进行CD8+PD-1+TIL细胞total RNA的提取及cDNA第一链的合成,应用Oligo(dC) adaptor引物进行cDNA第二链的合成。TCRVα1CDR3基因的巢式RT-PCR扩增。第一轮PCR:以以上合成的双链cDNA为模板,加入Adaptor Primer1引物及TCRVα1first PCR引物进行第一轮PCR扩增,PCR反应条件为:95 ℃ 5 min;95 ℃ 30 s,60 ℃ 15s,72 ℃ 2 min,共30个循环。巢式PCR:以以上第一轮PCR扩增的产物为模板,加入Adaptor Primer2引物及TCRVα1nest PCR引物进行巢式PCR扩增,同时扩增GAPDH编码基因做为质控对照。PCR反应条件为:95 ℃ 5 min;95 ℃ 15 s,60 ℃ 15 s,72 ℃ 1 min,共35个循环后,72 ℃ 2 min。
2 结果
2.1 肺癌组织分离培养的TIL细胞的表型鉴定
如图1~3所示,从肺癌肿瘤组织中分离培养的TIL细胞,CD3+CD8+(CTL)细胞亚群占75.7%(图1),CD3+CD4+(Th)细胞亚群占23.1%(图2),其中PD-1的表达约为29.7%(图3)。说明肿瘤组织中浸润性T淋巴细胞多以CD3+CD8+细胞毒T细胞(CTL)为主要细胞群,但由于其表面高表达PD-1负性调控分子而致其失去杀伤肿瘤的能力。
2.2 CD8+PD-1+TIL细胞表面TCR CDR3区基因的扩增
琼脂糖凝胶电泳结果如图4所示,经过巢式PCR扩增,CD8+PD-1+TIL细胞扩增出TCR Vα1条带,约686 bp左右,参照物GAPDH亦显示出条带,约158 bp左右。
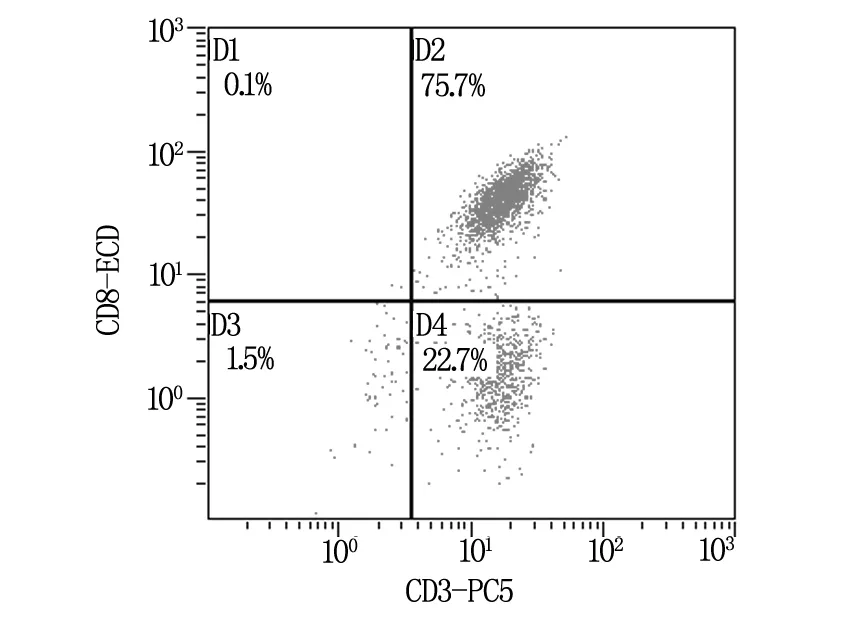
图1 TIL细胞中CD3+CD8+细胞分布情况
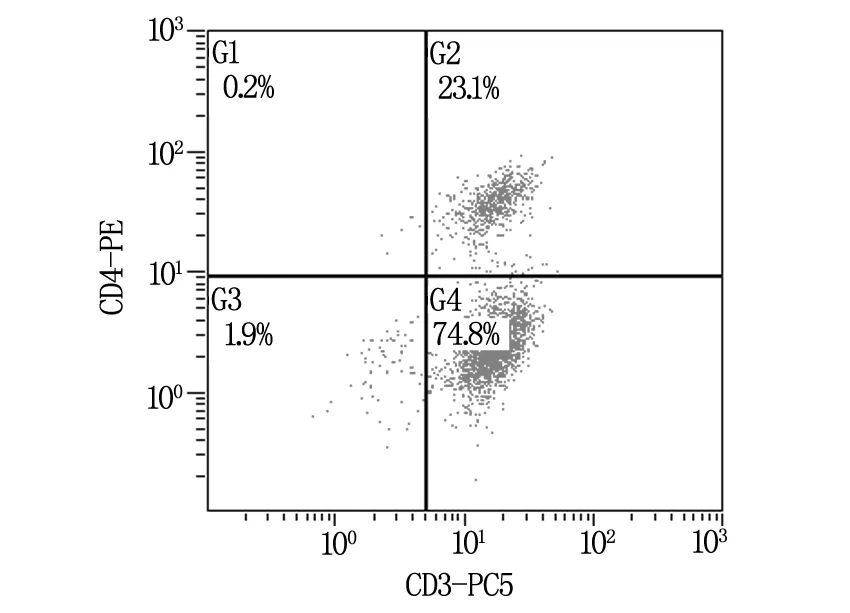
图2 TIL细胞中CD3+CD4+细胞分布情况
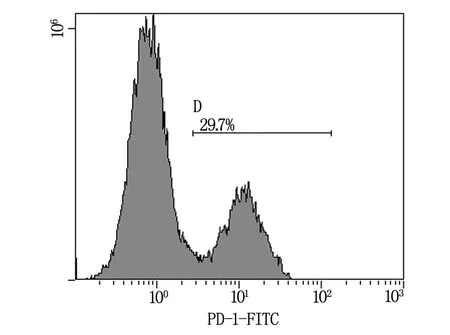
图3 TIL细胞中PD-1表达情况分析

注:1为100bp DNA marker;2为空白对照;3为Jurkat T淋巴瘤细胞阳性对照;4为GAPDH质控对照;5为CD8+PD-1+TIL细胞。
3 讨论
TIL细胞是存在于肿瘤间质内的以淋巴细胞为主的异质性淋巴细胞群体,大多聚集在肿瘤周围或其间质呈套状围绕癌巢。自1986年Rosenberg等从荷瘤小鼠实体瘤中分离到TIL,并于2002年报道了首例TIL细胞应用与黑色素瘤患者的临床治疗效果后[1],TIL细胞的临床应用越来越广泛。随着研究的深入,人们发现,TIL细胞中对肿瘤抗原起特异性免疫反应的T细胞克隆主要为CD8+效应性T细胞[3],而这群CD8+TIL细胞在肿瘤中由于受到抗原持久的刺激,不能有效分化成记忆性T细胞而逐步演变成功能紊乱的一群细胞[6],称之为衰竭性CD8+CTL细胞,这群细胞表面持续性高表达PD1抑制性受体,其机制可能与肿瘤微环境中长期高表达PD-L1相关[7]。我们的研究结果亦发现,从肺癌肿瘤组织中分离培养的TIL细胞主要以CD8+T细胞群为主,约占75.7%,而这群CD8+T细胞PD-1表达率高达29.7%,通过体外杀伤原代培养的肺癌肿瘤细胞能力检测,发现这群CD8+PD-1+TIL细胞在体外特异性杀伤活性最强,高于CD8+PD-1-TIL细胞,该结果与Rosenberg等[2]及Ye等[8]的研究结果相符,本研究的实验结果还显示未分群的TIL细胞的肿瘤杀伤功能超越了CD8+PD-1-TIL,以上这些实验结果尚需要进一步的验证及机制研究。
T细胞特异性识别肿瘤抗原的分子基础是其表面TCR受体。近年来,鉴定出功能性T细胞克隆,进而克隆其异二聚体TCR片段,并将其表达于T细胞表面赋予T细胞识别杀伤肿瘤的能力已成为研究热点。TCR修饰T 细胞(TCR-T)治疗肿瘤患者的于2006首次成功应用于黑色素瘤患者[9],之后针对CEA、 NY-ESO-1等肿瘤特异性抗原的TCR-T细胞治疗被应用于治疗多种肿瘤(多发性骨髓瘤、黑色素瘤、乳腺癌、卵巢癌、前列腺癌等),获得了19%~56% 的临床反应率[10-11]。2015 年,有报道将TIL细胞中分离出肿瘤特异性TCR克隆应用于一位胆管癌肝肺转移的患者使其完全缓解[12]。TCRα、β链可变V区基因千变万化,但是V区CDR3才是直接与肿瘤抗原接触的区域,CDR3基因可能蕴含着丰富的个体化特异性抗原信息,且优势扩增的原理导致肿瘤抗原特异性TIL细胞亚群中CDR3区的多样性较正常人明显降低,使得通过对CD8+PD-1+TIL细胞亚群CDR3基因测序,寻找差异表达基因,从中获取个体化肿瘤突变新抗原信息成为可能。但是,由于α/βTCR有32个Vα亚家族基因及26个Vβ亚家族基因,同时扩增难度较大,因此本研究先设计了Vα1亚家族的引物,利用巢式RT-PCR的方法先摸索TCR Vα1基因体外扩增的条件,为后续TCR Vα及Vβ全部亚家族CDR3基因的扩增建立稳定的实验条件,为通过对TIL细胞中CDR3基因测序寻找肿瘤特异性突变抗原,实现个体化精准细胞免疫治疗奠定了前期研究基础。

