烟曲霉Bem46基因荧光定位菌株构建及对极性生长相关基因影响作用初探
马 彦,曹 雪,李 雯,李雪静,冀 英,杨 静,岑 雯,冯文莉
由机会致病真菌烟曲霉引起的侵袭性曲霉病(IA)是免疫功能低下患者感染性死亡的主要原因之一[1]。免疫调节治疗联合抗真菌治疗目前被认为能最有效地改善疾病[2-4]。烟曲霉与宿主的相互作用是动态的、复杂的。宿主免疫系统需识别烟曲霉的不同形态以控制真菌生长,防止组织入侵。烟曲霉的生命周期及其细胞壁随形态变化而变化,这在烟曲霉致病中极其重要[5]。生长发芽是菌株在体内致病的重要环节[6]。出芽蛋白BEM46属于α/β水解酶超家族成员,在进化上相对保守。粗糙脉孢霉(Neurosporacrassa)中BEM46为菌丝特异性生长所必需,它通过一系列信号传导来决定或维持细胞的极性生长[7]。目前出芽蛋白BEM46在烟曲霉极性生长中的作用尚不明确。本研究旨在初步对编码出芽蛋白BEM46的基因在烟曲霉极性生长中定位及相关基因表达情况进行探索。
1 材料与方法
1.1菌株来源 烟曲霉Bem46基因缺陷株(ΔBem46)为本实验室前期构建,具体构建方法见文献[8]。荧光标记eGFP来自质粒为pUCGH,该质粒含有潮霉素抗性基因,可用于筛选含有荧光标记成功的转化子。转化和对照用菌株Ku80和质粒均由美国Duke大学分子遗传学实验室William J. Steinbach教授赠送。
1.2 培养基及试剂
1.2.1培养基 原生质体转化常用培养基参考文献[8]。
1.2.2试剂和仪器 溶壁酶:Vinoflow FCE 购自Novozymes公司;Gene JET Gel Extraction Kit、 Gene JET Plasmid Miniprep Kit、Fast DigestKpnI、 Fast DigestBamHI、Fast DigestSbfI和Fast DigestHindIII均购自Thermo Fisher Scientific公司,T4DNA Ligase购自TaKaRa,潮霉素B购自Sigma公司。DH5α细胞购自生工。激光共聚焦显微镜的型号FV1 000,日本奥林巴斯公司。
1.3DH5α感受态细胞的制备 -80 ℃保存的DH5α感受态细胞菌悬液冰上融化后接种于LB固体培养基,37 ℃过夜培养;取单菌落接种于5 mL LB液体培养基,37 ℃、220 r/min过夜震荡培养,在100 mL LB液体培养基中加入2 mL新培养的菌悬液,振荡培养至OD值达0.55后置于冰上;然后5 000 r/min,4 ℃离心10 min;弃去上清,用预冷的氯化镁溶液轻柔重悬细胞,于冰上5 min,再次4 000 r/min低温离心10 min,弃上清,用预冷的氯化钙溶液重悬细胞,冰浴20 min后再次4 000 r/min低温离心10 min,弃上清,用20 mL氯化钙-甘油溶液重悬细胞,-80 ℃分装保存。
1.4 构建烟曲霉Bem46基因荧光定位株
1.4.1Bem46基因扩增 利用烟曲霉基因组(www.aspergillusgenome.org) 找出同N.crassa中Bem46基因同源的基因及该基因下游约1 000 bp大小的序列。
1.4.2荧光定位菌株转化质粒的构建 克隆烟曲霉Bem46基因的ORF(不含终止密码子)后,利用限制性内切酶KpnI和BamHI,将该基因全序列克隆连接入pUCGH质粒,得到pUCGH-Bem46质粒。扩增Bem46基因下游约1 000 bp长度的侧翼序列,利用限制性内切酶SbfI和HindIII将片段连接入pUCGH-Bem46质粒得到pUCGH-Bem46-term。构建使用及验证引物见表1。用KpnI和HindIII酶切质粒pUCGH-Bem46-term,酶切片段4 ℃保存做原生质体转化用。

表1 构建烟曲霉Bem46荧光定位转化质粒载体及验证用引物
1.4.3烟曲霉原生质体转化法构建Bem46基因荧光定位株 在200 mL GMM+YE液体培养基中加入2 mLKu80孢子菌悬液,37 ℃ 250 r/min振荡过夜。于50 mL离心管中将3 g Vinoflow放入 40 mL Osmotic Media中振荡混匀。28 ℃ 75 r/min,摇床4 h,间断轻柔吹打混匀。沿管壁缓慢加入10 mL Trapping Buffer, 4 ℃ 3 500 r/min,离心10 min。轻柔将原生质吸取至15 mL离心管,置于冰上。然后加入12 mL STC,轻柔颠倒混匀,3 500 r/min低温离心8 min后放于冰上。弃上清,加入1 mL STC,轻吹上层白色沉淀,转移至15 mL离心管中,再次加STC离心,弃上清。加1 mL STC,轻柔吹打混匀,显微镜下观察原生质体状况,备用。取15 mL离心管将5 μg酶切片段产物及200 μL原生质体混合,置于冰上1 h。在离心管中将1.25 mL PEG-CaCl2,酶切片段-原生质体混合物轻柔混匀,室温下放置 20 min,将4 mL STC加入,轻轻上下混匀。在SMM平皿上平铺200 μL混合物,过夜后其上加盖含潮霉素的SMM培养基,37 ℃孵箱培养3 d,观察平皿上菌落生长状况。具体操作方法见文献[9]。
1.5激光共聚焦显微镜观察绿色荧光在烟曲霉不同形态中的分布 将烟曲霉Bem46荧光定位株孢子悬液定量,在10 mL GMM液体培养基中加入10 μL 1×106个/mL 孢子悬液,轻柔混匀,倒入灭菌培养皿;75%酒精冲洗盖玻片后过火,将盖玻片放入培养皿,尽量避免产生气泡;于37 ℃避光培养;分别于培养5 h、6 h和16 h 3个时间点取出盖玻片置于载玻片上,共聚焦显微镜观察。
1.6实时荧光定量PCR检测极性生长相关基因Bem1、Bud5表达量 烟曲霉基因组(www.aspergillusgenome.org) 中查找极性生长相关基因Bem1和Bud5基因序列,设计引物(见表2)。

表2 实时荧光定量PCR扩增极性生长相关基因Bem1、Bud5和内参基因所用引物
提取对照菌株Ku80及烟曲霉ΔBem46总RNA,将其反转录成cDNA(按试剂盒说明进行 操作)。反应 体系10 μL如下:5×PrimeScript RT Master Mix 2 μL,RNA 1 μL,RNase-free水 7 μL。荧光定量PCR反应条件如下:37 ℃ 15 min,85 ℃ 5 s,10 ℃保温。将产物浓度定量并储存于4 ℃。
RT-PCR检测烟曲霉ΔBem46中极性生长相关基因Bem1、Bud5的表达水平。内参基因为β-tubulin。研究中所用引物列于表2。反应体系如下:cDNA 2 μL, SYBR Premix Ex TaqII 10 μL,上下游引物分别0.8 μL,双蒸水 6.4 μL, 共20 μL。反应条件:预变性 95 ℃ 30 s;PCR 95 ℃ 5 s,60 ℃ 30 s,共40个循环;熔解 95 ℃ 5 s,60 ℃ 1 min,95 ℃ 1 s;降温 50 ℃ 30 s。实验重复6次。
1.7统计分析 计算基因表达量:将Cq值等数据从LightCycler96 PCR仪导出,Ku80作为对照菌株,计算2-ΔΔCq,其中ΔΔCq=(Cq目的基因-Cq内参基因)实验组-(Cq目的基因-Cq内参基因)对照组,得出Bem1和Bud5基因在ΔBem46基因缺陷株相对于Ku80表达的变化倍数。重复该实验6次。采用SPSS22.0统计软件进行统计分析,运用两独立样本t检验,P<0.05为差异有统计学意义。
2 结 果
2.1烟曲霉Bem46基因荧光定位菌株构建模式图
见图1,在烟曲霉基因组中通过序列比对找到Bem46基因,Afu7g04660,1 116 bp个碱基编码311个氨基酸。将该基因全序列克隆入质粒pUCGH。图1中将烟曲霉Bem46全基因插入到质粒pUCGH荧光标记eGFP上游,将烟曲霉Bem46基因下游约1 000 bp序列连接入筛选标记潮霉素下游。

图1 利用含有荧光定位标记eGFP的质粒pUCGH构建荧光定位株载体示意图
2.2 烟曲霉Bem46基因荧光定位菌株验证
2.2.1荧光定位菌株构建载体Bem46基因测序验证结果 将Bem46基因正确成功连接入质粒pUCGH后进行Bem46基因测序,确保正确的基因序列被克隆。由图2可见测序结果为整齐单一序列峰,且同烟曲霉基因组中Bem46基因序列比对完全符合。

图2 构建荧光定位菌株载体中Bem46基因测序结果(部分)
2.2.2荧光定位菌株转化子PCR验证结果 根据Bem46基因序列设计了3组引物来验证定位菌株构建是否成功,结果见图3。具体引物配对以及扩增相应片段大小见表3。

表3 烟曲霉Bem46基因荧光定位菌株验证使用引物及相应片段大小

菌株1,2,3,4,5,6均是转化子,Ku80为对照菌株
由表3可见引物I中烟曲霉Bem46定位菌株转化子扩增条带约1.2 kb,而对照菌株无条带出现,在图3 I中转化子1、2、3、4、5、6有正确大小的条带,说明有筛选标记eGFP同目的基因Bem46相连接。引物II荧光定位菌株应有扩增条带约1.0 kb,而对照菌株没有,在图3 II中可见到转化子1、2、3、4、5、6有筛选标记潮霉素同目的基因Bem46下游1.0 kb序列相连接。引物III扩增整个基因、连接入的质粒及下游1.0 kb序列,在对照菌株无质粒的连接,条带为2.3 kb,而在转化子由于有质粒连接进入故条带明显增大,为7.2 kb,图3 III中说明转化子1、2、3、4、5、6均为正确的转化子,有质粒成功连接进入。 通过I、II和III对引物验证表明转化子1、2、3、4、5、6均为构建成功的荧光定位菌株,可用来进行下一步实验。
2.3激光共聚焦显微镜观察荧光分布结果 观察发现在烟曲霉处于孢子状态时,绿色荧光弥漫分布于孢子内,见图4A。在孢子发芽出现芽管时,可见到绿色荧光在孢子壁一侧,靠近发芽部位,且可随着芽管的出现荧光沿芽管向前延伸见图4B。在菌丝状态时,可见绿色荧光呈弥散分布见图4C所示1处,但可见到在菌丝即将膨大出芽形成新分支处,荧光有聚集现象,如图4C所示2和3处。

A 孢子状态下Bem46基因定位菌株荧光分布情况

B 处于孢子发芽成芽管状态时Bem46基因荧光分布情况

C 处于菌丝状态时Bem46基因荧光定位情况(1:菌丝,2,3:分支膨大处)注:图片左侧均为光镜背景,右侧为荧光背景,左右两侧为同一视野。
2.4RT-PCR法检测 对照株Ku80及ΔBem46中极性生长相关基因Bem1和Bud5的表达,由图5A可见Bem1基因在烟曲霉ΔBem46中的表达量为0.67±0.052,差异有统计学意义(t=15.430,P<0.001),说明由于Bem46基因的缺失,Bem1基因表达量下降为正常时的0.67倍。由图5B可见Bud5基因在烟曲霉ΔBem46中的表达量为0.881±0.07,差异有统计学意义(t=4.168,P<0.05)。说明由于Bem46基因的缺失,Bud5基因表达量下降为正常时的0.881倍。
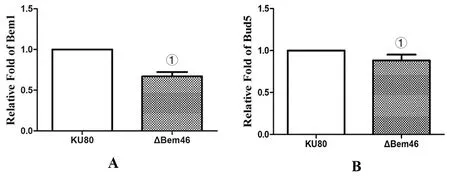
A为Bem1基因,B为Bud5基因;①为P<0.05
3 讨 论
近年来虽然在侵袭性曲霉病的诊断技术和抗真菌药物的研发上取得了一定的进步,然而侵袭性曲霉病的发病率和致死率仍然比较高,烟曲霉是侵袭性曲霉病最常见的致病菌[10],为开发治疗曲霉菌相关疾病的新方法,因而对最常见的烟曲霉生理生化性质及其同烟曲霉的致病性的研究更有必要[11]。丝状真菌的感染周期包括2个主要阶段:入侵(生长)和扩散(发展)。孢子在宿主身上沉积后,营养体的萌发、极性伸展和分枝是造成菌丝快速有效入侵的前提[12]。
目前对于Bem46基因的研究主要集中在模式生物。在疟原虫该基因主要定位于子孢子中独特的细胞内结构,在裂殖过程中,形成较少的裂殖子,降低子孢子的感染力[13]。Kempken团队在模式丝状真菌N.crassa的研究表明Bem46基因在细胞型特异性菌丝的形成中扮演重要角色,这表明该基因在维持细胞极性中有一定作用,该基因缺陷株显示子囊孢子萌发成菌丝表现出极性的缺失[7]。他们还发现Bem46基因定位于核周内质网,并在靠近质膜处形成斑点,可利用Bem46基因的保守区域进行真菌菌属的鉴定[14]。并且N.crassa中Bem46基因的过度表达可影响吲哚生物合成基因的调控,它能与中性氨基酸转运体MTR共域化[15]。致病真菌烟曲霉基因组同N.crassa基因组同源性较高,我们推测烟曲霉中N.crassa的Bem46同源基因可能有类似作用,这对于我们深入了解其致病有重要意义。前期我们构建了烟曲霉Bem46基因的缺陷株,通过研究发现ΔBem46发芽速度较对照菌株滞后,我们推测该基因可能和烟曲霉的发芽有关[8]。在此研究基础上,我们利用含有荧光报告基因eGFP的pUCGH质粒,构建了烟曲霉Bem46基因定位菌株。通过激光共聚焦显微镜观察,我们发现当烟曲霉处于孢子状态时,荧光的分布是弥散的,没有明确的定位点。但是随着烟曲霉孢子的生长发育,当其开始发芽时,我们注意到荧光向孢子一侧细胞壁聚集,并且随着芽管的出现,荧光定位从侧壁处突出,沿芽管方向延伸逐渐形成菌丝,而后弥漫扩散在整个菌丝中,并没有定位在细胞壁或者分隔等特殊部位。但是随着菌丝的增多、分支,在侧壁新的分支形成处可见局部膨大部位荧光聚集。在烟曲霉整个孢子形成菌丝过程中我们可看到荧光随极性生长点位置的变动,从而推断该基因可能同烟曲霉极性生长相关。有研究表明在裂殖酵母中Bem46被认为是酵母菌Bem1和Bud5双突变体的温度敏感抑制基因,而Bud5是酵母出芽所必须的基因,它同芽管形成基因Bem1相互作用[14]。在构巢曲霉中BemA基因缺失导致菌丝顶端形态异常,分生孢子囊泡产生后发育停滞,定位研究表明,BemA在菌丝顶端形成了一个清晰的帽状结构,类似于酿酒酵母极性体[16]。由上可见Bem1和Bud5两基因同极性生长密切相关,鉴于荧光定位显示烟曲霉中Bem46基因同极性生长有关,我们推测该Bem46基因可能影响极性生长相关基因Bem1和Bud5的表达情况。据此,我们通过实时定量PCR观察了烟曲霉Bem46基因敲除后对此两基因表达的影响。我们的研究发现烟曲霉Bem46基因敲除株中,Bem1和Bud5两种基因表达量均有下调。因而我们认为Bem46基因在烟曲霉中可以影响Bem1及Bud5基因的表达,但具体的作用机制尚不清楚,可能Bem46基因通过参与Bem1及Bud5所在的极性生长传导通路从而影响了该两基因。
总之,我们通过构建烟曲霉Bem46基因荧光定位株,初步了解了该基因在烟曲霉极性生长中定位情况,发现其可能同烟曲霉的极性生长相关,并对极性生长相关基因Bem1及Bud5的表达有影响,该结果提示进一步深入研究Bem46基因以何种方式参与极性生长相关信号传导通路,完成对极性生长相关基因的调控。
利益冲突:无

