小鼠腹腔巨噬细胞亚群对病毒拟似物Poly I∶C的免疫应答效应比较
杨 骁,陈 冲
(1.西安交通大学第二附属医院科研中心实验室,西安 710004; 2.天津医科大学肿瘤医院检验科,天津 300060)
巨噬细胞是免疫系统中的重要组分,对机体稳态维持、病原清除起着至关重要的作用。巨噬细胞具有较强的可塑性,按其功能表型、驻留器官、来源发育等,可分为不同的细胞亚群。根据其释放促炎/抑炎细胞因子或趋化因子的功能行为,可分为经典活化(classically activated)的M1型巨噬细胞亚群和选择性活化(alternatively activated)的M2型巨噬细胞亚群[1-3]。根据其各类驻留器官划分,可分为库佛细胞(肝组织)、朗格汉斯细胞(皮肤组织)、肺泡巨噬细胞(肺组织)、破骨细胞(骨组织)、小胶质细胞(脑组织)等巨噬细胞亚群[4-5]。根据来源,可将其分为胎肝造血干细胞来源、胚胎造血干细胞来源和成体骨髓造血干细胞来源的巨噬细胞亚群[6]。有研究报道表明,腹腔巨噬细胞具有一定的溯源异质性,其F4/80hi巨噬细胞亚群来源于肝造血干细胞,在稳态环境下依赖于自我增殖维持细胞群体数量的恒定;F4/80lo巨噬细胞亚群由骨髓造血干细胞来源的单核细胞发育而来,在机体遭受细菌感染或病毒侵扰的24~72 h,被大量募集并向F4/80hi巨噬细胞亚群定向分化[7]。然而在病毒侵染早期,腹腔巨噬细胞F4/80hi亚群和F4/80lo亚群是否具有免疫应答功能的异质性,仍未获曾阐明。
聚肌胞(Poly I∶C)是一种天然双链RNA(ds RNA)的类似物,能够有效模拟病毒感染后所形成的ds RNA,刺激机体产生抗病毒免疫反应和炎症反应[8]。已有报道表明,Poly I∶C可与成熟巨噬细胞表面Toll受体3(TLR3)受体结合,通过活化下游髓样分化因子88(MyD88)蛋白或β干扰素TLR结构域衔接蛋白(TRIF)两种方式,诱导Ι型干扰素(IFN)产生,进而触发炎性反应[9]。然而,目前对于异质性巨噬细胞抗病毒功能与机制的研究仍较少。因此,进一步深入研究巨噬细胞亚群感染早期病毒免疫应答作用与机制,对理解机体免疫系统早期病毒识别与应答调控具有重要意义。本实验通过研究Poly I∶C免疫刺激对小鼠腹腔F4/80hi和F4/80lo巨噬细胞亚群各类促炎因子和转录因子基因表达水平的影响,并进一步探究信号通路相关机制,以期为病毒感染的免疫应答调控研究提供理论依据和新思路。
1 材料和方法
1.1 实验动物
SPF级C67BL/6J雄性小鼠,6~8周龄,20只,体重20~22 g,购于北京维通利华实验动物技术有限公司[SCXK(京) 2016-0006],于西安交通大学医学部动物实验中心[SYXK (陕) 2015-0002]SPF级环境繁育饲养。温度20℃~25℃,相对湿度40%~70%,每天12 h昼夜明暗交替。本研究所有动物实验依据优化、减少、替代的3R原则进行实验设计,并经过西安交通大学动物实验伦理委员会批准(XJTULAC2018-2225)。
1.2 主要试剂与仪器
小鼠CD11b、F4/80流式抗体(1∶200,Biolegend,美国);RPMI-1640培养基、胎牛血清(Gibco,美国);Poly I∶C(Sigma,美国);RNA提取试剂TRIzol(Invitrogen,美国);cDNA合成试剂盒(Thermo,美国);SYBR Green荧光定量盒(TaKaRa,日本);BCA蛋白浓度定量试剂盒(Thermo,美国);JNK抗体(1∶500,CST,美国);P-JNK抗体(1∶500,CST,美国);GAPDH抗体(1∶500,CST,美国);羊抗兔HRP二抗(1∶3000,北京中杉金桥生物技术有限公司);JNK磷酸化抑制剂SP600125(MedChemExpress,美国);引物序列合成(北京六合华大基因科技股份有限公司)。
1.3 实验方法
1.3.1 流式分析和分选小鼠腹腔巨噬细胞
选取6~8周龄C67BL/6J小鼠,脱颈处死,使用预冷的PBS缓冲液反复冲洗腹腔,离心后重悬,置于冰上裂解红细胞10 min。离心后重悬行细胞计数,取5×106细胞,同时加入5 μL的CD11b-PE-Cy7和F4/80-APC抗体,避光冰上孵育30 min后,离心去上清。将细胞加入1 mL流式缓冲液重悬,过200目无菌滤网后上机进行流式细胞分选和分析,所使用流式细胞仪为ARIA ΙΙ(BD,美国),具体步骤参见文献[10]。共分选20只小鼠腹腔巨噬细胞,获得的小鼠CD11b+F4/80hi巨噬细胞亚群和CD11b+F4/80lo巨噬细胞亚群,一部分(8只小鼠样本)用于荧光定量PCR检测促炎因子和转录因子mRNA表达的检测,一部分(6只小鼠样本)用于JNK通路拮抗实验,另一部分(6只小鼠样本)用于Western blot检测信号通路磷酸化水平的检测,所有实验均至少开展三次独立重复实验。
1.3.2 Poly I∶C免疫刺激和JNK信号通路拮抗实验
将Poly I∶C干粉溶于PBS中,调整为终浓度2 mg/mL的储液,冻存于-80℃冰箱备用。本实验共设计两个Poly I∶C浓度组,分别为对照组(0 μg/mL),实验组(50 μg/mL),将作用后的F4/80hi亚群和F4/80lo亚群置于5% CO2浓度和37℃温度下培养8 h。将JNK通路磷酸化抑制剂SP600125干粉溶于DMSO中,调整为终浓度10 mmol/L的储液,低温冻存备用。在实验组加入Poly I∶C刺激的同时,设置加入SP600125(10 μmol/L)处理组和同体积DMSO对照组(每组3个样本,每个样本为分选的6只小鼠细胞两两合并),同上述条件培养8 h。
1.3.3 实时荧光定量PCR检测
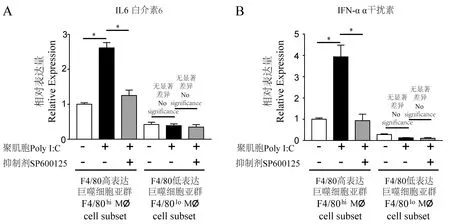
收集处理后的巨噬细胞亚群提取总RNA,采用Nanodrop微量分光光度计(Thermo,美国)测定提取RNA含量与质量(1.8 1.3.4 Western blot 提取处理后的巨噬细胞亚群蛋白,BCA定量法测定蛋白浓度,聚丙烯酰胺凝胶电泳后,半干转法电转至PVDF膜,10%BSA封闭液室温封闭1 h,加入比例稀释后的JNK、p-JNK、GAPDH抗体工作液,置于往复式摇床4℃孵育过夜,二抗室温孵育1 h。电化学发光显影,用Image J软件测定条带的灰度值,以磷酸化JNK灰度值与JNK总蛋白灰度值的比值作为蛋白的相对表达量。共收集6只小鼠腹腔巨噬细胞样本,由于CD11b+F4/80lo亚群占总细胞比例较低,为保证其细胞量不低于5×105,将收集的样本两两合并,分别进行了3次独立重复实验。在结果部分对其中一次代表性实验结果进行阐述。 表1 实时荧光定量PCR引物信息Table 1 Primers for qRT-PCR detection 经PBS缓冲液灌注冲洗,收集小鼠腹腔细胞。随后行CD11b-PE-Cy7和F4/80-APC抗体染色标记,通过流式分选,获得F4/80hi亚群和F4/80lo亚群细胞。其中CD11b+细胞占总细胞比例为(56.23±3.71)%;CD11b+F4/80hi巨噬细胞亚群占总细胞比例为(43.67±4.20)%,占CD11b+细胞比例为(77.23±3.16)%;CD11b+F4/80lo巨噬细胞亚群分别为(9.58±0.48)%和(17.23±1.39)%。F4/80hi亚群和F4/80lo亚群数量比较,P<0.05,具体结果见图1。 表2 Poly I∶C免疫刺激8 h后巨噬细胞促炎因子和相关转录因子基因的相对表达量Table 2 Relative expression value of pro-inflammatory factors and related transcription factor in macrophages with/without 8 h of Poly I∶C stimulation 利用上述引物(见表1),对Poly I∶C作用后巨噬细胞促炎因子IL6、iNOS、IFNα、IFNγ和信号通路相关转录因子IRF3、IRF7信使RNA的表达水平,进行荧光定量PCR检测。加入无Poly I∶C普通培养基的F4/80hi亚群设置为对照组(RQ=1),统计两个亚群巨噬细胞在Poly I∶C刺激前、后促炎因子和转录因子相对表达量(表2),并计算两个亚群巨噬细胞在Poly I∶C刺激后促炎因子和信号通路相关转录因子表达倍数的变化,具体结果见表3。 巨噬细胞经典M1型极化指标IL6和iNOS,相较于对照组,F4/80hi亚群IL6、iNOS表达增高(2.61±0.32)倍和(2.05±0.36)倍,F4/80lo亚群为(1.32±0.10)倍和(1.02±0.12)倍;同时F4/80hi亚群对Poly I∶C刺激的效应因子IFNα、IFNγ表达增加(3.90±0.54)倍和(2.29±0.29)倍,F4/80lo亚群为(1.37±0.10)倍和(1.22±0.10)倍。在病毒感染过程中,巨噬细胞通过胞膜模式受体识别病原,经胞内信号转导上调核内IRF3和IRF7转录,从而激活干扰素刺激反应原件(interferon stimulated response element, IRSE)的活性以发挥抗病毒和病原清除效应[11]。相较于对照组,F4/80hi亚群表达IRF3、IRF7表达增高(2.66±0.15)倍和(3.01±0.17)倍,F4/80lo亚群为(1.21±0.11)倍和(1.16±0.07)倍。综上,F4/80lo亚群相关因子增高倍数均未能大于1.4倍,提示该亚群对Poly I∶C刺激不敏感;而F4/80hi亚群相关炎性因子和转录因子指标增高倍数均显著高于F4/80lo亚群,P<0.05。 注:A:流式细胞术分选F4/80hi亚群和F4/80lo亚群划门策略;B:目的细胞占总细胞数百分比(左)或占CD11b+细胞数百分比(右)。F4/80高表达亚群与F4/80低表达亚群比较,*P<0.05。图1 F4/80hi亚群和F4/80lo亚群巨噬细胞相对数量Note. A, Gating Strategy for sorting F4/80hi subsetand F4/80losubset by Flow cytometre. B, Percentage of target cells in total cells (left panel) or in CD11b+ cells (right panel).F4/80hi subset Compared with F4/80lo subset,*P<0.05.Figure 1 The percentage of F4/80hi subset and F4/80losubset in total cells or CD11b+ cells 表3 Poly I∶C免疫刺激8 h后巨噬细胞促炎因子和相关转录因子基因表达倍数的变化Table 3 Fold changes of pro-inflammatory factors and related transcription factor in macrophages after 8 h of Poly I∶C stimulation 注:A:Western blot检测JNK信号通路磷酸化与表达水平代表图,采用GAPDH作为内参;B:Image J 软件对目的条带灰度值量化统计分析。图2 JNK信号通路磷酸水平差异的检测Note. A, Phosphorylation and expression level of JNK signal pathway was detected by Western blot, GAPDH was loaded as internal reference. B, Intensities of the Western blot bands were quantitated by ImageJ software.Figure 2 Phosphorylation level of JNK signal pathway 前期研究发现,Poly I∶C可诱导巨噬细胞IRF7表达上调,通过激活JNK信号通路以促进M1型极化反应[12]。Poly I∶C作用F4/80hi亚群后,其JNK通路磷酸化水平(相对表达量为1.19.)相较于对照组(相对表达量0.29),呈升高趋势。Poly I∶C作用F4/80lo亚群后,JNK通路磷酸化水平(相对表达量为0.064)相较于对照组磷酸化水平(相对表达量0.075),无明显变化趋势,具体结果见图2。 为进一步研究JNK信号通路在腹腔异质性巨噬细胞亚群应答Poly I∶C过程中的作用机制,在Poly I∶C作用的同时,加入JNK通路磷酸化抑制剂SP600125,以观察阻断JNK通路磷酸化对F4/80hi亚群和F4/80lo亚群促炎因子IL6和IFNα表达的影响。以无Poly I∶C和SP600125普通培养基的F4/80hi亚群为基线(RQ=1)。结果表明,未加入Poly I∶C刺激,F4/80hi亚群巨噬细胞,IL6相对表达量为1.00 ± 0.02,IFNα相对表达量为1.00 ± 0.03;Poly I∶C刺激后的F4/80hi亚群巨噬细胞,IL6相对表达量(2.64±0.05)和IFNα相对表达量(3.93±0.18)均显著上调,P<0.05;加入SP600125作用后,F4/80hi亚群巨噬细胞IL6相对表达量(1.25±0.05)和IFNα相对表达量(0.93±0.13)均显著下调,P<0.05。未加入Poly I∶C刺激,F4/80lo亚群巨噬细胞,IL6相对表达量为(0.32±0.02),IFNα相对表达量为(0.22±0.02);Poly I∶C刺激后的F4/80lo亚群巨噬细胞,IL6表达(0.37±0.01)和IFNα表达(0.17±0.02),与未加入Poly I∶C的F4/80lo亚群巨噬细胞组相比均无显著差异;加入SP600125作用后,F4/80lo亚群巨噬细胞IL6相对表达量(0.34±0.02)和IFNα相对表达量(0.11±0.01),与加入Poly I∶C但未加入SP600125的F4/80lo亚群巨噬细胞组相比均无显著差异,具体结果见图3。 注: A: 促炎因子IL-6基因表达的变化; B:促炎因子IFNα基因表达的变化。F4/80高表达亚群Poly I∶C刺激前与刺激后比较;F4/80高表达亚群加入抑制剂与未加入抑制剂的比较,*P<0.05。图3 阻断JNK信号活化后促炎因子IL-6和 IFNα基因表达变化Note. A, Relative expression of IL-6. B, IFNα.F4/80hi subset oafter Poly I∶C stimulation compared with before Poly I∶C stimulation, F4/80hi subset with SP600/25 stimulation compared with without SP600/25 stimulation,*P<0.05.Figure 3 Relative expression level of pro-inflammatory factors IL-6 and IFNα when phosphorylation of JNK signal pathway was attenuated 流行性感冒病毒(流感病毒)其感染的严重程度,和病毒引起的以过度炎症反应为特征的细胞因子风暴呈正相关[13]。部分宿主在感染H1N1流感病毒后,免疫细胞过度激活进而释放大量促炎细胞因子,引发细胞因子风暴,可发展为急性肺损伤,甚至可进展为急性呼吸窘迫综合征,导致呼吸衰竭与多器官损伤[14]。本研究通过研究异质性巨噬细胞亚群对早期病毒感染差异化应答及相关机制,发现在Poly I∶C诱导的病毒感染模型中,F4/80hi巨噬细胞亚群在病毒感染早期活化程度显著性高于F4/80lo亚群。F4/80hi巨噬细胞亚群释放大量的促炎细胞因子IL6,IFNα、IFNγ,同时转录因子IRF3和IRF7显著上调,通过活化JNK信号通路推进其促炎表型的形成,而抑制JNK通路磷酸化可显著抑制F4/80hi亚群致敏性。该结果进一步提示我们,定向干预F4/80hi巨噬细胞亚群过度激活,可能对抑制或延缓细胞因子风暴的发生起着积极重要作用。 固有免疫系统是机体抵抗病毒侵染的第一道防线,同时也是适应性免疫发展的基础。近年来,固有免疫中树突状细胞(DC)和巨噬细胞在抗病毒中的作用备受关注。髓系DC(mDC)可以主动摄取乙肝病毒抗原肽,通过MHCΙ类分子途径提呈抗原肽至CD8+T细胞,进而引发Th1型免疫反应[15]。而在巨细胞病毒感染中,浆细胞样DC(pDC)可通过分泌干扰素诱导Th2型免疫反应[16]。有报道表明,M1型巨噬细胞过度活化可导致急性流感病毒感染患者细胞因子风暴的产生,在感染早期介入抑制M1型巨噬细胞的过度激活,可以有效改善预后[17]。在本研究中我们发现,F4/80hi巨噬细胞亚群在早期病毒感染中促炎因子IL6、iNOS、IFNα、IFNγ表达上调。已有报道表明[18],F4/80hi巨噬细胞亚群成熟度和吞噬能力高于F4/80lo亚群。提示我们在病毒感染早期,可以通过氯磷酸盐脂质体类药物清除过度活化的F4/80hi亚群,以降低细胞因子风暴产生风险。然而随着病毒感染进程的推进,F4/80lo巨噬细胞亚群可能定向发育为F4/80hi亚群,此时采用氯磷酸盐脂质体清除巨噬细胞后是否能够抑制过度激活、能够真正利于机体病毒清除还有待进一步研究。 前期研究发现,功能异质性巨噬细胞亚群和组织特异性巨噬细胞亚群在白血病微环境中起着迥然相异的作用,其激活信号通路途径也不尽相同[19-21]。相较于脾巨噬细胞亚群,骨髓巨噬细胞亚群IRF7基因表达显著上调并活化JNK信号通路,诱导其促炎M1型表型与功能[12]。本研究发现,F4/80hi巨噬细胞亚群在病毒感染后IRF7基因高表达,且JNK磷酸化激活,提示我们IRF7-JNK通路可能在成熟巨噬细胞抗病毒早期免疫应答过程中起着重要作用。因此,采用SP600125等抑制JNK通路激活的化学类抑制剂,亦可作为阻断巨噬细胞过度激活的有效手段。 综上,研究异质性巨噬细胞在病毒感染免疫应答与活化中的作用与机制,进而探讨并开发新的免疫抑制剂与靶向小分子抑制剂,对防止或延缓病毒侵染导致细胞因子风暴的发生具有重要意义,同时将为疾病的预防与治疗提供积极的帮助。1.4 统计学方法


2 结果
2.1 腹腔F4/80hi亚群和F4/80lo亚群相对数量的比较

2.2 Poly I∶C免疫刺激下巨噬细胞亚群促炎因子和转录因子表达变化趋势


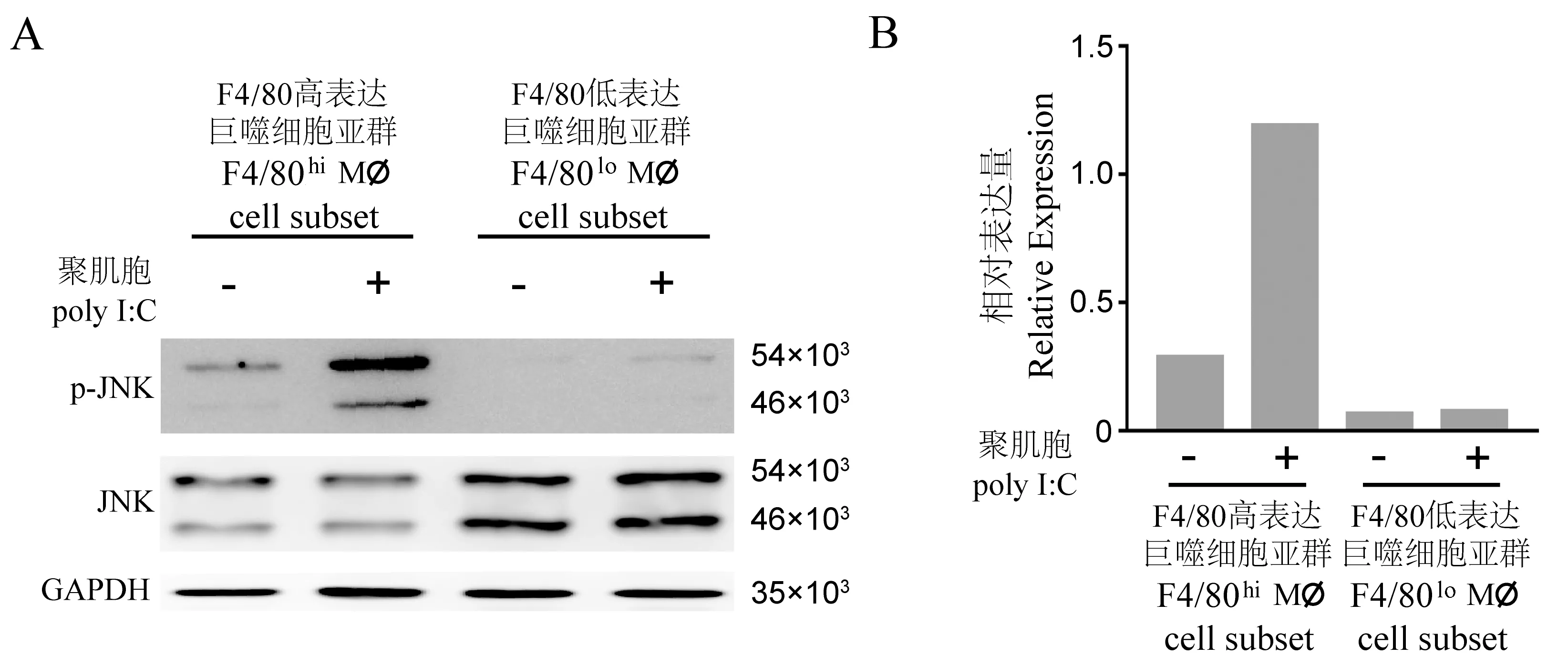
2.3 Poly I∶C免疫刺激下F4/80hi亚群和F4/80lo亚群信号通路的变化
2.4 阻断JNK通路活化对Poly I∶C作用后F4/80hi亚群和F4/80lo亚群促炎因子表达的影响
3 讨论

