姜黄素增强PTEN野生型三阴性乳腺癌细胞对PARP1抑制剂敏感性的研究
孙偲丰,王 莹,杨彦琴,玄基泽,张 斌,秦元华,茅卫锋*
(1.大连医科大学基础医学院生物技术系,辽宁 大连 116044; 2.大连医科大学附属第二医院肿瘤放射治疗科,辽宁 大连 116011; 3.大连医科大学附属第二医院病理科,辽宁 大连 116011; 4.大连医科大学第一附属医院肿瘤科,辽宁 大连 116011; 5.大连医科大学基础医学院寄生虫系,辽宁 大连 116044)
乳腺癌是发生于女性中最恶性的肿瘤之一,每年约有458,000人死于乳腺癌[1-2]。三阴性乳腺癌是雌激素受体(ER)、孕激素受体(PR)和原癌基因Her-2都为阴性的一种乳腺癌。由于是三阴性,常规靶向药物无法对其产生作用,只能按照常规放化疗治疗,但这种治疗效果较差,伴随低疗效、高复发的特性。PARP1抑制剂作为一种新型的靶向PARP1的分子靶向药物,近年来在乳腺癌治疗中表现出较好的疗效。PARP1是PARP家族的主要成员,其可将ADP-核糖基团转移至靶蛋白[3-5]。一旦DNA断裂发生,PARP1作为单链断裂(SSB)修复中的关键因子可以感知损伤并快速结合到断裂位点并使自身核糖基化,并进一步催化靶蛋白的核糖基化,招募DNA修复蛋白进行DNA修复[6]。因此PARP1抑制剂奥拉帕尼作为抗肿瘤药物具有良好效果,并已在临床上用于治疗乳腺癌和卵巢癌[7-8]。据报道,奥拉帕尼可有效抑制BRCA1和PTEN缺陷肿瘤细胞的生长,显示出PARP1和BRCA1/PTEN的合成致死性。然而,野生型PTEN的肿瘤细胞表现出对PARP1抑制剂的不敏感性[9],因此,急需要寻找可以增加野生型PTEN肿瘤细胞对奥拉帕尼敏感性的协同剂。
磷酸酶和张力蛋白同源物(PTEN)是位于人类基因组10q23.3上的抑癌基因表达的蛋白,PTEN通过参与PI3K途径而在细胞增殖中起作用[10-11]。PTEN突变经常发生在各种类型的癌症中[12-13]。PTEN还促进DNA修复以维持染色体的稳定性[14-15]。PTEN能增强肿瘤细胞对化疗药物抗性[16]。PTEN与复制蛋白A1协同作用,可以保护DNA复制叉并增强RAD51介导的同源重组(HR)。然而,PTEN在DNA修复中的具体作用仍未明确[9,15]。
姜黄素是一种从姜黄根中分离出来的天然化合物,具有抗氧化,抗炎和抗肿瘤活性[17-22]。姜黄素易获得,价格便宜,常用作膳食调味品[23-24]。据报道,姜黄素可抑制不同类型肿瘤细胞的生长,并使癌细胞对阿霉素和5-FU敏感[25]。本研究主要探讨了姜黄素对PTEN介导的DNA修复的作用及其潜在机制。这些结果可扩展姜黄素在PTEN野生型三阴性乳腺癌治疗中的应用,也可以为异常PTEN肿瘤细胞的个性化治疗提供理论基础。
1 材料和方法
1.1 实验细胞
人乳腺癌细胞系BT549从美国组织培养物收集中心(ATCC,美国)购得,是PTEN缺陷的三阴性乳腺癌细胞系。细胞在含有10% FBS(Biological Industries,Kibbutz Beit Haemek,以色列),1%青霉素和链霉素(Gibico,美国)的RPMI 1640(Hyclone,美国)中培养。本实验室稳转PTEN基因到BT549中,获得含PTEN基因的BT549,代表野生型BT549。
1.2 主要试剂
PTEN的抗体(sc-9145)购自Santa Cruz(美国);β-肌动蛋白(66009-1-1g)、PARP1(13371-1-AP)、微管蛋白(11224-1AP)、RAD51(14961-1-AP)的抗体购自Proteintech(美国)。PARP抑制剂奥拉帕尼(S1060)、姜黄素(S1814)购自Selleck(美国);苯甲基磺酰氟(PMSF);蛋白酶抑制剂(B14001,Selleck,美国);磷酸酶抑制剂(B15001,Selleck,美国);Fluorometer Qubit 2.0(Invitrogen,美国);MTT、NaCl、EDTA、Tris、肌氨酸钠、Trixton X-100、DMSO、NaOH(生工,中国)。
1.3 实验方法
1.3.1 蛋白质印迹
用含1 mmol/L苯甲基磺酰氟(PMSF),1×蛋白酶抑制剂和1×磷酸酶抑制剂的冰冷RIPA缓冲液裂解细胞;Fluorometer Qubit 2.0测定总蛋白浓度;使用10%SDS-PAGE凝胶分离细胞裂解物;将凝胶上的蛋白转移至PVDF膜,使用各种抗体(稀释比1∶500)检测蛋白质。
1.3.2 MTT检测
将细胞(4000个细胞/孔)接种在96孔板中。待细胞贴壁后,加入药物,与细胞一起温育48 h。取出药物,然后将3-(4,5-二甲基噻唑-2-基)-2,5-二苯基四唑溴化物(MTT)加入96孔板,与细胞一起温育4 h。除去培养基后加入150 μL的DMSO,492 nm处读取吸光度。

注:A:通过蛋白质印迹法分别检测转染PTEN基因、空载体的BT549细胞中PTEN的表达;B:PTEN细胞和EV(空载体)细胞通过MTT法测定的生长曲线。PTEN:稳定转染PTEN的BT529细胞,EV:转染空载体的BT549细胞。图1 PTEN基因的BT529细胞和转染空载体(EV)的BT549细胞的生长曲线Note. A, Expression of PTEN in BT549 cells transfected with PTEN gene and empty vector was detected by Western blot. B, Growth curves of PTEN cells and EV cells were tested by MTT assay. PTEN, BT529 cells stably transfected with PTEN. EV, BT549 cells transfected with empty vector.Figure 1 Growth curves of PTEN-transfected BT529 cells and empty vector-transfected BT549 cells
1.3.3 彗实实验
40 μmol/L姜黄素或80 μmol/L奥拉帕尼处理细胞后,取5000个细胞包埋在低熔点琼脂糖的载玻片上。将载玻片浸入冰冷的裂解缓冲液(2.5 mol/L NaCl,100 mmol/L EDTA,10 mmol/L Tris,1%肌氨酸钠,1% Trixton X-100,10%DMSO)裂解40 min。然后将载玻片放入碱性缓冲液(1 mmol/L EDTA,300 mmol/L NaOH)中电泳。用溴化乙锭染色后,显微镜分析结果。
1.4 统计学方法
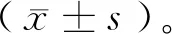
2 结果
2.1 PTEN上调RAD51的表达增强DNA修复
如图1所示,野生型BT549与BT549的细胞存活曲线(图1A)显示两者间没有生长差异(图1B)。
MTT测定显示EV细胞对奥拉帕尼敏感,而PTEN细胞对奥拉帕尼耐药。这些结果表明野生型PTEN细胞对新型分子靶向药物奥拉帕尼耐受(图2A)。随后,蛋白质印迹实验检测了两种细胞RAD51的水平(图2B),显示PTEN野生型细胞的RAD51表达更高,表明PTEN增加RAD51介导的同源重组修复以促进DNA修复。
2.2 姜黄素增强奥拉帕尼诱导的DNA断裂
接下来分析了姜黄素对PTEN促进DNA修复的影响。用奥拉帕尼处理PTEN野生型细胞24 h后,通过彗星试验检测DNA断裂。图中显示姜黄素诱导DNA的断裂。更重要的是,与单种药物产生的彗尾相比,姜黄素与奥拉帕尼的联合使用明显增加了彗尾(图3A、3B)。这些结果表明姜黄素促进PTEN野生型细胞中奥拉帕尼诱导的DNA断裂。
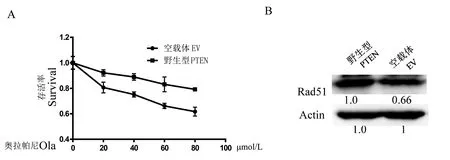
注:A:用不同剂量的奥拉帕尼处理24 h后,与转染空载体的BT549细胞相比,PTEN细胞具有olaprib抗性;B:蛋白质印迹显示,与EV细胞中的RAD51水平相比,PTEN上调RAD51的表达。图2 PTEN上调RAD51表达,增强PTEN野生型BT549对PARP1抑制剂奥拉帕尼的耐受Note. A, After treatment with different doses of Olaparib for 24 hours, PTEN cells were resistant to olaprib compared to BT549 cells transfected with an empty vector. B, Western blot shows that PTEN up-regulates RAD51 expression compared to RAD51 levels in EV cells.Figure 2 PTEN upregulates RAD51-mediated resistance of PTEN wild-type BT549 to the PARP1 inhibitor, Olaparib

注: A:用奥拉帕尼或姜黄素处理转染PTEN的BT549细胞12 h。彗星实验显示,40 μmol/L姜黄素增加了彗尾,并促进了奥拉帕尼(80 μmol/L)诱导的PTEN细胞的彗尾;B:分析彗星实验中的30个彗尾。单因素方差分析和 Turkey’s检验,与奥拉帕尼治疗组相比,***P <0.001。图3 姜黄素促进奥拉帕尼处理后的PTEN细胞中的DNA断裂Note. A, BT549 cells transfected with PTEN were treated with Olaparib or curcumin for 12 hours. The comet assay showed that 40 μmol/L curcumin increased the comet tail and promoted the comet tail of PTEN cells induced by Olaparib (80 μmol/L). B, Analysis of 30 comet tails in comet experiments. One-way analysis of variance and Turkey’s test, compared with the Olaparib treatment group,***P<0.001.Figure 3 Curcumin promotes DNA breaks in PTEN cells treated with Olaparib
2.3 姜黄素降低PTEN乳腺癌细胞中RAD51的表达
随后分析了姜黄素增强PTEN野生型乳腺癌细胞对奥拉帕尼敏感性的潜在机制。用姜黄素处理后,RAD51水平以剂量依赖性方式降低(图4)。因此,姜黄素会降低RAD51的表达,从而减轻PTEN介导的DNA修复。此外,我们还发现姜黄素降低了PARP1的水平,这表明姜黄素可能同样影响PARP1参与的DNA修复(图4)。

注:蛋白质印迹结果显示姜黄素降低了PTEN细胞中Rad51和PARP1的水平。每个Western数值均由三次实验完成,其中对照数值设定为1。Turkey’s检验,***P<0.001。图4 姜黄素降低了PTEN细胞中RAD51的水平Note. Western blot results showed that curcumin reduced the levels of RAD51 and PARP1 in PTEN cells. Each Western value was completed by three experiments. The control value was set 1. Turkey’s test,***P<0.001.Figure 4 Curcumin decreases the levels of RAD51 which is up-regulated in PTEN cells
2.4 姜黄素使PTEN野生型细胞对奥拉帕尼敏感
我们用MTT实验检测了姜黄素和奥拉帕尼联合处理的PTEN野生型细胞的生长曲线,与单药奥拉帕尼或姜黄素相比,显示出姜黄素以剂量依赖性方式使PTEN野生型细胞对奥拉帕尼敏感(图5A、5B)。这些结果表明,姜黄素与奥拉帕尼联合使用时,PTEN野生型癌细胞更加敏感。

注: A:姜黄素单药处理PTEN细胞与EV细胞后的存活曲线;B:MTT实验检测姜黄素与奥拉帕尼联合使用后,PTEN细胞的存活曲线。单因素方差分析和Turkey’s检验,与奥拉帕尼治疗组相比,***P<0.001,**P <0.01,*P <0.05。图5 姜黄素使转染PTEN的BT549细胞对奥拉帕尼敏感Note. A, Survival curves of curcumin monotherapy on PTEN cells and EV cells. B, MTT test to detect the survival curve of PTEN cells after curcumin was combined with Olaparib. One-way analysis of variance and Turkey’s test, compared with Olaparib treatment group,***P <0.001,**P <0.01,*P <0.05.Figure 5 Curcumin sensitizes PTEN-transfected BT549 cells to Olaparib
3 讨论
PTEN是癌细胞中高度突变的抑癌基因,是癌症治疗的潜在靶标靶标[12]。最近的报道显示PTEN具有DNA修复能力,使得PTEN野生型肿瘤细胞具有DNA损伤药物抗性[9,16], 因此研究PTEN引起的肿瘤化疗耐药性具有重要意义。奥拉帕尼是PARP1抑制剂,通过抑制PARP1活性以抑制单链断裂修复[7]。PARP1抑制剂不直接诱导DNA断裂,因此它具有低毒性并且是有前景的抗肿瘤药物。奥拉帕尼已被临床用于治疗卵巢癌和乳腺癌。然而,奥拉帕尼的作用依赖于肿瘤细胞的遗传背景。BRCA异常癌细胞对奥拉帕尼敏感,而BRCA和PTEN野生型细胞对奥拉帕尼耐药[7]。由于PTEN在DNA修复中的功能尚不清楚,因此很少报道能使PTEN野生型肿瘤细胞敏感的药物。据报道RI-1是一种RAD51抑制剂,可增加PTEN肿瘤细胞对顺铂的敏感性。然而,RI-1也不是临床试剂。此外,抑制RAD51并不能完全降低PTEN的DNA修复能力。
几个世纪以来,姜黄素一直被用作食用性香料,且在I期人体试验中,受试者每天使用量高达8000 mg,持续3个月仍没有显示出毒性[23]。据报道,姜黄素还具有抗肿瘤活性并可抑制多种DNA修复途径[25],姜黄素干预N-甲基亚硝基脲诱发膀胱癌[26]。针对三阴性乳腺癌的耐化疗药物特性[27],本研究分析了姜黄素对于PTEN的DNA修复能力的影响,同时分析了姜黄素对奥拉帕尼处理PTEN野生型三阴性乳腺癌细胞敏感性的影响。本研究发现PTEN促进奥拉帕尼诱导DNA损伤的修复,细胞生长曲线显示PTEN有助于肿瘤细胞抵抗奥拉帕尼。用姜黄素处理后,彗星实验显示PTEN野生型肿瘤细胞中的DNA断裂增加。MTT实验显示姜黄素增加PTEN野生型肿瘤细胞对奥拉帕尼的敏感。我们的研究结果表明,姜黄素可以抑制PTEN促进的DNA修复。
RAD51是HR中的关键因子,据报道,它在PTEN促进DNA的修复中起较为重要的作用[9]。我们发现姜黄素明显降低了RAD51的水平。该结果表明姜黄素干扰RAD51介导的HR并且可以通过降低RAD51水平影响PTEN介导的DNA修复。另外我们还发现姜黄素明显降低了PARP1的水平。PARP1是修饰蛋白质的聚-ADP-核糖基化(PARylation)的酶,可添加的多聚ADP-核糖(PAR)至靶标蛋白进而改变蛋白的电荷从而影响它们与DNA的相互作用[5]. 许多DNA修复因子,如XRCC1,Ku70和DNA-PKcs均是PARP1的靶标。由于PARP1影响DNA修复因子和DNA断裂位点之间的相互作用,因此PARP1被认为参与多种DNA修复途径。姜黄素降低PARP1的水平,表明姜黄素除了对RAD51介导的HR有影响外还可以干扰其他DNA修复途径。总之,本文的研究表明姜黄素可以抑制PTEN的DNA修复并使PTEN野生型癌细胞对奥拉帕尼敏感。
综上所述,这些结果表明姜黄素通过抑制RAD51介导的同源重组达到抑制PTEN的DNA修复能力,从而使PTEN野生型乳腺癌细胞对PARP1抑制剂敏感。这些发现将促进姜黄素在具有不同基因型PTEN肿瘤细胞的临床个体化治疗中的应用。

