辛伐他汀纳米粒的构建及对动脉粥样硬化模型大鼠作用的研究
韩金霞,朱亚南,王金文,王吉佳,李 迪,杨静波
(大庆油田总医院心内科,黑龙江 大庆 163000)
动脉粥样硬化(atherosclerosis,AS)指血液内脂质物未及时排出沉积在动脉内膜,久而久之所形成的粥糜样坏死病灶[1-3]。AS是冠心病、脑梗死及外周血管病的早期征兆和病理基础,因而有效预防和治疗AS具有重要的临床意义[4-5]。他汀类药物,是目前临床应用的有效降脂药物,主要用于治疗高脂血症。他汀类药物不仅能强效地降低总胆固醇(TC)和低密度脂蛋白(LDL),而且能一定程度上降低三酰甘油(TG),还能升高高密度脂蛋白(HDL),所以被公认为为较全面的调脂药[6-7]。同时,对于治疗动脉粥样硬化和预防冠心病他汀类药物也能发挥一定疗效[6-7]。辛伐他汀(Simvastatin,Sim)为他汀类药物,是临床上治疗高脂血症的一线用药。Sim作为羟甲基戊二酰辅酶A还原酶抑制剂,在体内主要抑制机体内源性胆固醇的合成以及血液中胆固醇的含量[8]。但由于Sim水溶性较差,口服生物利用度有限,因此其临床应用受到一定限制[9]。脂质聚合物纳米粒(lipid-polymer hybrid nanoparticles, LPNs),简称纳米粒,是近几年研究较热的一种新型纳米给药系统,与传统的脂质体和纳米粒给药载体相比,其具有更优良的生物相容性,较高的载药量,生物可降解等优势,是一种极具发展前景和应用前景的一种新型纳米给药载体[10]。本研究通过构建辛伐他汀纳米粒,主要观察其对大鼠动脉粥样硬化的治疗效果,并对其作用机制进行探讨。
1 材料和方法
1.1 实验材料
1.1.1 实验动物
6~7周龄健康SD大鼠40只,清洁级,雄性,体重180~200 g,采购于北京维通利华实验动物有限公司提供[SCXK(京)2016-0001],本研究获得大庆油田总医院伦理委员会批准(20191012)。大鼠以每笼3~4只饲养于排风通气笼具内,自由饮水、摄食,饲养场所为黑龙江中医药大学屏障环境中[SYXK(黑)2018-007],动物实验严格按实验动物3R原则给予实验动物人道主义关怀。
1.1.2 实验细胞
Caco-2细胞购自中国科学院典型培养物保藏委员会细胞库/中国科学院上海生命科学研究院细胞资源中心,细胞以含20%胎牛血清、1%青-链霉素的MEM培养基培养于37℃、5% CO2、95%空气的细胞培养箱中。
1.2 主要试剂与仪器
辛伐他汀(货号S6196)和COU-6(货号442631)购自美国Sigma公司;总胆固醇(TC)试剂盒(批号20180105)、甘油三酯(TG)试剂盒(批号20180917)、高密度脂蛋白胆固醇(HDL-C)试剂盒(批号20190106)、低密度脂蛋白胆固醇(LDL-C)试剂盒(批号20181224)均购自南京建成生物工程研究所有限公司;HE染色试剂盒购自北京索莱宝公司;GAPDH抗体购自武汉博士德公司;AMPK抗体、p-AMPK抗体、Acetyl-CoA Carboxylase (ACC)抗体和p-ACC抗体购自美国CST公司。高速剪切机(德国艾卡公司);电子天平(德国赛多利斯公司);JEOL JEM-2100F场发射透射电子显微镜(日本日本电子株式会社公司);高压均质机(德国APV公司);CX31倒置显微镜(日本奥林巴斯公司);64R高速低温离心机(美国Beckman公司);NanoSight NS300纳米颗粒跟踪分析仪(英国马尔文公司); SpectraMax 190酶标仪(美国美谷分子仪器公司);AI600凝胶成像仪(美国通用电气公司)。
1.3 实验方法
1.3.1 辛伐他丁纳米粒的构建
制备辛伐他汀纳米粒,将10 mg辛伐他汀和50 mg 聚乳酸-羟基乙酸共聚物(PLGA)溶解在10 mL乙腈中作为有机相,磷脂25 mg溶解在0.5 mg无水乙醇中,然后加入到20 mL 60℃预热的超纯水中分散均匀作为水相。将油相在300 r/min搅拌条件下倒入到水相中,继续室温下搅拌2 h,旋转蒸发除去乙腈。经0.8 μm的滤膜滤过,备用。取制备的辛伐他汀纳米粒子,超纯水稀释50倍,取5 μL纳米粒溶液滴加到铜网上,自然晾干,透射电镜下观察辛伐他汀纳米粒的形态,同时利用纳米颗粒分析仪测定其粒径分布。
1.3.2 纳米粒载药系统细胞摄取研究
香豆素6(COU-6)作为有机荧光染料可模拟细胞对药物的摄取行为。取对数期Caco-2细胞接种于两个13 mm无菌玻璃底细胞培养皿中,培养过夜,次日取制备好的COU-6和COU-6纳米粒(COU-6-LPNs)溶液各100 μL加入1.5 mL培养基中混匀备用,取出细胞,PBS洗2遍,各加入配备好的培养基,于培养箱中继续孵育0.5 h,后弃去细胞上层液体,用PBS轻柔洗细胞3遍,4%多聚甲醛固定20 min,PBS洗3遍,加入浸没细胞量的DAPI 荧光染料(10 μg/mL)染色20 min,PBS洗3遍,封片,铝箔纸避光4℃保存。荧光显微镜拍照,记录荧光强度。
1.3.3 动脉粥样硬化模型构建、分组及给药
构建动脉粥样硬化大鼠模型,设立模型组(Model)、辛伐他汀组(Sim)、辛伐他汀纳米粒组(Sim-LPNs)和对照组(Control)。Model组、Sim组和Sim-LPNs组大鼠腹腔注射60万IU/kg维生素D3,后以高脂饲料饲养8周建立动脉粥样硬化模型;Control组腹腔注射等体积生理盐水,以正常饲料饲养8周。造模完成后Control组和Model组每天灌胃给予生理盐水,Sim组给予Sim 8 mg/(kg·d), Sim-LPNs组给与Sim-LPNs 8 mg/(kg·d),连续给药3周。
1.3.4 大鼠血清TC、TG、LDL-C、HDL-C检测
给药最后1 d,动物禁食过夜,各组大鼠以异氟烷持续麻醉,开腹后于腹主动脉取血约3 mL,室温下静置至凝固, 3000 r/min离心10 min,上清液即为血清,将血清转移至新的EP管中,参照TC、TG、LDL-C、HDL-C检测试剂盒说明书进行检测。
1.3.5 HE染色和动脉粥样硬化斑块面积统计
取血后迅速处死大鼠,并进行解剖,取出肝样本,将样本左中叶剪下,置入10%甲醛溶液中固定。组织样本在固定18 h后,流水冲洗12 h,常规梯度乙醇脱水,石蜡浸泡,包埋,制成4 mm石蜡切片。经二甲苯脱蜡及梯度乙醇复水后,进行苏木素-伊红(HE)染色,梯度乙醇脱水,二甲苯脱乙醇,最后中性树胶封片,显微镜下观察肝组织切片的病理变化并拍照。采用Photoshop(软件)计算动脉粥样硬化斑块面积。
1.3.6 蛋白印记实验检测肝组织p-AMPK和p-ACC蛋白表达变化
解剖各组大鼠,各取肝组织0.5 g左右,眼科剪剪碎后置于管中,加入1 mL细胞组织裂解液,均质仪研碎并于冰上静置5 min,参考文献[1]方法提取蛋白,按每孔30 μg蛋白进行SDS-PAGE电泳,将蛋白转印至PVDF膜上,封闭。按需求加入AMPK抗体(1∶2000)、p-AMPK抗体(1∶500)、ACC抗体(1∶2000)、p-ACC抗体(1∶1000)或GAPDH抗体(1∶5000)4℃孵育过夜。次日,TBST洗膜后加入相应的抗兔IgG-HRP二抗(1∶2000),室温孵育1 h,PVDF膜以ECL发光试剂盒进行显色并于AI600凝胶成像仪中成像,对蛋白印迹条带进行处理和分析。磷酸化蛋白相对蛋白表达量= 磷酸化蛋白灰度值/(总蛋白灰度值/GAPDH灰度值)。
1.4 统计学方法

2 结果
2.1 Sim-LPNs的体外表征
Sim-LPNs粒径分布如图1A所示, Sim-LPNs的平均动力学直径为(180±23) nm。如图1B所示,在透射电镜下,Sim-LPNs形态较为圆整,外观呈均一的球形。
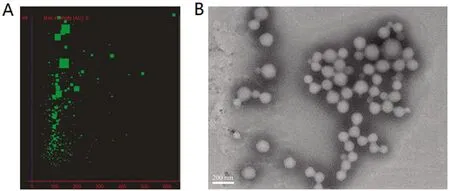
图1 辛伐他汀纳米粒径分布和透射电镜图Figure 1 The size distribution and transmission electron micrograph of S-LPNs
2.2 纳米粒载药系统细胞摄取水平
COU-6为绿色荧光染料,如图2所示,荧光显微镜下观察发现,COU-6和COU-6-LPNs处理后的Caco-2细胞均可发出绿色荧光,但与COU-6相比,COU-6-LPNs呈现高荧光水平。结果如图3所示, COU-6和COU-6-LPNs细胞的平均荧光强度值分别为(221.3±34.5)和(756.8±78.4),后者荧光强度显著增强(P<0.01)。
2.3 各组大鼠血清TC、TG、LDL-C、HDL-C水平比较
检测各组大鼠血清TC、TG、LDL-C、HDL-C水平,结果显示,与对照组(Control)相比,模型组(Model)大鼠TC、TG、LDL-C均显著升高,HDL-C明显降低(P<0.01);相较于Model,辛伐他汀组(Sim)TG和HDL-C变化不明显,TC和LDL-C显著降低(P<0.05或P<0.01);与Model相比,辛伐他汀纳米粒组(Sim-LPNs)TC、TG、LDL-C均显著降低,HDL-C明显升高(P<0.01);与Sim相比,Sim-LPNs大鼠TC和LDL-C显著降低(P<0.01)(见表1)。
2.4 各组大鼠主动脉HE染色和粥样硬化斑块面积
如图4所示,HE染色结果发现,Model组大鼠动脉血管壁粘膜变性和水肿,在血管壁中出现典型的动脉粥样硬化斑块,并且脂质核心较厚,泡沫明显;Sim组出现一定改善,但Sim-LPNs组改善更为明显。计算各组斑块面积,结果如表2所示,与Control组相比,Model组动脉血管壁相对斑块面积和相对斑块面积/总面均显著增加(P<0.01);Control组和Sim组未见明显差异;Sim-LPNs组相较于Model组动脉血管壁相对斑块面积和相对斑块面积/总面明显减小(P<0.01)。
2.5 各组大鼠肝组织中p-AMPK和p-ACC蛋白表达变化
Western blot结果显示,相较于Control组,Model组大鼠肝组织p-AMPK和p-ACC蛋白表达均显著下调(P<0.01);与模型组相比,Sim组p-AMPK蛋白表达显著上调(P<0.05),Sim-LPNs组p-AMPK和p-ACC蛋白表达显著上调(P<0.05或P<0.01);与Sim组相比,Sim-LPNs组p-AMPK蛋白表达上调更明显(P<0.01),见表3和图5。

注:A:Caco-2细对COU-6的摄取;B:Caco-2细对COU-6-LPNs的摄取。图2 Caco-2细对COU-6和COU-6-LPNs的摄取Note. A, Caco-2 fine intake of COU-6. B, Caco-2 fine intake of COU-6-LPNs.Figure 2 Absorption capacity of Caco-2 to COU-6 and COU-6-LPNs
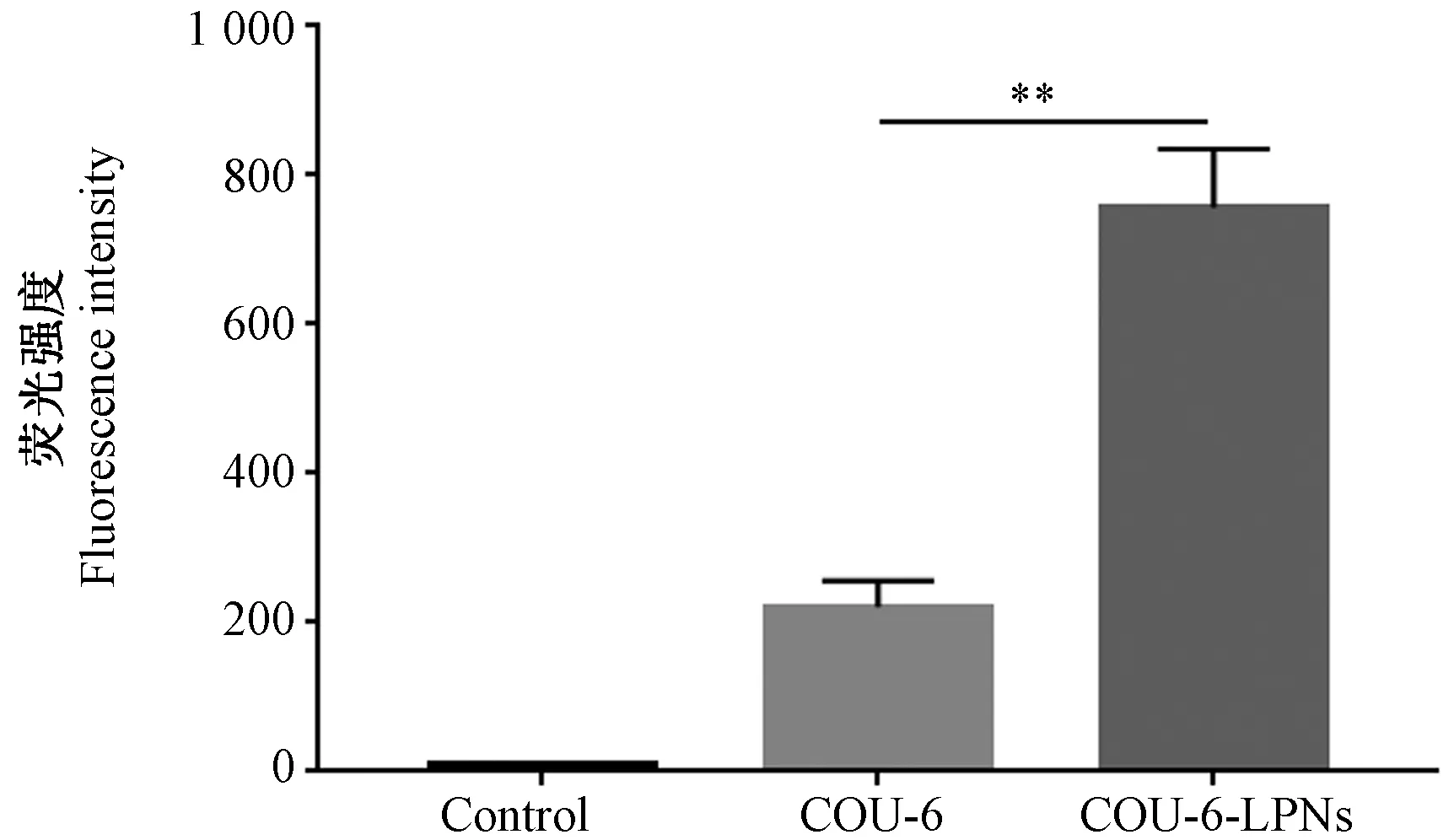
图3 Caco-2细摄取COU-6和COU-6-LPNs后的 荧光强度Figure 3 Fluorescence intensity of Caco-2 after fine uptake of COU-6 and COU-6-LPNs
3 讨论
LPNs作为近几年大家比较关注的新型给药系统,兼具传统脂质体和聚合物纳米粒两种纳米药物载体的优点,在增加水不溶性药物生物利用度和控制药物释放等方面显示出了独特的优势[11]。PLGA是一种生物可降解的材料、磷脂层为纳米载体的外壳,对于疏水性药物有更好的包载,而磷脂层外壳与细胞膜的表面具有类似的生理功能,因此可增加纳米粒子的生物相容性,同时也能够减缓药物的释放[12-14]。此外,纳米粒子表面也可以进行功能基团的修饰,可进一步促进细胞的摄取,增强药效[15-16]。
本研究制备辛伐他汀纳米粒,验证发现其形态圆整,外观呈均一的球形,更有利于增加对生物膜的穿透性及增强细胞内的药效发挥。本研究发现LPNs可增强Caco-2细胞对COU-6的摄取。研究显示,Caco-2细胞可形成与小肠上皮细胞相同的细胞极性和致密的单细胞层结构,分化出绒毛面A和基底面B,可做为研究药物吸收和转运的有效工具[17-18]。提示,LPNs能提高药物的小肠吸收。观察血清TC、TG、LDL-C、HDL-C水平发现,实验终点时,Sim可显著降低TC和 LDL-C水平;而Sim-LPNs不仅可更为显著的降低TC和 LDL-C水平,还能显著降低TG水平和升高HDL-C水平。提示,LPNs可

表1 各组大鼠血清TC、TG、LDL-C、HDL-C水平Table 1 Serum TC, TG, LDL-C, HDL-C levels of rats in each group
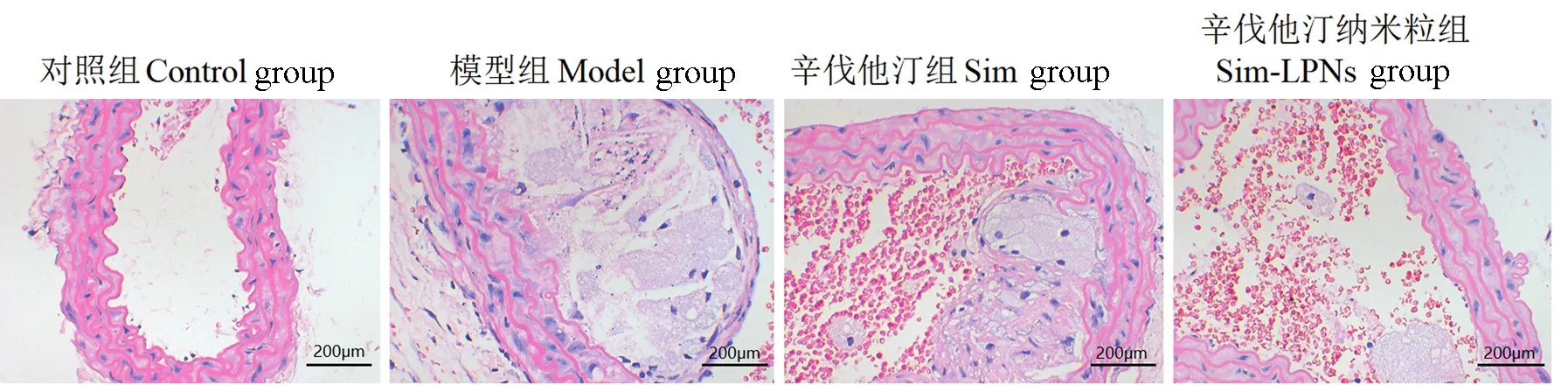
图4 各组主动脉HE染色Figure 4 HE staining of aorta in each group

表2 各组大鼠动脉血管壁相对斑块面积
表3 各组大鼠肝组织中p-AMPK和p-ACC相对 蛋白表达量Table 3 Relative protein expression of p-AMPK and p-ACC in liver tissues of rats in each group

图5 各组大鼠肝组织中p-AMPK和p-ACC蛋白表达水平Figure 5 Expression levels of p-AMPK and p-ACC protein in liver tissues of rats in each group
增强Sim的降脂效果。观察各组大鼠主动脉粥样硬化程度发现,模型组大鼠动脉血管壁粘膜变性和水肿,在血管壁中出现典型的动脉粥样硬化斑块,并且脂质核心较厚,泡沫明显。Sim治疗后病理变化得到一定改善,而Sim-LPNs治疗后的改善效果更为明显。计算各组粥样硬化斑块面积发现, Sim-LPNs治疗后模型大鼠动脉血管壁相对斑块面积和相对斑块面积/总面均明显减小。这些提示,LPNs可显著增强Sim对大鼠动脉粥样硬化的治疗效果。
业已证明,AMPK-ACC信号通路在参与机体能量代谢和脂肪合成中发挥重要生理作用。文献报道,AMPK可通过直接磷酸化脂质代谢相关的酶类,从而改变脂质的代谢方向。ACC是AMPK的下游靶点之一,由于ACC是脂肪酸代谢的限速酶,当机体处于应激状态时,组织细胞内AMPK被激活,而活化的AMPK可磷酸化ACC 的79 位点苏氨酸位点而使后者失活[19-20]。ACC失活后,脂肪酸氧化加剧,血清游离脂肪酸水平降低,脂肪在组织中的沉积减少[19-21]。肝是人体重要的代谢器官,参与糖类、脂类和蛋白质的代谢。本研究观察了肝AMPK和ACC蛋白表达变化,结果发现,动脉粥样硬化模型大鼠AMPK和ACC磷酸化蛋白均显著下调,Sim治疗后模型大鼠肝p-AMPK明显上调,但ACC变化不明显。而Sim-LPNs治疗后模型大鼠肝p-AMPK和p-ACC均显著上调。这些提示,相较于Sim,Sim-LPNs可明显激活肝细胞AMPK-ACC信号通路,从而参与促进脂质代谢调节。
综上所述,相较于Sim,Sim-LPNs对动脉粥样硬化大鼠具有较好的治疗作用,而该作用可能与增强小肠对药物的吸收和激活肝细胞AMPK-ACC信号通路增强脂质代谢有关。

