咪唑安定通过上调miR-290-5p调节PI3K/AKT信号通路抑制缺氧诱导心肌细胞损伤的机制研究
江婷婷,马兴华
(西安交通大学医学院附属三二〇一医院麻醉科, 陕西 汉中 723000)

1 材料和方法
1.1 实验细胞
大鼠心肌细胞H9C2购自中田科学院典型培养物保藏委员会细胞库。
1.2 主要试剂
DMEM培养基、胎牛血清、青链霉素混合液购于武汉普诺赛生命科技有限公司;咪唑安定(批号:20111005)购于徐州恩华药业集团有限责任公司;细胞计数试剂盒(Cell Counting Kit 8,CCK-8)购于北京百奥莱博科技有限公司;膜联蛋白V异硫氰酸荧光素/碘化丙啶(Annexin V-FITC/PI)细胞凋亡检测试剂盒购于南京诺唯赞生物科技有限公司;逆转录试剂盒和荧光定量PCR试剂盒购于大连宝生物工程有限公司;miR-290-5p模拟物(miR-290-5p mimics)及其阴性对照(miR-NC)、miR-290-5p抑制物(anti-miR-290-5p)及其阴性对照(anti-miR-NC)、PCR引物由上海生工生物工程股份有限公司提供;兔源细胞周期素D1(cyclinD1)抗体、兔源活化的含半胱氨酸的天冬氨酸蛋白水解酶3(Cleaved caspase 3,C-caspase-3)抗体、兔源β-肌动蛋白(β-actin)、兔源磷酸化的磷脂酰肌醇-3-羟激酶(p-PI3K)抗体和兔源磷酸化的蛋白激酶B(p-AKT)抗体购于美国CST公司。
1.3 实验方法
1.3.1 细胞培养和模型构建
H9C2细胞采用DMEM培养基(含10%胎牛血清和1%青链霉素溶液)培养,置于37℃缺氧培养箱(含1% O2、5% CO2、94% N2)内培养48 h构建心肌细胞缺氧损伤模型[8]。
1.3.2 MID对缺氧诱导的心肌细胞存活、凋亡以及miR-290-5p表达的影响
(1)CCK-8法检测细胞存活
将H9C2细胞(每孔5×103cells)接种到96孔板并分为正常(NC)组、缺氧(hypoxia)组、MID+hypoxia组(分别采用终浓度为8、16、32 μmol/L的MID处理心肌细胞后进行缺氧处理)。各组细胞进行相应处理后,每孔加入10 μL的CCK-8试剂,培养箱孵育4 h,酶标仪测定450 nm波长处的吸光度值。确定用药浓度为16 μmol/L。
(2)流式细胞术检测细胞凋亡
收集NC组、hypoxia组、MID+hypoxia组H9C2细胞,PBS洗涤细胞2次,采用结合缓冲液调整为单细胞悬液。取100 μL细胞悬液(1×105cells/mL)加入流式管,按照Annexin V-FITC/PI试剂盒说明书检测细胞凋亡情况。
(3)RT-qPCR检测miR-290-5p的表达水平
收集NC组、hypoxia组、MID+hypoxia组H9C2细胞,PBS洗涤细胞2次,TRIzol法提取各组细胞的总RNA,随后进行逆转录反应和RT-qPCR反应。miR-290-5p的表达以U6为内参,按照2-ΔΔCt法计算其表达水平。引物序列如下(5’-3’):miR-290-5p上游引物:GCTGGGTTTCACGGGGGTATCAA,下游引物:TCAACTGAGTGCCGTAGGGTGCG;U6上游引物:CTCGCTTCGGCAGCACATATACT,下游引物:ACGC TTCACGAATTTGCGTGTC。
(4)Western blot检测Cleaved-caspase-3的表达水平
收集NC组、hypoxia组、MID+hypoxia组H9C2细胞,采用RIPA裂解液获得各组细胞蛋白。将细胞蛋白与适量上样缓冲液混合煮沸变性后,取适量样品进行聚丙烯酰胺凝胶电泳。随后利用湿法转膜装置将分离的细胞蛋白转移至硝酸纤维素膜。5%的脱脂牛奶封闭膜后,采用PBS液洗膜3次,将膜置于稀释的一抗溶液中4℃孵育过夜,PBS液洗膜3次,将膜置于稀释的二抗溶液中室温孵育1 h,PBS液洗膜3次,进行化学发光显色。以目标蛋白与内参β-actin蛋白灰度值的比值表示目标蛋白的表达水平。
1.3.3 过表达miR-290-5p对心肌细胞存活和凋亡的影响
将H9C2细胞分为miR-NC+hypoxia组(转染miR-NC 48 h后进行缺氧诱导)、miR-290-5p+hypoxia组(转染miR-290-5p mimics 48 h后进行缺氧诱导)。按照上述步骤检测各组细胞的存活、凋亡以及CyclinD1和Cleaved-caspase-3蛋白的表达情况。
1.3.4 MID调控miR-290-5p表达对缺氧诱导心肌细胞损伤的影响
将H9C2细胞分为anti-miR-NC+MID+hypoxia组(转染anti-miR-NC 48 h后,进行MID干预和缺氧处理)、anti-miR-290-5p+MID+hypoxia组(转染anti-miR-290-5p 48 h后,进行MID干预和缺氧处理),按照上述步骤检测各组细胞的存活、凋亡以及CyclinD1和Cleaved-caspase-3蛋白的表达情况。
1.3.5 MID调控miR-290-5p表达对缺氧诱导心肌细胞损伤PI3K/AKT信号通路的影响
收集NC组、hypoxia组、MID+hypoxia组、anti-miR-NC+MID+hypoxia组、anti-miR-290-5p+MID+hypoxia组H9C2细胞,按照上述Western blot步骤检测各组细胞PI3K/AKT信号通路关键蛋白p-PI3K和p-AKT的表达水平。
1.4 统计学方法
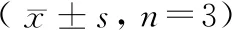
表1 不同浓度MID对心肌细胞H9C2增殖的 影响Table 1 Effect of different concentrations of MID on the proliferation of cardiomyocyte H9C2
2 结果
2.1 不同浓度MID对心肌细胞H9C2增殖的影响
CCK-8实验结果表明,见表1,与NC组比较,hypoxia组H9C2细胞存活率显著降低;与hypoxia组比较,8 μmol/L MID+hypoxia组、16 μmol/L MID+hypoxia组、32 μmol/L MID+hypoxia组细胞存活率显著升高(P<0.05)。随着MID浓度增加,H9C2细胞存活率呈先升高再降低趋势,选择16 μmol/L的MID进行后续实验。
2.2 MID对心肌细胞H9C2凋亡的影响
流式细胞术和Western blot实验结果表明,见图1和表2,与NC组比较,hypoxia组H9C2细胞凋亡率、Cleaved-caspase-3蛋白表达显著升高;与hypoxia组比较,MID+hypoxia组细胞凋亡率、Cleaved-caspase-3蛋白表达显著降低(P<0.05)。
2.3 MID对miR-290-5p表达的影响
RT-qPCR实验结果表明,见表3,与NC组比较,hypoxia组H9C2细胞miR-290-5p的表达显著降低;与hypoxia组比较,MID+hypoxia组H9C2细胞中miR-290-5p的表达显著升高(P<0.05)。
2.4 高表达miR-290-5p对心肌细胞H9C2增殖、凋亡的影响
结果见表4和图2,与miR-NC+hypoxia组比较,miR-290-5p+hypoxia组H9C2细胞miR-290-5p和CyclinD1蛋白的表达水平、细胞存活率显著升高,Cleaved-caspase-3蛋白的表达水平和细胞凋亡率显著降低(P<0.05)。

注:A:流式细胞仪检测细胞凋亡;B:Western blot检测Cleaved-caspase-3蛋白的表达。图1 MID对心肌细胞H9C2凋亡的影响Note. A, Flow cytometry to detect apoptosis. B, Western blot detection of Cleaved-caspase-3 protein expression.Figure 1 Effect of MID on apoptosis of cardiomyocyte H9C2
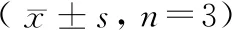
表2 MID对心肌细胞H9C2凋亡的影响
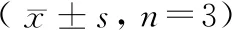
表4 高表达miR-290-5p对心肌细胞H9C2增殖、凋亡的影响Table 4 Effect of high expression of miR-290-5p on proliferation and apoptosis of cardiomyocyte H9C2
2.5 低表达miR-290-5p可以部分逆转MID对心肌细胞H9C2增殖和凋亡的影响
见图3和表5,与anti-miR-NC+MID+hypoxia组比较,anti-miR-290-5p+MID+hypoxia组H9C2细胞miR-290-5p和CyclinD1蛋白的表达水平、细胞存活率显著降低,Cleaved-caspase-3蛋白的表达水平和细胞凋亡率显著升高(P<0.05)。
2.6 PI3K/AKT信号通路相关蛋白的表达
见图4和表6,与NC组比较,hypoxia组H9C2细胞p-PI3K和p-AKT的表达水平显著降低;与hypoxia组比较,MID+hypoxia组H9C2细胞p-PI3K和p-AKT的表达水平显著升高;与anti-miR-NC+MID+hypoxia组比较,anti-miR-290-5p+MID+hypoxia组H9C2细胞p-PI3K和p-AKT的表达水平显著降低(P<0.05)。
3 讨论
缺氧是心肌梗死的主要危险之一。缺氧状态下,心肌细胞线粒体功能异常,能量代谢紊乱,同时引起大量的生理和病理反应,引起心肌细胞损伤和凋亡[9]。因此,如何减轻缺氧诱导的心肌细胞损伤和凋亡对防治心肌梗死具有重要意义。
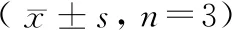
表3 MID对miR-290-5p表达的影响Table 3 Effect of MID on miR-290-5p expression

图2 Western blot检测CyclinD1、 Cleaved-caspase-3蛋白的表达Figure 2 Western blot detects expression of CyclinD1, Cleaved-caspase-3 protein
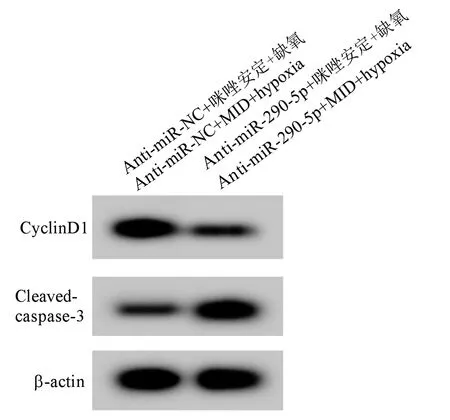
图3 低表达miR-290-5p可以部分逆转MID对H9C2心肌细胞 CylinD1和Cleaved-caspase-3蛋白表达的影响Figure 3 Low expression of miR-290-5p can partially reverse the effect of MID on the expression of CylinD1 and Cleaved-caspase-3 in cardiomyocytes H9C2
表5 低表达miR-290-5p可以部分逆转MID对心肌细胞H9C2增殖、凋亡的影响Table 5 Low expression of miR-290-5p can partially reverse the effect of MID on the proliferation and apoptosis of cardiomyocyte H9C2

图4 Western blot检测p-PI3K、p-AKT蛋白的表达Figure 4 Western blot detects p-PI3K, p-AKT protein expression
长期以来,MID被认为对心肌细胞损伤具有保护作用。刘保江等[10]研究发现MID预处理可改善心脏收缩和舒张功能,减轻再灌注心律失常发生频率,提高心肌细胞抗氧化能力,降低脂质过氧化反应,减轻心肌细胞损伤程度。覃军等[11]指出MID缺氧前预处理可明显增高心肌组织及血浆中血管
表6 PI3K/AKT信号通路相关蛋白的表达Table 6 Expression of PI3K/AKT signaling pathway related proteins
内皮生长因子的表达量,对改善缺血心肌功能具有积极作用。本研究发现缺氧诱导后心肌细胞存活率显著降低,细胞凋亡率和促凋亡蛋白表达水平均显著升高,说明缺氧诱导的心肌细胞损伤模型建立成功。进一步研究发现一定浓度的MID预处理可改善缺氧诱导对心肌细胞的存活抑制作用,并减轻缺氧诱导的心肌细胞凋亡,与前人研究结论相吻合[5, 10-11]。以上研究说明,MID预处理通过抑制缺氧诱导的心肌细胞凋亡,提高心肌细胞存活率,对缺氧诱导的心肌细胞损伤发挥保护作用。
miR-290-5p是miR-290-295簇的成员之一,研究显示miR-290-295在小鼠胚胎干细胞中具有潜在的促生存功能,其表达缺失可导致小鼠部分胚胎致死和生殖细胞缺陷[12]。此外,miR-290-295簇还可促进细胞G1期向S转换,加速细胞增殖,在防止小鼠胚胎干细胞凋亡中发挥保护作用[13]。然而,miR-290-5p在缺氧诱导的心肌细胞损伤中的作用尚未可知。本研究显示缺氧诱导后心肌细胞miR-290-5p的表达显著降低,而咪唑安定预处理可提高缺氧诱导下心肌细胞miR-290-5p表达水平。进一步功能分析显示,过表达miR-290-5p可提高缺氧诱导下心肌细胞存活率,降低缺氧诱导的心肌细胞凋亡,并升高促增殖蛋白CyclinD1、降低促凋亡蛋白Cleaved-caspase-3的表达水平,与MID预处理对缺氧诱导的心肌细胞损伤的保护作用相同。此外,本研究发现抑制miR-290-5p表达还可部分逆转MID对缺氧诱导的心肌细胞和存活抑制的影响。以上研究说明上调miR-290-5p是MID对缺氧诱导的心肌细胞损伤发挥保护作用的重要机制。
PI3K/AKT信号通路的激活在缺氧缺血损伤后心脏保护中起着关键作用[14-15]。研究发现,miR-181c、miR-335等多种miRNA通过调控PI3K/AKT信号通路改善心肌缺血复氧损伤[16-17]。本研究显示MID预处理可减轻缺氧诱导对PI3K/AKT信号通路的抑制作用,而抑制miR-290-5p表达则部分逆转MID对缺氧诱导的心肌细胞PI3K/AKT信号通路活化的影响。提示MID通过上调miR-290-5p激活I3K/AKT信号通路进而对缺氧诱导的心肌细胞损伤具有保护作用。
综上所述,本研究证实MID通过上调miR-290-5p可减轻缺氧诱导的心肌细胞凋亡,促进心肌细胞存活,对缺氧诱导的心肌细胞损伤具有保护作用,其机制与激活PI3K/AKT信号通路有关,这为MID在临床预防缺氧诱导的心肌细胞损伤中应用奠定理论基础。

