肠球菌耐药率与抗菌药物使用强度相关性研究*
杨 涛,陆 怡,邓卫平,陆惠平△
(1.上海市浦东医院药剂科,上海201399;2.上海市浦东医院检验科,上海201399)
抗菌药物合理使用常被视为预防与控制多重耐药菌感染的核心措施之一[1]。但抗菌药物的使用和细菌耐药性之间的关系极复杂[2]。细菌耐药性的变迁除与细菌及药物自身的特点相关外,还可能与某种药物或某种药物的用量等因素相关[3-5]。肠球菌属条件致病菌,可引起泌尿系统感染、肺部感染、菌血症、腹腔感染、伤口感染等[6]。肠球菌中的粪肠球菌(EFA)和屎肠球菌(EFM)是医院分离的革兰阳性球菌主要菌种[7],其耐药性受到了越来越多的重视[8]。目前关于EFA和EFM耐药性的研究主要集中在耐药机制、治疗及管理方面[8-10]。本研究中拟从抗菌药物使用强度(AUD)与细菌耐药性相关性的角度,初步探讨医院层面AUD与EFA和EFM耐药性的相关性,为临床合理用药提供依据。现报道如下。
1 资料与方法
1.1 菌株来源及分析方法
选取医院2017年至2019年住院患者标本中培养、分离的EFA和EFM。采用Vitek compact 2全自动微生物分析系统及配套的药敏卡进行菌种鉴定及临床常用抗菌药物的最低抑菌浓度(MIC)检测。使用细菌耐药监测软件WHONET 5.6统计耐药率,自动剔除同一患者相同标本检出的相同细菌、门诊患者样品及外院送检样品。质控菌株为ATCC 29212。
1.2 AUD计算
以季度为单位,采用医院信息系统(HIS)统计相关药物的抗菌药物使用频度(DDDs)及住院总天数,AUD=DDDs/住院总天数×100。
1.3 统计学处理
采用SPSS 25.0统计学软件分析。采用Spearman秩相关检验,分析两者的相关性;相关系数(r)为正值表示正相关,负值表示负相关;绝对值0.8~1.0为极强相关,0.6~0.8为强相关,0.4~0.6为中等程度相关,0.2~0.4为弱相关,0~0.2为极弱相关或无相关[11]。P<0.05为差异有统计学意义。
2 结果
2.1 病原菌检出情况
2017年至2019年,我院病原菌(细菌)检出量呈逐年上升趋势;EFA的3年检出率较平稳,平均为5.16%,样本来源主要为尿液(ur)、血液(bl)、胆汁(bi)和分泌物(se);EFM 3年平均检出率为4.98%,样本来源主要为ur、bl、引流液(dn)和导尿管尿(uc)等。详见表1。
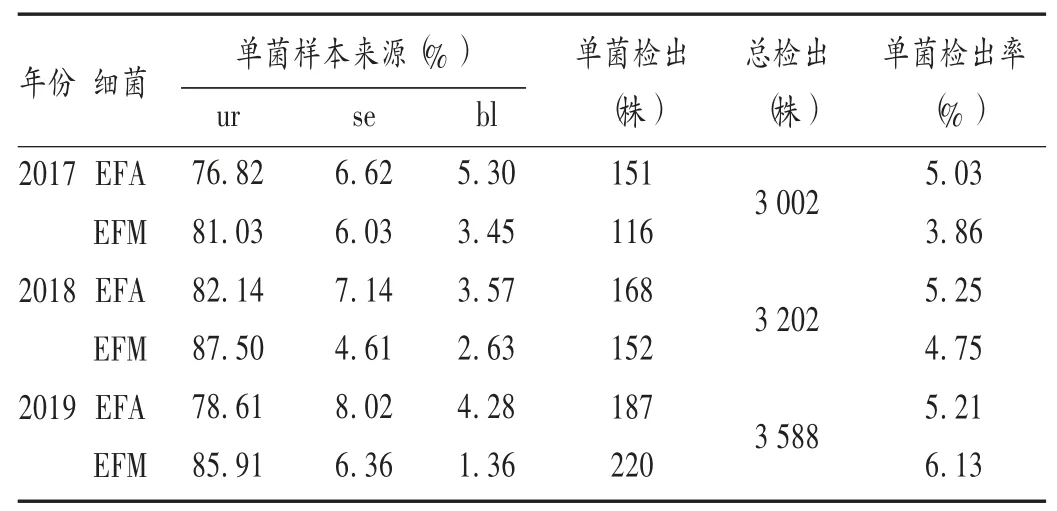
表1 粪肠球菌和屎肠球菌检出情况Tab.1 Detection of EFA and EFM
2.2 我院与上海地区三级医院EFA和EFM的耐药性变迁对比
2017年至2019年,我院EFA与EFM对相关药物的耐药率和趋势变迁与上海地区三级医院整体情况[12-13]基本一致。详见表2。
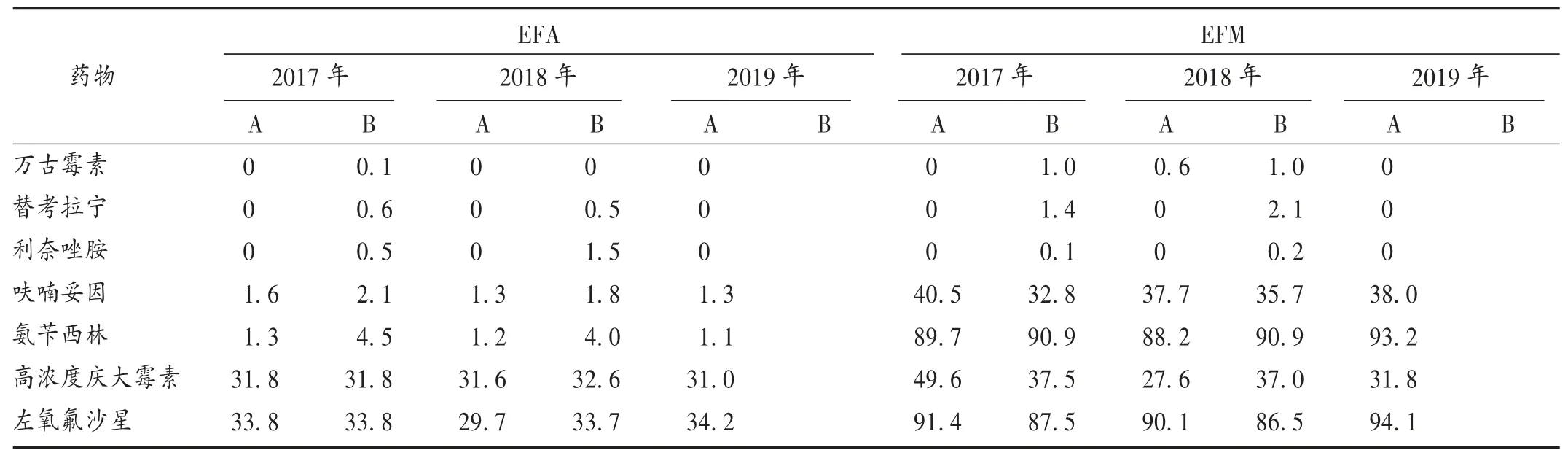
表2 我院与上海地区粪肠球菌和屎肠球菌的耐药率变迁对比(%)Tab.2 Comparison of drug resistance rate of EFA and EFM between our hospital and Shanghai(%)
2.3 EFA的耐药性变迁
2017年至2019年,我院均未检测出对利奈唑胺、替加环素和万古霉素耐药的EFA;EFA对氨苄西林和呋喃妥因的耐药率均小于5%,对青霉素G的耐药率均小于30%;对高浓度庆大霉素的耐药率基本大于30%,特别是对四环素的耐药率最高(超过90%)。详见表3。
2.4 EFM的耐药性变迁
2017年至2019年,我院均未检测出对利奈唑胺和替加环素耐药的EFM,但在2018年第4季度曾检出过少量对万古霉素耐药的EFM。EFM对其余受试药物表现出高度的耐药性,并且普遍高于EFA。详见表4。
2.5 常用抗菌药物AUD
2017年至2019年,我院头孢菌素类及喹诺酮类抗菌药物AUD相对较高,碳青霉烯类及β-内酰胺/β-内酰胺酶抑制剂复方制剂等被我院列为特殊使用级抗菌药物,AUD相对较低。详见表5。
2.6 抗菌药物AUD与EFA和EFM耐药性的相关性
复方新诺明的AUD与EFA对高浓度链霉素,莫西沙星的AUD与EFA对四环素,头孢曲松的AUD与EFA对莫西沙星的耐药率呈不同程度的相关性(见表6)。头孢西丁、头孢他啶、头孢哌酮舒巴坦、头孢曲松、复方新诺明、比阿培南和美罗培南的AUD分别与EFM对不同药物的耐药率相关(见表7)。
3 讨论
2017年至2019年,我院EFA和EFM的样本来源、检出率及耐药特点和2019年中国细菌耐药监测网(CHINET)相关报告基本一致[7],与世界范围内EFA和EFM的特征趋势类似[14-15]。EFA和EFM对利奈唑胺、替加环素和万古霉素均高度敏感,上述药物均可作为两种细菌所致感染的治疗药物。另外,EFA对呋喃妥因和青霉素G也表现出较高的敏感性,可酌情根据药敏试验结果或经验使用。
EFA和EFM耐药率的变迁和我院常用抗菌药物AUD的变化存在关联。莫西沙星的AUD分别与EFA对四环素的耐药率呈显著正相关,即莫西沙星的大量使用可能导致对相关抗菌药物产生耐药;相反,加大复方新诺明的用量可能降低EFA对高浓度链霉素的耐药。对于EFM,头孢西丁和头孢哌酮舒巴坦的大量使用可能导致EFM对相关抗菌药物的耐药;而增加头孢他啶、头孢曲松、复方新诺明、比阿培南和美罗培南的用量,可能降低EFM对相关抗菌药物的耐药率。

表3 粪肠球菌的耐药率变迁(%)Tab.3 The drug resistance changes of EFA(%)
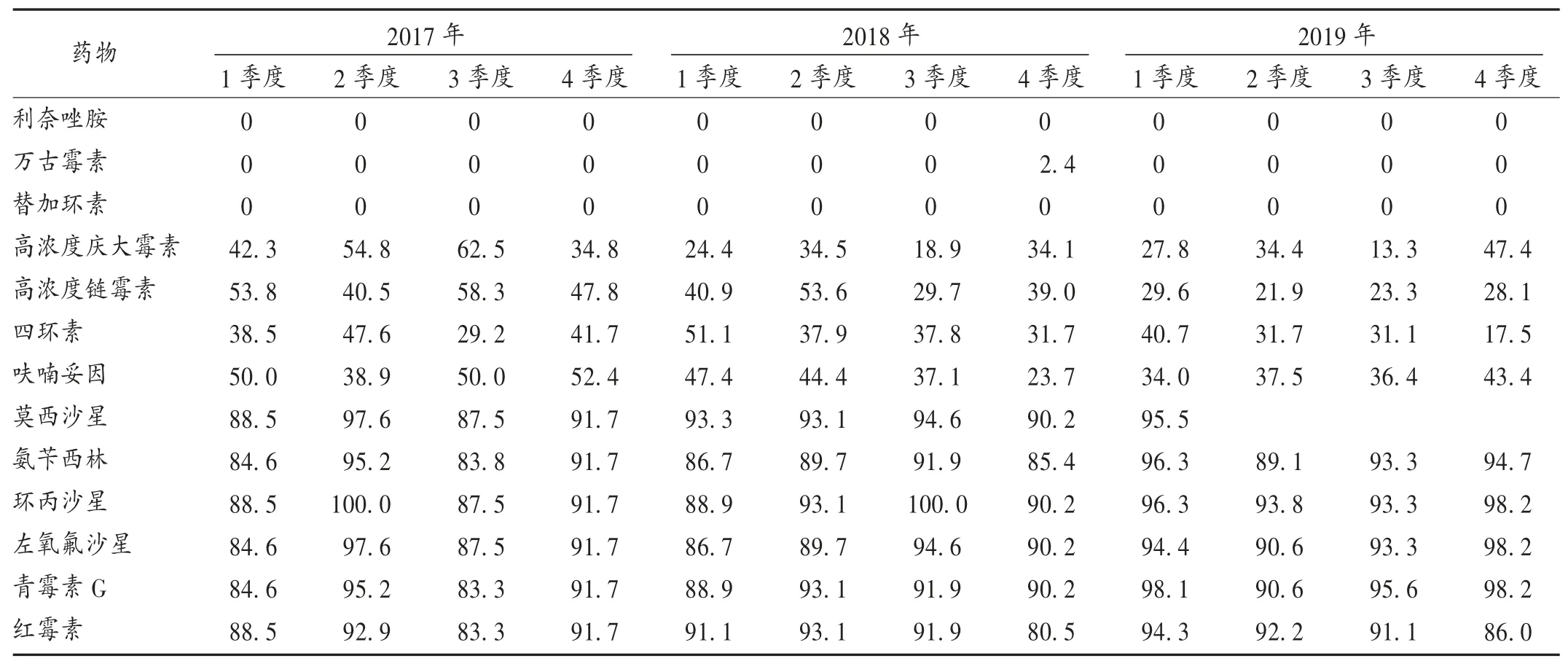
表4 屎肠球菌的耐药率变迁(%)Tab.4 The drug resistance changes of EFM(%)
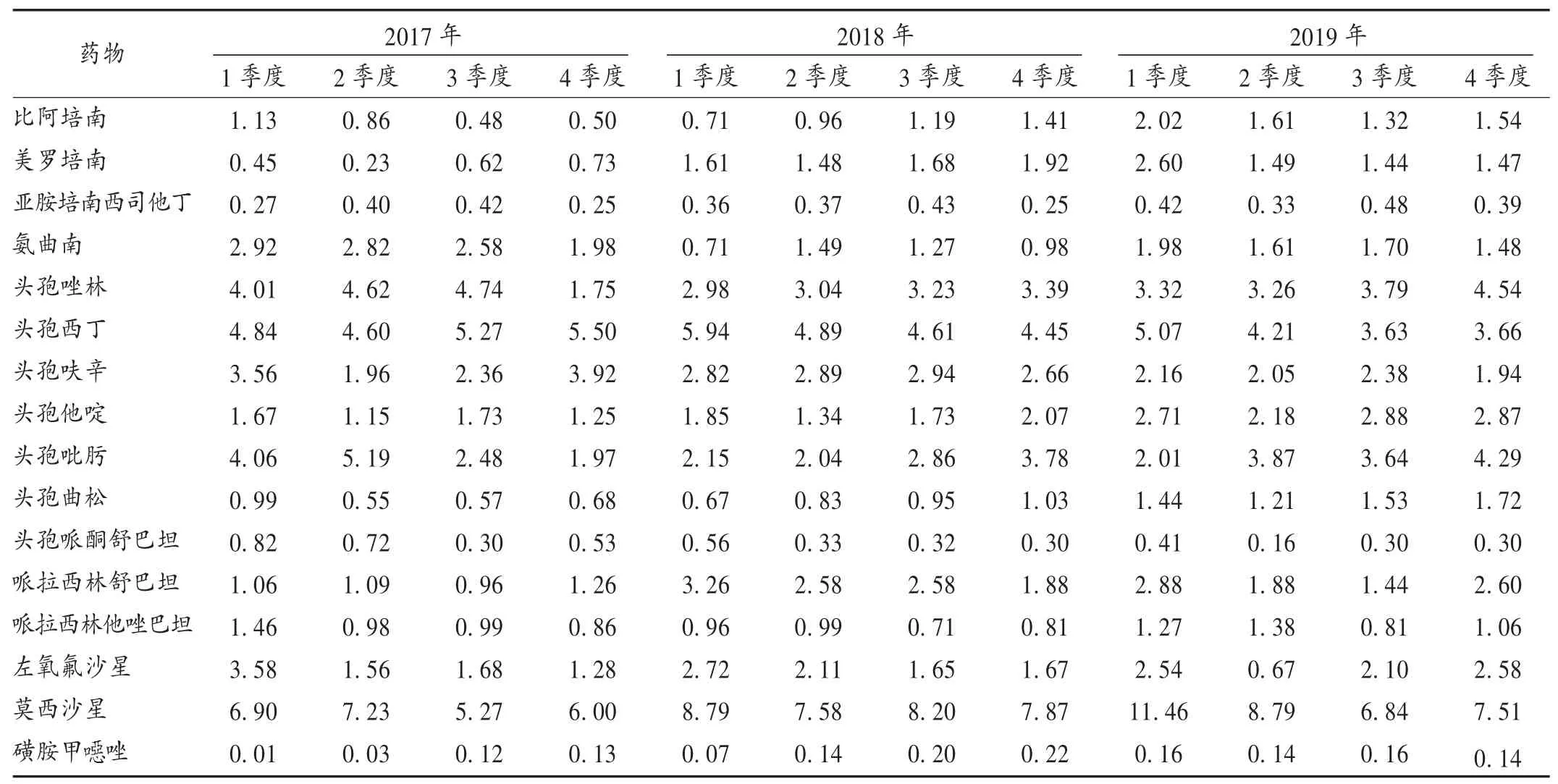
表5 常用抗菌药物使用强度Tab.5 AUD of commonly used antibiotics

表6 抗菌药物使用强度与粪肠球菌耐药率的相关性Tab.6 Correlation between AUD of antibiotics and resistance rate of EFA
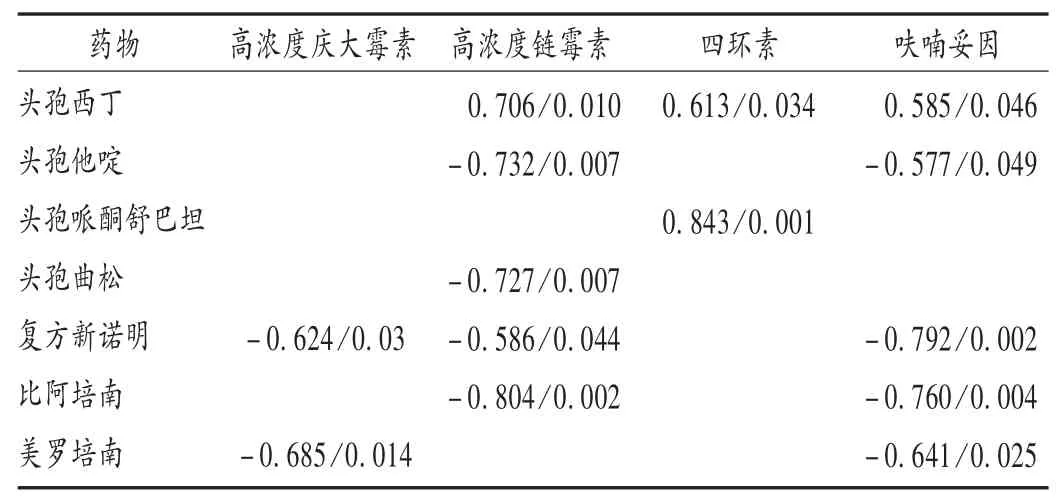
表7 抗菌药物使用强度与屎肠球菌耐药率的相关性(r值/P值)Tab.7 Correlation between AUD of antibiotics and resistance rate of EFM(r/P)
EFA和EFM的耐药特点在一些方面存在显著差异,但其耐药机制都可归为3种,即天然耐药、获得性耐药和细菌耐受[16-17]。天然耐药和细菌种群共同表达的产物有关;获得性耐药常与可动遗传因子在细菌间的平行交换有关;而细菌耐受可理解为细菌的MIC不变的情况下,能在有效杀菌药物浓度下存活,但不能增殖[18]。AUD对EFM的相关耐药率存在负相关的抗菌药物基本为β-内酰胺类的杀菌剂,增加这类抗菌药物的用量,能降低EFM对相关药物的耐药性,这可能与较高浓度的抗菌药物可防止抗性突变体的扩增并破坏耐受性/耐药性循环有关[19]。
本研究从宏观角度考察了抗菌药物AUD和细菌耐药率的相关性,其背后的机制还有待进一步探讨。另外,本研究是单中心研究,未纳入同地区其他医院的相关数据,不足之处有待在进一步研究弥补。在临床实践中,需要结合病原菌的耐药情况、其他抗菌药物使用情况等,综合考虑抗菌药物使用对细菌耐药的影响,可尝试通过适当调整剂量或品种[4]来控制耐药菌的产生和蔓延。

