柚皮苷对DSS诱导结肠炎小鼠肠道菌群的影响*
张伟东 徐 阳 郑 路 蒋 溶 周子娟 王靖宇 董建一
(1. 大连医科大学附属第一医院,大连 116044)(2. 大连医科大学附属第二医院,大连 116044)(3. 大连医科大学实验动物中心,大连 116044)
炎症性肠病(Inflammatory bowel disease,IBD)是一种病因尚未明确的慢性非特异性肠道炎症性疾病,包括溃疡性结肠炎和克罗恩病[1],主要表现为反复发作的腹痛、腹泻及黏液脓血便,同时可合并包括肠道狭窄、中毒性巨结肠、穿孔、出血等。近些年来,全球IBD发病率不断提高[2],据Dubinsky等[3]统计,全球已超过680万患者患有IBD,中国患病率也不断提高,该病给患者带来极大负担。目前,大多学者认为该病与遗传因素[4]、环境因素[5]、免疫失衡和肠道微生态[6]有关,但具体病因尚未清楚。研究表明肠道菌群在IBD发病中起着关键作用,正常人体的肠道菌群主要包括:厚壁菌门(Furmicutes)、拟杆菌门(Bacteroidetes)、变形菌门(Proteobacteria)、放线菌(Actinobacteria)等。其中厚壁菌门和拟杆菌门是共生菌群的主要成员,在健康组中含量最多。Zheng等[7]研究显示,IBD患者肠道菌群出现明显菌群多样性紊乱,表现为有害菌群如拟杆菌门明显增加,有益菌如厚壁菌门明显降低。柚皮苷(Naringin,NG)是葡萄柚皮中含量最丰富的天然黄酮类化合物[8]。Yu等[10]报道,NG不仅具有抗炎、抗氧化、抗凋亡、抗应激等生物活性,还具有抗菌作用。本研究证实NG显著影响IBD小鼠模型的肠道菌群,并通过PCR-DGGE技术对菌群进行了分析,探究其可能的机制。
1 材料和方法
1.1 材料
1.1.1实验动物:15只SPF级C57BL/6雄性小鼠,6~8周龄,体质量18~22 g,购自辽宁长生生物科技有限公司,实验动物生产许可证编号:SCXK(辽)2015-0001。实验动物饲养于大连医科大学实验动物中心,实验动物使用许可号:SYXK(辽)2018-0007。小鼠随机分为正常组(对照组)、模型组(IBD模型组)和NG组(NG药物干预组),每组5只。正常组:正常饮水;其余两组自由饮用4%(m/v)DSS水溶液7 d,建立IBD模型;NG组小鼠在自由饮用4%(m/v)DSS水溶液的第2天灌胃给予剂量为40 mg/kg的NG水溶液,1 mL/只,连续灌喂7 d。第9天处死,留取结肠及肠内容物。本研究涉及实验已通过大连医科大学伦理委员会审批,审批号:AEE20046。
1.1.2试剂与仪器:NG(北京索莱宝科技有限公司,HPLC≥98%,货号 SN8030);柳氮黄吡啶(SASP,天津金耀集团有限公司);硫酸葡聚糖钠(DSS,大连美仑生物技术有限公司,货号 MB5535);磷酸化核因子-κB-p65(p-NF-κB-p65)抗体和GAPDH抗体(万类生物科技有限公司),Bcl-2抗体(Abcam,货号 ab59348);E.Z.N.A.® Stool DNA kit(Omega,货号 D4015);RIPA 裂解液和Bradford 蛋白浓度试剂盒(上海碧云天生物技术有限公司);2×Easytaq PCR SuperMix(+dye)和通用引物515F和806R[宝生物工程(大连)有限公司,货号 AS111-14];引物序列为: 515F (5′-3′): GTGCCAGCMGCCGCGGT AA;806R (5′-3′): GGACTACNNGGGTAT CTAAT。主要仪器:Gel DocTM EZ 成像仪(Bio-RAD),紫外分光光度计(Nanodrop2000)。
1.2 方法
1.2.1IBD活动程度观察评估:每天记录小鼠体质量、精神状态、毛发色泽、饮水量、采食量,并收集新鲜粪便,加入粪便DNA保护剂于-80 ℃冰箱保存。按表1标准进行疾病活动指数(DAI)评分。小鼠处死后,沿腹正中线剖开小鼠腹腔,分离盲肠至直肠全段结肠,测量长度,并进行拍照,观察炎症损伤状况。使用无菌磷酸盐缓冲液(PBS)清洗肠内容物后统一取同一部位1 cm左右远端结肠组织固定于4%甲醛中、石蜡包埋切片,苏木素-伊红(HE)染色观察,并拍照分析结肠的病理学变化(见图2)。

表1 疾病活动指数评分标准
1.2.2DNA提取、扩增与检测:严格遵循E.Z.N.A.®Stool DNA kit试剂盒说明书进行DNA提取操作。用PCR扩增肠道菌群多样性,并用16s rDNA基因V3区特异序列进行PCR-DGGE分析。引物序列为:上游引物(338F)CGCCCG GGGCGC GCCCC GGGCGG GGCGGG GGCACG GGGGGC CTACGG GAGGCA GCAG和下游引物(518R)ATTACCGCGGCTGCTGG。反应体系总体积为50 μL:包括25 μL 2×Easytaq PCR SuperMix(+dye),1 μL 338F(10 pmol/μL),1 μL 518R (10 pmol/μL),3 μL DNA模板和20 μL ddH2O。反应条件为:93 ℃持续预热,93 ℃变性5 min,93 ℃、30 s,54.5 ℃、30 s,72 ℃、30 s,30次持续循环,72 ℃、5 min,4 ℃、10 min。反应完成后,通过1%琼脂糖凝胶电泳对扩增PCR产物进行检测,并保存在-20 ℃下备用。
1.2.3免疫印迹检测:从实验小鼠分离结肠组织,并立即保存在液氮中。总蛋白提取试剂盒(KeyGen Biotech)分离总蛋白。Western blot实验将蛋白质转移到硝酸纤维素滤膜上,并在4°C轻轻摇动下,用相应的抗体孵育过夜,洗膜后二抗37 ℃孵育2 h,使用多光谱成像系统(UVP)检测和定量条带。
1.2.4变性梯度凝胶电泳(PCR-DGGE):严格按操作步骤配胶、灌胶、点样、电泳、染色和凝胶成像进行分析,凝胶切割后回收纯化并测序得到序列后与NCBI数据库比对分析。
1.3 统计方法

2 结果
2.1 疾病症状及疾病活动程度
各组小鼠体质量变化如图1A所示:对照组小鼠一般情况表现良好,无明显变化。模型组小鼠精神活动欠佳,反应不灵活,采用4%DSS诱导的动物均在第3天出现腹泻、血便现象。第3天开始,模型组小鼠体质量的变化和正常组比较,明显下降(P<0.01,t=5.21),第7天起差异最为显著(P<0.05,t=12.89)。NG组小鼠在造模后第3天,体质量和正常组相比明显降低(P<0.05,t=7.61);第6天时,小鼠体质量与模型组相比,显著回升(P<0.05,t=15.85)。各组小鼠DAI评分结果:第3天,与正常组相比,模型组和干预组给予4%DSS并自由饮水,小鼠DAI评分进行性升高(aP<0.05,at=12.90;bP<0.05,bt=12.51);与模型组相比,第6天NG组小鼠DAI评分显著降低(abP<0.05,abt=15.85),见表2及图1B。这一结果说明,4%DSS诱导的IBD小鼠模型第3天起症状显著,而NG组小鼠IBD在NG的干预下得到缓解。

表2 DAI评分
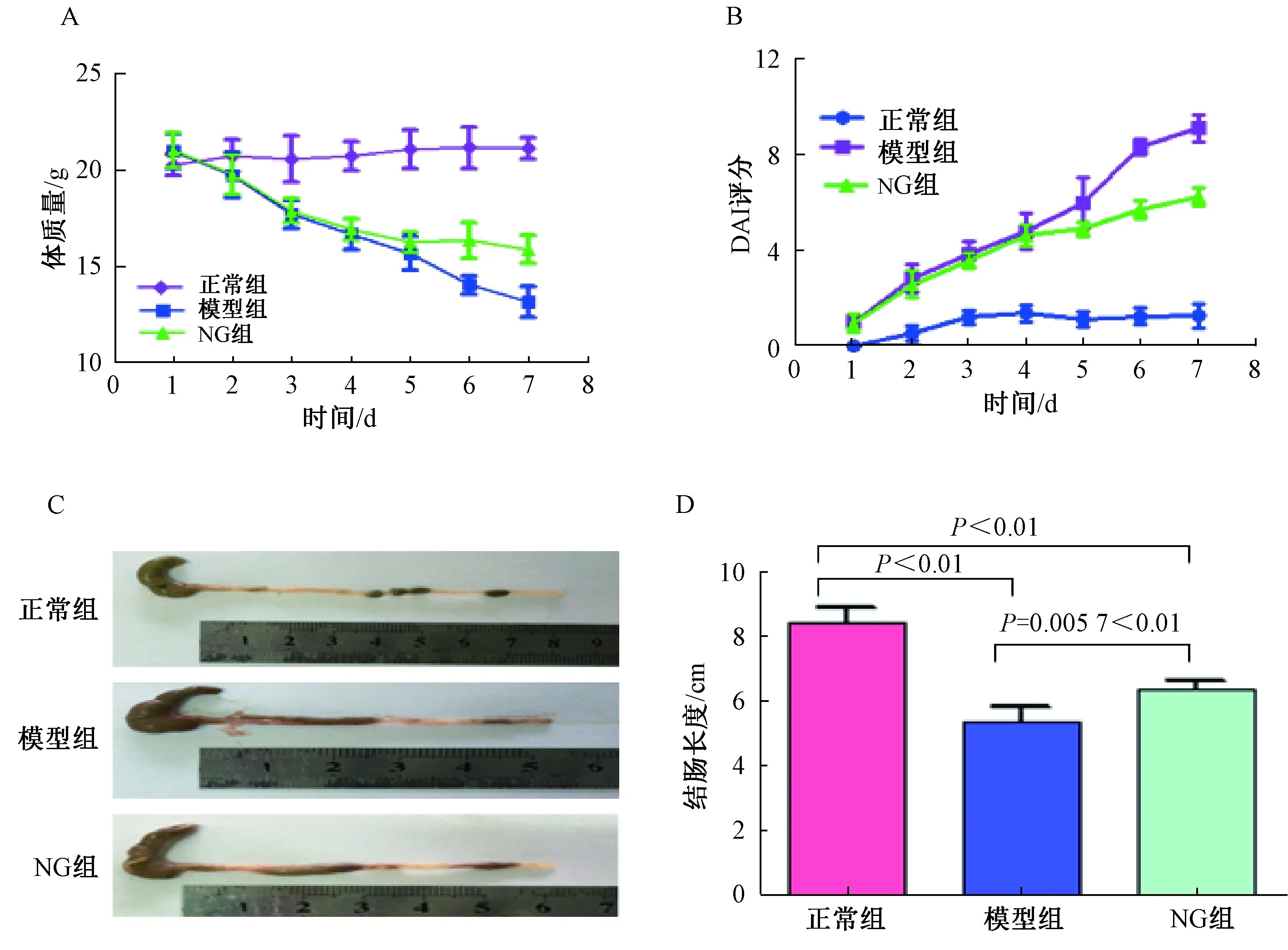
图1 各组小鼠疾病症状及疾病活动程度
2.2 结肠改变情况及HE染色
第9天,将小鼠处死,观察结肠大体形态。正常组小鼠结肠外观光滑、弹性好及肠内容物正常;其它两组小鼠结肠明显红肿、肠黏膜可见有糜烂并肠腔内容物伴有黏液脓血。结肠长度变化如图1C~1D所示:与正常组相比,模型组结肠长度显著缩短(P<0.0001,t=10.49);与模型组相比,NG组结肠长度缩短得到了抑制(P=0.0057<0.001,t=3.74)。图2所示:光镜下可见,正常组小鼠结肠黏膜组织完好,未见炎性细胞浸润。模型组黏膜组织严重破坏,原有结构消失,并在黏膜层中存有大量炎性细胞浸润。NG组黏膜下层炎症细胞浸润较轻,可见点状黏膜侵蚀。

图2 结肠HE染色
2.3 各组小鼠炎症蛋白和凋亡蛋白的检测
正常组和NG组小鼠的结肠组织结构较为完整,能够清楚的看到肠上皮细胞的形态;模型组结肠组织出现大量炎性细胞浸润等病理现象。与正常组相比,模型组小鼠结肠组织中,p-NF-κB-p65蛋白水平显著增加(P<0.01,t=4.52),Bcl-2蛋白水平显著降低(P<0.01,t=5.826)。与NG组相比,模型组p-NF-κB-p65蛋白水平显著减少(P<0.01,t=2.75),Bcl-2蛋白水平显著降低(P<0.01,t=3.28),见图3A~3B。这一结果表明,DSS诱导的IBD小鼠NF-κB炎性介质生成增多及Bcl-2细胞凋亡水平显著下降可能是与其恶化程度相关,NG组能够抑制p-NF-κB-p65,促进Bcl-2水平回升,对IBD有治疗作用。
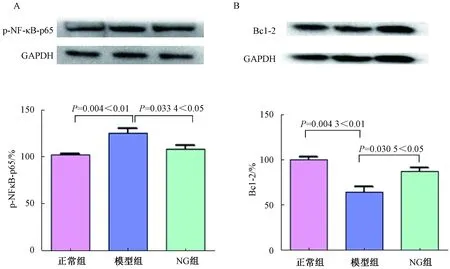
图3 各组小鼠炎症蛋白和凋亡蛋白的检测
2.4 肠道菌群
细菌16s DNA V3区的PCR-DGGE电泳结果如图4A所示,三组菌群丰富度无显著差异。利用Quantity One对DGGE图谱数字化处理,然后对各泳道条带通过非加权成对算术平均算法(UPGMA)开展聚类分析。图4B可见,模型组样本4~5聚成一簇,正常组和NG组大致聚为一簇,模型组、对照组及NG组菌群结构有差异。对三组小鼠PCR-DGGE图谱中变化较大的条带(图4A箭头所示)进行切胶测序得出表3的结果:与正常组相比,模型组中HungatellahathewayiWAL-18680菌株含量增多;与模型组相比,NG组MarvinbryantiaformatexigensDSM 14469、PrevotellaoryzaeDSM 17970及HelicobacterpullorumMIT 98-5489含量增多;模型组Muribaculumintestinale相较于正常组和NG组含量增多。

表3 DGGE条带切胶回收后测序比对结果

图4 肠道菌群
3 讨论
本研究探讨了NG对小鼠IBD的作用及其机制。根据Li等[11]和Dong等[12]报道,NG作为中药对多个系统有保护作用,并且对小鼠IBD有缓解作用。本研究证实,NG改善IBD细胞浸润,抑制细胞凋亡,因此证实NG对DSS诱导的IBD具有治疗作用。近年来,随着对肠道菌群研究的认识,发现肠道菌群平衡对肠黏膜保护起着重要作用[13]。改善肠道菌群多样性,减少肠道致病菌拟杆菌门、变形菌门等丰富度,增加隶属于厚壁菌门的健康菌乳酸杆菌属(Lactobaillus)等丰富度。基于此,通过PCR-DGGE技术检测NG在DSS诱导小鼠IBD模型的肠道菌群的作用,结果显示,模型组拟杆菌门致病菌Muribaculumintestinale相对于其他两组明显增多,MarvinbryantiaformatexigensDSM 14469隶属于健康菌厚壁菌门,相较于模型组,饮用NG水溶液后,菌群丰富度明显提高,这表明该化合物作为天然黄酮类化合物,具有抑制致病菌,促进健康菌丰富度,进而改善小鼠IBD,为临床药物研发以及IBD临床治疗提供新治疗思路与科学参考。本研究发现NG对IBD肠道菌群变化的影响,但该化合物与菌群之间以及菌群与IBD之间作用机制尚未探索,未来将继续探讨菌群变化对IBD影响的具体机制,为IBD临床治疗贡献力量。

