上调脂蛋白酯酶基因对精神分裂症大鼠的干预效果及作用机制研究
佘 意,余军军,吕 媛
(1.湖南省第二人民医院精神科,中国 长沙 410007;2.湖南师范大学医学院,分子流行病学湖南省重点实验室,中国 长沙 410013)
精神分裂症属于一种较为常见的精神疾病,该病以精神活动与环境不协调为主要特征表现,患者多存在思维、知觉、情感及行为障碍,目前临床上认为遗传学变异、表现遗传突变、环境因素相互作用下诱导精神分裂症的发生,但其具体作用机制尚不完全明确[1]。研究表明,脂蛋白脂酶(LPL)为甘油三酯水解过程中的一种关键酶,其广泛存在于大脑组织中的认知、记忆、学习等区域中,属于血脂异常、冠心病、阿尔兹海默病的高危影响因素之一[2]。基于上述研究背景,本文研究上调LPL基因对精神分裂症大鼠的干预效果及作用机制,以明确LPL基因与精神分裂症的作用关系,为临床应用提供参考。
1 材料与方法
1.1 材料
选取60只SPF级SD雄性大鼠,8~12周龄,购自慕恩(广州)生物科技有限公司,动物许可证号:SYXK(粤)2020-0225,体重185~220 g,所有大鼠均在相对湿度为30%~50%、温度为(23.8±1.5)℃的环境下预喂养7 d,每日光照12 h,分笼饲养。本研究获我院伦理委员会批准,实验操作严格按照动物实验伦理要求相关规定进行。
主要试剂:LPL载体构建及慢病毒载体滴定由上海吉玛公司完成;MK801购自美国Sigma公司;小鼠抗大鼠CREB抗体、兔抗大鼠p-CREB抗体、兔抗人BDNF抗体、兔抗大鼠TrkB抗体、小鼠抗大鼠p-TrkB抗体购自Cell Signaling Technology。
1.2 方法
1.2.1 LPL载体构建 使用GenBank查找序列获得LPL基因序列,构建LPL下调转染质粒、LPL上调转染质粒,由上海吉玛公司设计并合成,并做慢病毒滴度测定(病毒滴度为1×1012TU·L-1)。LPL引物序列:上游:5’-CTGTGTGGGACTTATTGAGGTGGT-3’,下游:5’-ACTGATGTAGTGTGTGGCTGTTGA-3’;LPL引物序列:上游:5’-CGCTTCTTTGCCAACATCGT-3’,下游:5’-ACACTCCATGCTGTCATCTTGA-3’。
1.2.2 分组及建模 将所选取的60只大鼠随机分为正常组、模型组、下调组、上调组各15只,模型组、下调组、上调组大鼠参照房茂胜等[3]研究中精神分裂症模型的建立方法构建精神分裂症大鼠模型,取MK801,在使用前先稀释为0.1 g·L-1的注射药液,在恒温状态下水浴震荡20 min,在每日9:00~10:00将0.3 μg·g-1的MK801注射于大鼠左或者右下侧腹腔略靠近外科1/3处(左、右侧每日交替),连续注射1周。正常组注射等剂量的生理盐水。
1.2.3 LPL慢病毒载体滴定 建模成功后在下调组大鼠海马组织注射含10 μL LPL的下调质粒慢病毒悬液,上调组大鼠海马组织注射含10 μL LPL的上调质粒慢病毒悬液。正常组、模型组大鼠注射等量生理盐水。7 d后观察大鼠变化。
1.2.4 LPL慢病毒载体滴定效率鉴定 在LPL慢病毒载体滴定完成7 d后随机取各组中3只大鼠使用5%苯巴比妥做常规腹腔注射麻醉后处死,迅速取海马组织,采用实时荧光定量PCR法检测LPL慢病毒载体滴定效率,提取并鉴定海马组织总RNA含量、纯度,使用Takara逆转录试剂盒行逆转录处理后获得cDNA,采用Primer 5.0软件设计引物序列。以U6为内参照,LPL上游序列5’-AGCTGTGCCTGTGATTGTAGCATTC-3’,下游序列:5’-AACATGTGAGTAAGGCTGCCACTAG-3’;U6上游序列5’-GCTTCGGCAGCACATATACTAAAA-3’,下游序列5’-CGCTTCACGAATTTGCGTGTCAT-3’。
1.2.5 刻板行为评分 依照Sams Dodd和Hoffman标准[4]对各组大鼠进行刻板行为评分,10 min·次-1,观察60 min,共6次,评分标准:0分:大鼠静止不动,无活动或者几乎不活动;1分:大鼠正常活动,偶尔有向前的运动;2分:大鼠活动并伴随着反复向前探索现象;3分:大鼠活动并持续向前探索;4分:大鼠存在重复旋转、抬头、摇头表现;5分:大鼠出现快速摇头、转圈或者头的背腹运动。
1.2.6 共计失调评分 对各组大鼠进行共济失调评分[5],10 min·次-1,观察60 min,共6次,评分标准:0分:大鼠协调运动;1分:大鼠存在轻度摇晃现象,摇摆运动,竖立不倒;2分:大鼠存在中度的不协调运动,偶尔跌倒;3分:大鼠无力支撑体重,爬行运动;4分:大鼠无运动,躺向一边。
1.2.7 水迷宫试验 采用水迷宫试验评价大鼠平均逃避潜伏期、穿越原平台位置次数连续测量3次,取均值。
1.2.8 样本采集 在各组大鼠上述操作完成后,使用5%苯巴比妥做常规腹腔注射麻醉后处死,立即取海马组织,分为均匀3等份,其中1等份做组织切片行病理组织学观察,另外两份在液氮中保存用于后续指标检测。
1.2.9 病理组织学观察 取所制备的海马组织,固定1 d后,使用酒精脱水、二甲苯透明处理后做常规石蜡包埋,做5 μm切片,做HE染色,树胶封片后使用光学显微镜观察大鼠海马组织病理变化。
1.2.10 Glu-DA神经递质系统指标检测 取1等份液氮中所保存的海马组织,采用分光光度计检测海马组织中NO活性和MDA含量。采用实时荧光定量PCR法检测海马组织中nNOS mRNA表达量;采用HPLC-ECD法测定海马组织中DA和Glu水平。
1.2.11 海马组织CREB/BDNF/TrkB信号通路蛋白表达量检测 采用Western blot法检测大鼠海马组织CREB/BDNF/TrkB信号通路蛋白CREB,p-CREB,BDNF,TrkB及p-TrkB表达量,取1等份液氮中所保存的海马组织,将所制备的海马组织做10 000×g离心处理10 min,提取上清液,BCA进行蛋白定量检测,DAB显色,定量分析蛋白表达情况,内参为GAPDH。
1.3 统计学处理
采用SPSS 20.0统计软件进行处理。计量资料采用均数±标准差描述,多组间比较采用完全随机设计方差分析,P≤0.05为差异具有统计学意义。
2 结果
2.1 LPL基因转染效率鉴定
如表1所示,与正常组相比,模型组、下调组LPL基因表达量降低,上调组LPL基因表达量升高,差异具有统计学意义(P<0.05)。

表1 LPL基因转染效率鉴定
2.2 各组大鼠刻板行为评分、共计失调评分、平均逃避潜伏期、穿越原平台位置次数比较
如表2所示,与正常组相比,模型组、下调组、上调组刻板行为评分、共计失调评分、平均逃避潜伏期升高,穿越原平台位置次数降低,差异具有统计学意义(P<0.05);与模型组、下调组相比,上调组刻板行为评分、共计失调评分、平均逃避潜伏期降低,穿越原平台位置次数升高,差异具有统计学意义(P<0.05)。

表2 各组大鼠刻板行为评分、共计失调评分、平均逃避潜伏期、穿越原平台位置次数比较
2.3 病理组织学观察
如图1所示,正常组大鼠海马组织结构正常,海马神经元细胞(箭头处)正常;模型组大鼠海马神经元变性,细胞核固缩(箭头处),神经元细胞层减少;下调组大鼠海马神经元变性,存在较为明显的细胞核固缩现象(箭头处),神经元细胞层明显减少。上调组大鼠存在局灶性的神经元变性现象,少量细胞核固缩(箭头处),组织学正常。
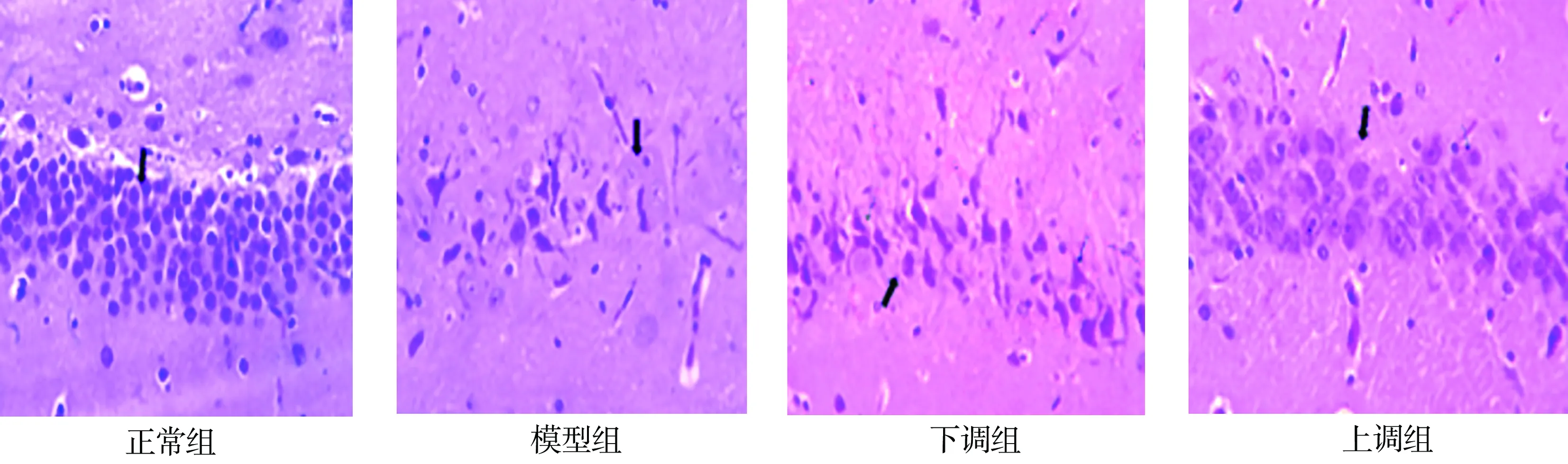
图1 病理组织学观察(HE×400)Fig. 1 Histopathological observation (HE×400)
2.4 各组大鼠Glu-DA神经递质系统指标比较
如表3所示,与正常组相比,模型组、下调组、上调组NO活性、MDA含量、nNOS mRNA、DA水平升高,Glu水平降低,差异具有统计学意义(P<0.05);与模型组、下调组相比,上调组NO活性、MDA含量、nNOS mRNA、DA水平降低,Glu水平升高,差异具有统计学意义(P<0.05)。

表3 各组大鼠Glu-DA神经递质系统指标比较
2.5 各组大鼠海马组织中CREB/BDNF/TrkB信号通路蛋白表达量比较
如表4所示,与正常组相比,模型组、下调组、上调组的CREB,p-CREB,BDNF,TrkB及p-TrkB蛋白表达量降低,差异具有统计学意义(P<0.05);与模型组、下调组相比,上调组的CREB,p-CREB,BDNF,TrkB及p-TrkB蛋白表达量升高,差异具有统计学意义(P<0.05)。

表4 各组大鼠海马组织中CREB/BDNF/TrkB信号通路蛋白表达量比较

图2 CREB/BDNF/TrkB信号通路蛋白表达WB图 Fig. 2 WB graph of protein expression of CREB/BDNF/TrkB signaling pathway
3 讨论
目前临床上对于精神分裂症的具体发病机制仍处于不断研究中,尚不完全明确,认为此病的发生与神经细胞膜相关,神经细胞膜主要包括花生四烯酸、二十二碳六烯酸,在神经发育的过程中多不饱和脂肪酸水平降低可增强血清、脑组织中PLA2的活性,进而诱导精神分裂症的发生。
LPL基因定位于染色体8p22上,其长度大约为36 000 bp,由9个内含子和10个外显子所构成,在脊髓、大脑、外周神经中广泛存在,当大脑损伤或者周围神经阻滞供血被阻断后LPL含量显著升高,修复损伤的神经组织[6-8]。临床表明精神分裂症的发生与人染色体8p22区域相关,而LPL基因同样定位于染色体8p22上,因此推测LPL基因与精神分裂症可能相关。但目前临床上对于LPL基因与精神分裂症的关系研究较少,仅有邢洪源等[2]发现LPL基因mRNA在精神分裂症模型大鼠脑组织中的低表达。基于此背景,本文推测LPL基因可能作为精神分裂症的靶点。上调和下调LPL基因对精神分裂症动物模型的影响试验结果显示,LPL基因与精神分裂症相关,上调LPL基因可阻止海马组织进一步受损,抑制疾病进展。
CREB/BDNF/TrkB信号通路与神经系统发育相关,维持神经系统功能,其中BDNF属于一种较为重要的脑源性神经营养因子,其在神经元生长分化、突出可塑性、抗神经元凋亡等过程中具有重要的意义[9]。而CREB属于BNDF的上游转录因子,其具有对多种记忆相关蛋白表达的调节功能,其自身及磷酸化后均会在一定程度上抑制BDNF表达,促进BDNF下游调控因子TrkB磷酸化[10]。Guo等[11]在其研究中发现,上调CREB/BDNF/TrkB信号通路可改善精神分裂症认知障碍。神经递质系统紊乱与精神分裂症发生后的海马神经元损失相关,Glu-DA神经递质系统在精神分裂症发生后出现明显的紊乱表现[12]。本文结果显示,上调LPL基因可能经激活CREB/BDNF/TrkB信号通路,稳定Glu-DA神经递质系统,发挥其改善精神分裂症认知的作用。
综上所述,本研究发现上调LPL基因后可在一定程度上修复精神分裂症大鼠海马组织损伤,其作用机制可能与激活CREB/BDNF/TrkB信号通路,稳定Glu-DA神经递质系统,改善NO,MDA,nNOS,DA及Glu异常表达相关。但由于本研究动物样本数量有限,该结论尚需后续试验进一步证实。

