超声、高分辨率磁共振成像技术在诊断评估兔颈动脉粥样硬化中的应用研究
徐松涛李嘉颖沈利叶郁晨徐雁云潘永明孙志超陈民利∗
(1. 浙江中医药大学动物实验研究中心/比较医学研究所,国家中医药管理局实验动物三级实验室,杭州 310053;2. 浙江中医药大学附属第一医院,医学影像科,杭州 310006)
动脉粥样硬化(atherosclerosis,AS)主要由脂肪、血栓、结缔组织和碳酸钙在血管中的沉积引起的,包括冠状动脉、脑动脉、主动脉及肾动脉等其他血管的动脉粥样硬化。动脉粥样硬化仍是世界范围内心血管疾病的首要原因[1],据世界卫生组织报道全世界每年约有1500 万人死于动脉粥样硬化引起的心血管疾病[2]。另外,动脉粥样硬化也是引起脑血管疾病的主要原因之一,可导致动脉壁增厚、硬化和管腔狭窄,使得动脉供血的组织或器官最终会引发缺血或坏死,导致脑卒中、短暂性脑缺血等脑血管疾病的发生,严重威胁人类的健康和生命。因此,探索有效的动脉粥样硬化诊断评估方法具有重要意义[3]。
目前临床上诊断颈动脉粥样硬化的影像学方法众多,包括超声成像(US)、磁共振影像学(MRI)、血管造影、正电子发射断层成像术(PET)/计算机断层扫描(CT)等[1],其中超声以无创、便携、操作简单快速等优点广泛用于临床血管疾病的诊断[4]。MRI具有较高的空间分辨率,不仅可以评价血管的狭窄程度,还可以动态观察血管壁的变化[5]。尽管关于动脉粥样硬化的诊断已有较多的检测方法,但大多局限于单一的诊断,而对几种检测方法的比较和评价研究较少。因此,仍需大量基础研究推进动脉粥样硬化的研究进展。自1908年首次使用高胆固醇饮食兔研究主动脉壁斑块形成以来,动物模型一直是研究动脉粥样硬化发生发展过程和机制的重要工具[6]。兔是较为理想的AS 模型动物,与大小鼠比,兔的脂代谢过程与人类相似,更能模拟人类AS病程;与大型动物比,兔易于处理且研究成本较低[7]。高胆固醇饮食联合球囊损伤法是目前复制AS 常用的造模方法之一[8],球囊损伤后血管内皮功能障碍、炎症反应严重,持续的高胆固醇饮食又加剧了脂质积聚在血管内膜上,加速AS 病变的进程,8周即可形成AS 病变[9]。因此,本研究采用超声和高分辨率磁共振成像(HRMRI)技术观察高胆固醇饮食联合球囊损伤兔颈动脉动脉粥样硬化模型的病变状况,为临床前AS 模型诊断评估以及对于延缓AS 的进展和改善其预后的诊断具有重要意义。
1 材料与方法
1.1 材料
1.1.1 实验动物
18 只普通级雄性4 ~5 月龄日本大耳白兔,体重为2.2 ~2.5 kg,来源于新昌县大市聚镇欣健兔场【SCXK(浙)2015-0004】;饲养于浙江中医药大学动物实验研究中心普通级兔实验室【SYXK(浙)2018-0012】,环境温度(22 ± 2)℃,相对湿度:50%~60%,光照:12 h/12 h 明暗交替;单笼饲养,自由饮食。所有饲养和操作均经浙江中医药大学动物实验研究中心动物伦理委员会批准(IACUC 批准号:20191021-08)。
1.1.2 主要试剂与仪器
TC、TG 试剂盒(上海圣能德赛诊断技术有限公司,中国)。2.5 mm PTCA 球囊导管(Terumo 公司,日本),全自动生化分析仪(7020,日立公司,日立),组织脱水机(STP120,Microm 公司,德国),半自动病理切片机(RM2245,Leica 公司,美国),Nano Zoomer 数字切片扫描设备(2.0 RS,滨松公司,日本)数字化彩色超声诊断仪(G50,飞依诺科技有限公司,中国),3.0 T MRI 扫描仪(GE Discovery MR 750,GE 公司,美国),8 通道兔专用线圈(上海晨光医疗技术公司,中国)。
1.2 方法
1.2.1 分组与造模
取日本大耳白兔18 只,适应性饲养2周后,按体重随机分为2 组,即正常对照组(n=9)和模型组(n=9)。正常对照组饲喂常规饲料(每天120 g),模型组饲喂1%高胆固醇饲料(每天120 g)2周后,行经皮颈动脉腔内球囊成形术,简言之,术前禁食不禁水12 h 后,用3%戊巴比妥钠溶液(30 mg/kg)耳缘静脉注射麻醉,并给予肝素钠(500 IU/kg)以防止术中急性血栓形成,仰卧位保定,颈部皮肤剃毛消毒后,纵向切口约4 cm,暴露并游离右侧颈总动脉(common carotid artery,CCA)行球囊损伤术,分别用动脉夹临时夹闭CCA 近心端及颈内动脉(internal carotid artery, ICA) 起始段, 颈外动脉(external carotid artery,ECA)远心端结扎、近心端用线轻轻提起,距ECA 起始段0.5 cm 处用一次性无菌注射器针头穿刺小口,球囊导管从此处轻轻插入CCA 中。球囊内充以生理盐水至6 atm,牵拉旋转导管,回抽球囊内液体至0 atm 后回抽导管,重复3 次,取出球囊导管,结扎ECA,恢复血流,缝合切口,术后继续饲喂1%高胆固醇饲料6周,以建立颈动脉粥样硬化模型。术后连续3 d 施以青霉素钠80 万单位预防感染。整个实验周期为8周。
1.2.2 体重与血脂检测
在造模4周和8周时动物禁食12h 后,空腹称重,并取耳中动脉肝素抗凝血5 mL,分离血浆,在全自动生化仪上测定血浆总胆固醇(TC)和甘油三酯(TG)。
1.2.3 颈动脉超声检查
造模4周、8周时行颈动脉超声检查。用3% ~5%异氟烷吸入诱导并面罩维持兔的麻醉状态,颈部皮肤备皮后,在超声探头上涂抹偶联剂,通过超声诊断仪依颈动脉走行方向探测颈总动脉的长轴切面,显示颈总动脉的管腔内径、内中膜厚度(IMT)、狭窄程度等,用彩色多普勒图像显示颈总动脉内血流情况,用脉冲多普勒测量血流速度,利用回声强度不同和彩色多普勒来观察是否存在斑块及其大小与性状。诊断标准有四项:(1)IMT,测量最初的高回声与血液的交接面到第二个高回声层之间的距离,采用五个随机位置的IMT 平均值;(2)血流速度,采用三个收缩期最高血流速度的平均值;(3)血管阻力指数(resistance index,RI):RI=(收缩期流速-舒张期流速)/收缩期流速,采用三次阻力指数的平均值;(4)狭窄率:狭窄率=(血管最大内径-狭窄部血管径)/血管最大内径,采用3 个长轴切面狭窄率的平均值。
1.2.4 MRI 扫描
造模8周时,实验兔禁食不禁水12 h,经耳缘静脉注射30 mg/kg 戊巴比妥钠溶液1 mL/kg 后麻醉,行MRI 扫描,参数包括快速飞行时间三维成像(3DTOF):重复时间20 ms;回波时间3.69 ms;回波链长度1;视野225 mm;切片厚度0.6 mm;T2 加权涡轮自旋回波成像:重复时间4120 ms;回波时间62 ms;回波链长度14,视野140 mm;切片厚度2 mm;T1 加权取样的完美性,应用优化对比度,使用不同的角度演变,脂肪饱和成像:重复时间900 ms;回波时间15 ms;回波链长度52;视野160 mm;切片厚度0.63 mm。将原始图像传入工作站处理进行最大信号强度投影(maximum intensity projection,MIP)成像。观察颈部血管情况,用Image J 软件测量狭窄率。
1.2.5 组织病理学观察
行安死术后解剖右侧颈总动脉血管进行组织病理学检查。取一部分冰冻切片后,油红“O”染色,观察脂质沉积程度,用Image J 软件定量分析脂质含量。另取一部分用中性甲醛固定后,脱水、石蜡包埋、切片、HE 染色,用NDP. view 2 软件观察形态学变化并定量分析内中膜厚度(IMT)、血管管腔面积(lumen area,LA)、内弹力层围绕面积(internal elastic lamina area,IELA) 和外弹力层围绕面积(external elastic lamina area,EELA),并计算狭窄率,即(IELA-LA)/(EELA-LA)×100。
1.3 统计学分析
2 结果
2.1 各组兔体重及血脂水平的变化
与对照组相比,造模4周后模型组血浆总胆固醇水平明显升高(P<0.01),但体重和甘油三酯水平均无显著性差异(P>0.05);造模8周后,模型组兔体重、总胆固醇和甘油三酯水平均显著升高(P<0.05,P<0.01)(图1)。
2.2 颈动脉二维灰阶超声结果
颈总动脉灰阶超声图像显示,对照组在造模4周和8周时血管内膜光整,未见斑块形成;模型组造模4周时血管内膜毛糙、内中膜增厚、回声增强、可见斑块形成;8周时内中膜明显增厚、强回声区明显、管腔变窄。定量分析结果显示,与对照组相比,模型组的IMT 和狭窄率随病程的进展而显著升高(P<0.01)(图2)。
2.3 颈动脉多普勒超声结果
颈总动脉狭窄远段的彩色多普勒和频谱多普勒超声结果显示,对照组在造模4、8周时管腔内血流充盈良好、呈层流特点、血流波形呈高尖状;模型组造模4周时可见散在的血流信号、血流波形仍呈低尖状,8周时血流信号紊乱、频带增宽、峰型变钝、频谱图形边界部分模糊(图3A)。定量分析结果显示,模型组造模4周和8周的PSV 显著低于对照组(P<0.01),而模型组RI 则显著高于对照组(P<0.05,P<0.01);与模型组4周时比,模型组8周时RI 显著增加(P<0.05)(图3B、3C)。
2.4 高分辨率磁共振成像检测结果
HRMRI 检查显示正常对照组颈总动脉未见狭窄,模型组右侧颈总动脉有明显狭窄形成;水平层面上,正常对照组双侧颈总动脉管腔光滑、未见斑块形成,模型组右侧颈总动脉明显狭窄、有斑块形成。定量分析结果显示,与对照组相比,模型组颈总动脉狭窄率显著增加(P<0.01)(见图4)。
2.5 AS 病变分析结果
兔颈总动脉HE 染色显示,正常对照组平滑肌细胞排列整齐、形态良好,内膜无增厚,管腔正常,未见狭窄;模型组内膜明显增厚、管腔狭窄,大量泡沫细胞形成脂质斑块,血管平滑肌细胞迁移、增殖(图5A)。定量分析显示,模型组IMT 和狭窄率均显著高于对照组(P<0.05,P<0.01)(图5B、5C)。油红“O”染色显示,模型组颈动脉中有大量脂质沉积;定量分析显示,与对照组比,模型组脂质含量显著升高(P<0.01)(图5D)。
2.6 B 超、HRMRI 检测结果与病理结果的相关性分析
超声检测与HE 染色定量分析所得的中内膜厚度和狭窄率均具有显著性相关(P<0.01),相关系数分别为0.77 和0.99;同样,HRMRI 检测和HE 染色定量分析所得的狭窄率具有显著性相关(r=0.99,P<0.01);超声检测和HRMRI 检测所得的狭窄率亦具有相关性(r=0.98,P<0.01)。
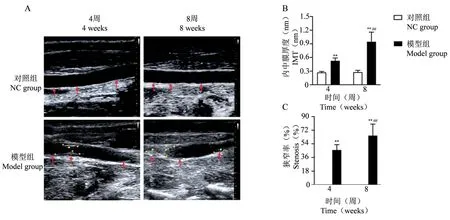
图2 二维灰阶超声成像与定量分析Note. A. Two-dimensional gray-scale ultrasound representative images of the rabbit right CCA at 4 and 8 weeks, the red arrow indicates IMT and the yellow“+” shows plaques. B, C. Quantitative analysis of IMT and stenosis rate of rabbit right CCA. Compared with the 4th week model group, ##P<0.01.Figure 2 Two-dimensional gray-scale ultrasound imaging and quantitative analysis

图3 多普勒超声成像与定量分析Note. A. Representative doppler ultrasound images of the rabbit right CCA at 4 and 8 weeks, the yellow and white arrow indicates PSV and EDV,respectively. B, C. Quantitative analysis of PSV and RI of rabbit right CCA. Compared with the 4th week model group, #P<0.05.Figure 3 Doppler ultrasound imaging and quantitative analysis
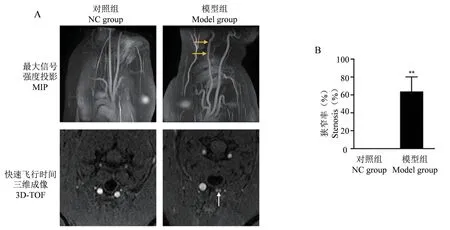
图4 高分辨率磁共振成像与定量分析Note. A. Representative HRMRI images of the rabbit right CCA at 8 weeks,the yellow and white arrows indicate stenosis and plaques,respectively. B.Quantitative analysis of stenosis rate in rabbit CCA by HRMRI.Figure 4 High resolution magnetic resonance imaging and quantitative analysis

图5 兔颈总动脉病理染色结果与定量分析Note. A. Representative image of HE staining and Oil Red “O” staining of the rabbit CCA. B, C. Quantitative analysis of IMT and stenosis rate in rabbit CCA by HE staining. D. Quantitative analysis of lipid content by oil red “O” staining.Figure 5 Pathological staining results and quantitative analysis of rabbit CCA
3 讨论
临床上颈动脉粥样硬化是全身性动脉粥样硬化的反映,研究表明通过颈动脉超声测量的内中膜厚度和颈动脉斑块能预测人类认知障碍和CAD 风险[10]。兔AS 模型被广泛用于AS 临床前研究,与仅使用高胆固醇饮食的自发性病变比,通过球囊损伤术破坏内皮并使血管壁扩张,能够快速形成斑块[11]。本研究在高胆固醇饮食背景下行球囊损伤术8周后,模型兔体重明显增加,并具有高脂血症。从病理检测结果中可见,8周时模型组颈动脉出现新生内膜,新生内膜是血管损伤后修复的普遍反应[12],表现为明显的内膜增厚、大量泡沫细胞浸润形成脂质核、中膜平滑肌细胞迁移到内膜并大量增殖、纤维帽形成。
二维灰阶超声成像图能明显观察到模型兔的强回声斑块,且8周时的IMT 和狭窄率均比4周时增加明显,这与AS 病变进程相符。与病理结果的相关性分析表明,IMT 和狭窄率均有相关性,但模型组IMT 值普遍大于病理定量分析结果,这可能与兔颈动脉内径相对较小,超声测量时较难分辨内、中、外膜三者的明确界限,存在一定误差,且测量时管腔血液充盈,与病理检测时状态不一致有关。有研究显示,随着狭窄程度的增加,PSV 呈上升趋势[13],但本实验频谱多普勒超声结果显示,PSV 随AS 的发展呈下降趋势,这可能与AS 后期血管狭窄程度高有关,狭窄后段血流量不足导致PSV 降低。尽管在狭窄部位测量PSV 是多普勒评估狭窄程度的理论基础,但由于球囊损伤术形成的AS 病变比人类自发性病变程度深,实际操作过程中很难检测到狭窄部位的血流情况。然而狭窄后段也能得到有价值的信息,在狭窄后端,通过狭窄段的高速血流突然散开到相对低流速低压的区域而产生紊乱的血流信号,反应在频谱上就是“频带增宽”[14]。研究显示随着AS 的病程进展,血管管腔变窄,其阻力指数升高[15],这与本实验结果保持一致。
最近研究表明,与超声比,HRMRI 就动脉粥样硬化斑块的诊断更有效[16-17]。HRMRI 的MIP 重建图像可以突破血管形态上的限制,直观输出图像,以更准确地评估病变程度。HRMRI 的优势还在于可以获得和结合多对比图像来区分血管壁内的组织成分,如3D-TOF MRA 是目前最常用的“亮血”技术,能够识别斑块成分及出血情况,有利于鉴别易损斑块[18]。本实验采用HRMRI 技术进行兔颈动脉AS 检测,MIP 成像结果显示模型组右侧颈总动脉有明显狭窄,3D-TOF 成像结果显示AS 斑块形成。此外,相关性分析也表明HRMRI 定量分析所得的狭窄率与病理结果显著相关。近来也有一些研究将HRMRI 技术应用到其他实验动物中,如大鼠[19]、狗[20]等,运用不同类型的线圈均可获得清晰成像,达到诊断评估效果。但HRMRI 仍存在一定局限性,图像采集时间较长且需要特定线圈,检测成本较高。
综上所述,超声和HRMRI 技术均能无创检测兔颈动脉粥样硬化模型的病变,均可诊断AS 斑块是否形成,而HRMRI 能更清晰、直观地判断血管狭窄及斑块的严重程度,适合用于药物治疗效果的评价。

