Bmal1 时钟基因敲除小鼠的繁育及基因型鉴定
李纳陈志彦王力杰刘哲郭炳彦李拥军
(河北医科大学第二医院, 石家庄 050000)
时钟节律是指生物机体为了适应环境,从整体到组织、细胞各个层次都呈现明显的时间周期现象。目前克隆鉴定出哺乳动物的生物钟基因包括调控时钟基因Bmal1、Clock、Per及Cry等,它们在转录和转录后形成的自激振荡环路是昼夜节律产生的分子基础[1]。昼夜节律的产生依赖于这些时钟基因及其蛋白质产物间的相互作用所形成的“转录-翻译反馈环路”。Bmal1 基因处于整个时钟体系的上游,其表达产物Bmal1 蛋白是正反馈环路的调节因子之一,CLOCK 蛋白是其分子伴侣。Bmal1 蛋白与CLOCK 蛋白结合所生成的Bmal1/CLOCK 异二聚体是整个中心振荡环的正向元件[2]。近年来研究发现,Bmal1 基因不仅在调控生物的时钟节律中发挥一定作用,而且在糖代谢、能量平衡、脂肪细胞的增殖和分化等方面都起着关键作用[3]。Bmal1基因的缺失会导致小鼠昼夜节律振荡的丧失,是心血管内科,神经内科,内分泌等学科的共同关注的热点。Kondratov 等[4]在早年研究表明Bmal1 敲除纯合小鼠丧失繁殖能力,培育出纯合率更高的基因敲除小鼠,提供实验周期更短的时钟动物模型是亟待突破实验技术。本实验室通过引进Bmal1 基因敲除鼠,在SPF 级动物房内以1 雄2 雌的合笼方式进行了饲养、保种繁育,并对繁育出生的仔鼠进行基因鉴定,结果获得了稳定的Bmal1-/-基因型小鼠。
1 材料与方法
1.1 材料
1.1.1 实验动物
3 ~12周龄SPF 级C57BL/6JBmal1 基因敲除杂合子小鼠3 只,雌鼠2 只及雄鼠1 只自美国Jackson 实验室引进, 美国政府健康证书【1911A03594】,品系名:B6.129-Arnll<tml Bra >/J,遗传背景C57BL/6J,基因型:Bmal1+/-。所有引进小鼠饲养于河北医科大学第四医院实验动物中心【SYXK(冀)2018-001】SPF 级标准饲养,室温(23±3)℃,12 h 光照/黑暗循环,自由取食、饮水,所有操作均符合实验动物伦理学要求(伦理审查备案号:IACUC-4th Hos Hebmu-1018001)。
1.1.2 主要试剂与仪器
5×Green buffer(普洛麦格(北京)生物技术有限公司,货号:0000322802),Go Taq DNA 聚合酶(普洛麦格(北京) 生物技术有限公司, 货号:0000324964),DNTP(天根生化科技(北京)有限公司,货号:Q5818),Marker(中科瑞泰(北京)生物科技有限公司,货号:RTM415-02),4S RED PLUS 核酸染色(BBI 生命科学有限公司,货号:A606695),Bmal1(abcam,货号:ab230822 批号:GR3340956-2,英国), ACTIN (abclonal, 货 号: AC026, 批 号:9100026001),小鼠二抗(bioeasy,货号:BE0102,批号:808000805, 中 国), 兔 二 抗(bioeasy, 货 号:BE0101,批号:808000901,中国)。
PCR 扩增仪(艾本德德国生命科技公司,型号:Mastercyler Nexus),凝胶成像系统(普诺森生物科技(上海)有限公司,型号:AlphaImager HP),电泳仪(北京市六一仪器厂,型号:DYY-7C 电泳仪),台式冰冻离心机(苏州赛恩斯仪器有限公司,型号:Thermo),鱼跃580 血糖仪,洁净工作台(中国北京设备一厂),电子称重仪(VP202 N 中国上海精密仪器有限公司),电子天平(Sartorius 公司,德国),移液枪(Eppendorf 公司,法国),-80℃低温冰箱(青岛海尔),4℃低温冰箱(青岛海尔),PVDF 膜(Millipore,美国),医用X 射线胶片(柯达公司,美国),通用显影粉、酸性定影粉(天津天陆海感光材料厂),高速离心机(Eppendorf 公司,德国),转移脱色摇床(海门其林贝尔仪器制造公司),凝胶玻璃板、固定夹(北京六一仪器厂),垂直电泳槽(北京六一仪器厂),转移槽(北京六一仪器厂)。
1.2 方法
1.2.1 引物设计
根据美国Jackson 实验室公布的小鼠Bmal1 基因序列,设计检测鼠Bmal1 基因位点引物,设计引物 及 序 列 如 下: Arntl-Commom (5′-GCCCACAGTCAGATTGAAAAG-3′); Arntl-WT (5′-CCCACATCAGCTCATTAACAA-3′);Arntl-M Reverse(5′-GCCTGAAGAACGAGATCAGC-3′)。
1.2.2Bmal1 基因敲除小鼠的饲养繁育
采用将F0 代1 雄2 雌(Bmal1+/-)合笼方式进行3 个月保种繁殖,得到54 只后代小鼠后将小鼠进行鼠尾鉴定,将F1 代杂合子小鼠(Bmal1+/-)饲养至8周龄进行近交系繁殖,本实验将10 笼合笼的杂合Bmal1 基因敲除鼠(20 ~44周龄)的生产情况进行24周的记录,对仔鼠数量进行基因鉴定及统计计算。
1.2.3Bmal1 敲除小鼠表型分析
每周定期观察小鼠体型以及被毛、皮肤形态的变化,详细记录;检测8周龄基因敲除小鼠24 h 小鼠血糖、体重变化。开灯时间上午6:00 规定为ZT0(zeitgeber time),分别测定Bmal1-/-及Bmal1+/+每组3 只,本实验设计测定每4 h 的血糖值,分别为ZT0(6:00)、ZT4(10:00)、ZT8(14:00)、ZT12(16:00)、ZT14(20:00)及ZT20(0:00)6 个时间点血糖,并利用Graph Pad Prism 8 绘制血糖曲线图。
1.2.4Bmal1 敲除小鼠鉴定
(1)鼠尾基因组DNA 提取:剪取小鼠尾尖2 ~3 mm 的组织置于0.2 mL 薄壁管中并置于冰上,-80℃冻存。DNA 提取方法,加A 液(25 mmol/L NaOH;0.2 mmol/L EDTA)98℃干浴,消化1 h 后,加B 液(40 mmol/L Tris-HCL;40 mmol/L Tris)终止消化,即可得到DNA 消化产物。
(2)PCR 扩增:鉴定引序列上海生工生物工程技术服务股份有限公司合成,以上3 种引物按照1 ∶1 ∶1比例混合至4 μmol/L,进行PCR 反应。PCR 反应体(20 μL):5 × PCR Mix 5.7 μL,引物混合物2.4 μL,模板DNA 1 μL,灭菌ddH2O 10.9 μL。采用PCR 扩增仪进行循环扩增,反应条件:预变性94℃5 min;变性94℃30 s,复性60℃30 s,延伸72℃50 s,循环30次;最后延伸72℃10 min;10℃停留。
(3)琼脂糖凝胶电泳:取PCR 产物10 μL,在1%琼脂糖凝胶中进行电泳分析,以110 V 36 mA 由负极向正极电泳25 min,在化学发光凝胶成像系统中拍照分析。
(4)基因型结果判定:按照条带不同来区分小鼠基因情况。PCR 产物DNA 扩增后,琼脂糖凝胶电泳基因型片段为:Commom 和mutant Reverse 引物扩增长度为160 bp 左右,为突变型(KO)小鼠;Commom 和Wild type reverse 片段为330 bp 左右为野生型(WT);160 bp 和330 bp 之间两条电泳条带均存在的为杂合子(HET)小鼠。
1.2.5 Western Blot 检测心肌组织中Bmal1 蛋白表达情况
(1)制备SDS-PAGE 凝胶;配制10%分离胶10 mL,快速灌入凝胶玻璃槽中,使其液面至标志线位置。去离子水覆盖胶面,室温放置约40 min 至分离胶凝固。配制5%浓缩胶2 mL。将凝胶板重新垂直放置,轻轻加入5%浓缩胶液,插入样品梳,室温凝胶约40 min,固定在电泳槽上。
(2)样品变性及电泳:根据蛋白定量结果,加入相应体积的总蛋白样品与5 ×蛋白质凝胶电泳上样缓冲液,轻轻混合,95℃变性10 min,立即插入冰中待用。将样品轻轻加至凝胶孔中,电泳仪设置成稳压状态,接通电源,将电压调至80 V 使样品通过浓缩胶与分离胶(电压约8 V/cm)。电泳使染料至分离胶适当位置,结束电泳。
(3)凝胶转膜及其检测:凝胶电泳结束后,将凝胶上分离到的蛋白条带通过转移电泳方式转印至固相支持物上,然后分别用非标记一抗及辣根过氧化物酶标记的二抗对其进行孵育、检测。用于Western Blot 的固相支持物有多种,本实验采用PVDF 膜作为固相支持物。本实验采用湿转的转膜方式。
1.3 统计学分析
结果用平均值± 标准差(±s)表示。所有数据均用SPSS 21.0 和GraphPad Prism 6 软件处理,多组间比较使用单因素方差分析,两组间比较采用独立样本t检验。以P<0.05 表示差异具有显著性。
2 结果
2.1 Bmal1 敲除小鼠表型
2.1.1 小鼠外形特征
C57BL/6 遗传背景的Bmal1 基因敲除小鼠成年鼠被毛为黑色,体重上,纯合型鼠(20.3 ± 1.6)g明显低于野生型(25.8 ± 1.2)g,体型肉眼可见较小,其余未见差异。繁殖小鼠交配后的子代新生仔鼠,皮肤为粉嫩肉红色,双眼未睁,四肢躯干向腹侧蜷缩,与野生型仔鼠外观形态无显著性差异,本实验结果不排除实验室饲养条件、环境因素等对小鼠状态的影响,但经观察,杂合子繁殖小鼠生产出的野生型小鼠同等条件下与动物实验中心其他小鼠体重无明显差异(图1)。

图1 野生型和基因敲除型成年及仔鼠外形体征Note. A. Left is adult mice of knockout type, right is adult mice of wild-type mice. B. Top is neonatal mice of knockout type, bottom is neonatal mice of wild-type mice.Figure 1 Physical signs of wild-type and knockout type adults and neonatal mice
2.1.2 小鼠24 h 血糖变化
本实验室采取随机测定血糖法和空腹12 h 测定法分别测定Bmal1-/-和Bmal1+/+两组血糖24 h 节点血糖值,两组实验及结果如下:测定WT 及KO 小鼠各6 只,24 h 各个时间的血糖值,观察节律并绘制折线图。取尾血利用鱼跃血糖仪测定。可见两组小鼠随机血糖在ZT4 和ZT20,这2 个时间点时血糖水平具有统计学差异(P<0.05),然而两组小鼠空腹12 h 各个时间点未见明显差异(图2)。

图2 Bmal1-/-与Bmal1+/+两组小鼠24 h 血糖曲线图Note. Compare with WT, ∗P<0.05.Figure 2 24 h blood glucose curves of Bmal1-/- and Bmal1+/+ mice
2.2 小鼠繁殖情况
Bmal1 基因敲除杂合母鼠妊娠期为22 d 左右,哺乳期为21 d 左右,小鼠性成熟期约为60 ~84 d,以上生理特征与野生型小鼠无明显差异,但纯合Bmal1 敲除鼠合笼12周雌鼠均未受孕繁殖。通过对3 笼纯合鼠合笼观察记录,判定实验中Bmal1 敲除纯合小鼠丧失繁殖能力。比较野生8 笼鼠及杂合12 笼鼠,16 ~40周龄产仔数量上每胎6 ~11 只,两组相比无明显差异。对生产的仔鼠数量进行统计计算。野生型小鼠,在6 个月期间8 笼小鼠共计生产22 胎,产仔数量总数为132 只,平均每胎为(6.0 ± 1.8)只,与杂合鼠比较,6 个月期间12 笼小鼠共计生产38 胎,产仔数量总数为241 只,平均每胎为(6.3 ± 2.6)只,其中纯合鼠40 只,纯合鼠出生率约16.4%。
2.3 小鼠基因鉴定结果
以下结果来自部分实验小鼠中鼠中,小鼠鼠尾基因组DNA 扩增产物鉴定结果。如下图:N 为阴性水对照,未见条带。7 号样品条带在160 bp 位置左右,为Bmal1 基因敲除小鼠,3 号样品条带在330 bp位置左右,为野生型小鼠。1、2、4、5、6 为杂合基因型鼠(图3)。

图3 部分小鼠PCR 基因型鉴定结果Note. Marker(2 × 103 DNA marker).1, 2, 4, 5, 6.Heterozygote samples. 3. Wild type. 7. Knock out type. N.Negative control.Figure 3 Results of genotype identification of some mice by PCR
2.4 敲除小鼠在心脏中Bmal1 表达情况
Western Blot 检测F1、F2 代Bmal1-/-小鼠和Bmal1+/+小鼠心肌组织蛋白水平表达水平(图4),Bmal1+/+小鼠均有Bmal1 表达,而Bmal1-/-小鼠中未检测到Bmal1,说明Bmal1 基因敲除鉴定结果与PCR 鼠尾鉴定结果一致。
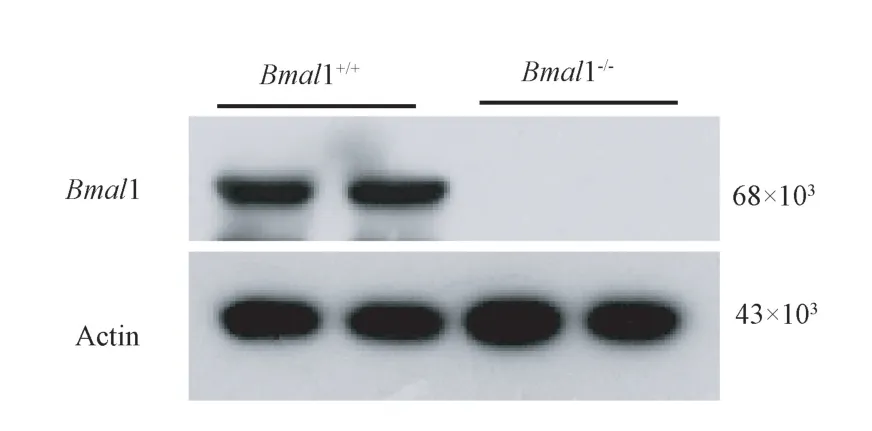
图4 F1 和F2 中Bmal1-/-及Bmal1+/+小鼠心肌组织Bmal1 表达情况分析Figure 4 Expression of Bmal1-/- and Bmal1+/+ in myocardial tissue of mice in F1 and F2
3 讨论
目前基因敲除小鼠广泛应用到各种疾病的研究之中,但部分基因纯合敲除小鼠丧失繁殖能力[5],因此小鼠保种繁殖方法成为科学研究首先考虑的实验步骤,基因鉴定是基因敲除小鼠保种繁殖的重要环节之一[6],其中常见小鼠基因敲除鉴定所使用的检测方法之一为PCR 法[7]。本实验采用Bmal1+/-小鼠合笼法获得子代,并采用NaOH 法提取鼠尾组织基因组DNA、PCR 扩增和凝胶电泳等鉴定出Bmal1 敲除鼠的基因型,通过Western Blot 法检测心脏组织中的Bmal1 蛋白证实此法准确有效。整个实验时间、经济成本均较为适中,通过本次实验可以明确Bmal1 基因敲出小鼠的保种繁育可以应用此法。此外,本次实验通过两种血糖检测方法检测不同基因的小鼠血糖水平,得到Bmal1 敲除小鼠在随机血糖测量中血糖差异性明显,实验证实小鼠血糖水平与时钟基因具有相关性以及关于血糖测定方式选择也提供了思路[8]。
Kondratov 等[4]在早年研究表明Bmal1 敲除纯合小鼠丧失繁殖能力,这一结论与本次研究中的结果相一致,Bmal1 敲除小鼠不具有生育能力,保种繁殖需根据遗传定律通过合笼杂合子小鼠,进而得到纯合的Bmal1 基因敲除鼠。Bmal1 基因是调节生物24 h 节律时钟环路中的重要部分,所以推测,敲除后小鼠除了生物节律的丧失外,还会对机体内其他分子通路有损伤,导致小鼠繁殖能力的丧失。Bmal1 是具体通过何种分子同路影响小鼠繁殖能力,仍尚不明确。
生物钟基因,指能够使生物体产生昼夜节律,并控制其运转的基因,是生物钟的分子基础[9]。在转录水平上,生物钟蛋白可作为转录因子,通过Ebox、D-box 和RORE 等顺式作用元件直接控制钟控基因的表达;可分为正性调控因子(如Bmal1、CLOCK)和负性调控因子(如PER、CRY)。其中Bmal1 蛋白与CLOCK 在细胞核内形成异二聚体CLOCK/Bmal1,可激活目标基因Per、Cry 和Rev-erb的转录,是时钟环路中的重要步骤之一[10],作为时钟环路中的重要元件之一,Bmal1 在机体内几乎所有组织细胞均有时钟节律的振荡[11]。
在心血管领域,Bmal1 基因的表达水平与多种疾病具有相关性,如直接调节血压的昼夜节律,是血压调节的关键基因[12]。有研究发现Bmal1-/-小鼠持续维持低血压状态,血压活动节律完全消失。这与Bmal1-/-小鼠血管内皮细胞中Nox 过表达,NO信号解耦连使得超氧化物增加,诱发血管内皮功能障碍所致相关[13]。除此之外,小鼠实验已明确Bmal1 在脂质代谢中发挥着关键作用[14]。Bmal1-/-小鼠血脂异常、动脉粥样硬化的发生率明显升高,当过表达Bmal1 时则可减缓二者的发生和发展[15]。此外,动物实验证实小鼠内皮细胞Bmal1 基因的缺失会导致趋化因子CXCL5、CCL20 和CCL8 表达增加,致使血管屏障功能和内皮细胞完整性受损,致白细胞迁移至内皮细胞层[16],进而引起血管炎症反应。
本次实验发现根据遗传规律进行保种繁育,并且利用PCR 法测定能够准确检测Bmal1 基因,为下一步关于疾病与时钟的作用,如与血糖水平密切相关的糖尿病心肌病发生发展等研究提供了实验动物基础。

