免疫检查点及其抑制剂在脑胶质瘤中的研究进展
陈文婷,柳 军
(中国药科大学新药筛选中心,南京210009)
脑胶质瘤是中枢神经系统中最常见且致命的原发性恶性肿瘤。其中Ⅳ级胶质母细胞瘤(glioblastoma,GBM)患者的预后最差,其5 年相对生存率低于5%,且最终都会复发[1]。胶质母细胞瘤的常规疗法是手术切除后辅以放疗并联合使用替莫唑胺(temozolomide)化疗,效果仍不理想[2]。传统手术的局限性主要是由于肿瘤的扩散浸润性,阻止了正常脑实质浸润细胞的完全切除,因此临床上亟需新的疗法来改善患者预后[3]。
除化疗、放疗、手术和其他靶向治疗外,肿瘤免疫治疗(也称为免疫肿瘤学)现在被认为是肿瘤治疗的第五大支柱,主要是由于免疫检查点抑制剂的快速发展[4-6],因此该疗法有望造福脑胶质瘤患者。免疫检查点分子通过调节T 细胞对自身抗原的免疫反应来限制自身免疫的发展,但也会像“刹车”一样限制免疫系统对癌细胞的攻击,不同的免疫检查点其作用机制也不尽相同[7]。本文综述了免疫检查点分子及其抑制剂在脑胶质瘤中的研究现状,为探索和研发更为有效的免疫治疗方案提供参考。
1 免疫检查点分子在脑胶质瘤中的研究
1.1 程序性死亡蛋白-1及其配体(PD-1/PD-L1)
PD-1表达于活化的T细胞、B 细胞、单核细胞、树突状细胞(dendritic cell,DC)和自然杀伤细胞(natural killer,NK)。PD-L1 是PD-1 的主要配体,有研究发现其在乳腺癌、黑色素瘤和口腔鳞状细胞癌等多种肿瘤组织中高表达[8]。PD-1 与PD-L1结合可以抑制T细胞受体下游的信号传递,从而阻断T 细胞活化的第一信号,阻止T 细胞的增殖,促进活化T 细胞的凋亡,抑制各种细胞因子的产生,导致肿瘤反应性T 细胞的耗竭而导致免疫逃逸[9]。PD-L1 的表达与脑胶质瘤的恶性级别正相关且在肿瘤生长边缘显著上调[10-11]。值得注意的是,在小胶质细胞/巨噬细胞中也有发现PD-L1,而PD-1 表达于肿瘤浸润淋巴细胞(TIL),且一般集中在血管周围,并非是肿瘤组织,提示肿瘤浸润淋巴细胞可能不容易迁移到免疫抑制的肿瘤微环境中,而在血管周围发生阻滞[12]。Nduom 等[13]通过肿瘤基因组图谱(The Cancer Genome Atlas,TCGA)数据库,发现PD-1/PD-L1 的表达水平与胶质母细胞瘤患者预后呈负相关,但此观点仍存在争议[12]。此外,脑胶质瘤中白介素-10(interleukin-10,IL-10)信号传导的上调促进了循环单核细胞和肿瘤浸润性巨噬细胞中PD-L1 的表达,使其转变为免疫抑制表型[14]。PD-1抑制剂与其他疗法的联合用药在小鼠脑胶质瘤模型中产生了显著的疗效:PD-1 抑制剂联合放疗、树突状细胞疫苗或替莫唑胺化疗可延缓肿瘤生长,显著提高小鼠的存活率[15-17],与Toll样受体3(toll-like receptor 3,TLR3)激动剂联合治疗脑胶质瘤,增加了树突状细胞活化和T 细胞增殖[18]。
1.2 细胞毒性T淋巴细胞相关抗原-4(CTLA-4)
CTLA-4表达在活化的调节性T细胞(regulatory T cell,Treg)表面,可通过与共刺激分子CD28,竞争性结合抗原呈递细胞(antigen-presenting cell,APC)表面的配体B7-1 和B7-2,抑制协同刺激信号,进而抑制T 细胞活化,增强Treg 免疫抑制活性而介导免疫逃逸[19]。Fong 等[20]发现接种树突状细胞疫苗后,胶质母细胞瘤患者的生存率与CD4+和CD8+T 细胞上表达的CTLA-4水平具呈负相关。这表明在树突状细胞疫苗的存在下,辅助性T细胞和细胞毒性T细胞上降低CTLA-4的表达可延长患者生存期,从而增强抗肿瘤免疫反应。研究发现,CTLA-4在高级别胶质瘤患者中的表达高于低级别胶质瘤患者;在异柠檬酸脱氢酶(isocitrate dehydrogenase,IDH)野生型胶质瘤中的表达高于IDH突变型;在间充质分子亚型胶质瘤患者中的表达显著高于其他分子亚型胶质瘤患者;进一步分析表明脑胶质瘤患者中CTLA-4 表达水平越高,其肿瘤浸润淋巴细胞的浸润程度越高,生存率越低,预示着CTLA-4 可作为脑胶质瘤的预后因素[21]。CTLA-4的特异性单克隆抗体(monoclonal antibody,mAb)阻断剂显示出了抗肿瘤功效,可降低小鼠脑胶质瘤模型中CD4+FoxP3+Treg 细胞的比例,并提高小鼠的存活率,联合PD-1 或PD-L1 抑制剂后治愈率高达75%[22-23]。同时,CTLA-4 抗体阻断也被证明可增强肿瘤细胞疫苗的效力[24]。
1.3 T细胞免疫球蛋白和黏蛋白分子-3(TIM-3)
TIM-3 既表达于T 细胞、树突状细胞、巨噬细胞、NK,也在肿瘤细胞上表达。TIM-3 与配体半乳凝素-9(galectin-9)和磷脂酰丝氨酸(phosphatidylserine,PtdSer)结合,诱导T 细胞凋亡,增加吞噬作用,上调促炎细胞因子的分泌而促进肿瘤生长[25]。有研究称TIM-3通过与配体黏附蛋白癌胚抗原相关细胞黏附分子1(carcinoembryonic antigen-related celladhesion molecule 1,CEACAM-1)的联合阻断可改善小鼠CT26 结肠癌的抗肿瘤免疫反应[26]。此外,高迁移率族蛋白B1(high mobilitygroupbox 1,HMGB1)是TIM-3 的另一配体,肿瘤相关树突状细胞表面的TIM-3通过干扰HMGB1介导核酸传感系统的激活,抑制先天性核酸免疫应答[27]。TIM-3 主要在胶质母细胞瘤和IDH 野生型胶质瘤中高表达,并且在间充质分子亚型胶质瘤中的表达水平显著上调。它还与胶质瘤的免疫功能密切相关,尤其是T 细胞介导的肿瘤细胞免疫应答和针对肿瘤细胞的细胞毒性。通过Kaplan-Meier 法分析1024例胶质瘤患者的预后,发现TIM-3的表达与患者的预后呈负相关[28]。外周CD4+和CD8+T 细胞中TIM-3 呈高表达,且与脑胶质瘤恶性级别正相关[29],而胶质母细胞瘤瘤内CD4+T 细胞中TIM-3 表达水平也较高[30]。在原位小鼠脑胶质瘤模型中,TIM-3 表达于胶质细胞和T 细胞。对脑胶质瘤模型的荷瘤细胞和对侧大脑半球细胞的比较发现,肿瘤浸润的CD11b+CD45mid胶质细胞中TIM-3 表达较低,而肿瘤浸润的CD8+T 细胞中TIM-3 表达较高[31]。与双药或单药治疗相比,PD-1抑制剂、TIM-3 抑制剂和放疗三联疗法也已被证明可显著提高小鼠的生存率[32]。目前,全球尚无抗TIM-3的抗体药物获批上市,一项诺华公司研制的MBG453(TIM-3 单抗)和PD-1 抑制剂在复发性胶质母细胞瘤中联用的研究,已申请了Ⅰ期临床试验(NCT03961971)。
1.4 淋巴细胞活化基因-3蛋白(LAG-3)
LAG-3 是在多种T 细胞(CD4+、CD8+T 细胞为主)和NK、树突状细胞、B 细胞上表达的一种免疫球蛋白,可抑制T 细胞增殖和细胞因子分泌[33]。LAG-3在结构上与CD4同源,通过结合抗原呈递细胞上的主要组织相容性复合物-Ⅱ(major histocompatibility complex-II,MHC-II)传递抑制信号,促进Treg 介导的免疫抑制[34]。肿瘤相关基质细胞上表达的半乳凝素-3(galectin-3)和肿瘤细胞表达的肝窦内皮细胞凝集素(liver sinusoidal endothelial cell lectin,LSECtin)也被认为是LAG-3的配体,两者均通过其糖基化位点与LAG-3 结合,阻断该作用可增强CD8+T 细胞分泌IFN-γ 的能力[35-36]。此外,纤维蛋白原相关蛋白(fibrinogen-related protein,FGL-1)与LAG-3 的D1 和D2 结构域结合,也可作为配体发挥作用[37]。在流式细胞术分析的胶质瘤样本中,LAG3 在高达30%的CD8+肿瘤浸润淋巴细胞中呈阳性,在CD4+细胞中呈低频率表达[38]。研究发现,LAG-3 和PD-1 的共同表达标志着T 细胞衰竭和对自身与肿瘤抗原耐受[39]。抗LAG-3 和抗PD-1抗体的共同作用增强了对单一检查点耐药肿瘤的清除率,包括胶质母细胞瘤[40-41]。LAG-3 的抗体药物还未批准上市,目前百时美施贵宝公司研发的BMS-986016(relatlimab,LAG-3 单抗)与抗PD-1 单抗纳武单抗(nivolumab)联用,正在进行Ⅰ期临床试验(NCT03493932)。
1.5 T细胞免疫球蛋白和ITIM结构域蛋白(TIGIT)
TIGIT 是一种跨膜蛋白,表达于CD8+、CD4+T细胞、Treg和NK细胞上。TIGIT与CD96、CD226形成了类似于CD28/CTLA-4 的通路:CD226 是共刺激受体,而TIGIT 与CD96是共抑制受体,可竞争性结合配体CD155,抑制NK 细胞活性[42]。在几种荷瘤小鼠模型中,阻断TIGIT可阻止NK细胞衰竭,还可导致肿瘤特异性T 细胞免疫,增强PD-1 抗体治疗,并在肿瘤再攻模型中维持记忆免疫。这表明TIGIT 在NK 细胞中具有重要作用,单独或联合其他检查点抑制剂是一种可行的抗肿瘤策略[43]。胶质母细胞瘤患者的肿瘤浸润淋巴细胞上TIGIT 表达升高,提示TIGIT 可能是有价值的治疗胶质母细胞瘤的靶点。TIGIT 和PD-1 阻断剂联用可增加小鼠脑胶质瘤模型中细胞毒性CD8+T细胞,减少Treg并提高存活率。与单药治疗组相比,联合用药可以增强效应T细胞功能、抑制肿瘤浸润树突状细胞产生[44]。目前,抗TIGIT的抗体药物还未批准上市,已申请的临床实验也还未应用于脑胶质瘤领域。
1.6 负性协同共刺激分子B7-H4
B7-H4通过抑制CD4+和CD8+T细胞增殖、细胞因子分泌和细胞周期而负向调控T 细胞的免疫应答,从而介导免疫逃逸[45]。迄今为止,B7-H4 的受体尚未发现,但有研究表明其受体可能在活化的T细胞上表达;同时B7-H4 以血清可溶性形式存在,在各种肿瘤组织中均有表达,可作为诊断肿瘤的生物标志物,与肿瘤的不良预后及高复发率密切相关[46]。CD133+细胞是脑胶质瘤的肿瘤干细胞(tumor stem-like cells,TSC),而肿瘤干细胞被认为在肿瘤的更新和对放疗与化疗的抵抗中起着重要作用。Yao 等[47]发现了B7-H4 在人原发性胶质瘤和髓母细胞瘤的肿瘤细胞中均有表达,B7-H4在分选的CD133+细胞中也有表达。另一方面,Yao等[48]又报道了B7-H4 的表达水平与脑胶质瘤的恶性级别正相关,可作为疾病预后不良的潜在预测因子。免疫荧光实验证实了B7-H4在巨噬细胞/小胶质细胞中表达且主要在肿瘤边缘上调,可能与肿瘤细胞侵入邻近脑组织期间逃避免疫监视相关。信号传导与转录激活因子3(signal transduction and transcriptional activators 3,STAT3)与B7-H4 上游启动子位点结合,通过IL-6/Janus 激酶(Janus Kinase,JAK)/STAT3 信号通路上调B7-H4的蛋白表达。抗B7-H4 单抗药物还未批准上市,目前有两项Ⅰ期临床试验(NCT01878123 和NCT03514121)正在进行,但还未应用于脑胶质瘤疾病。
1.7 T 细胞激活抑制物免疫球蛋白可变区结构域(VISTA)
VISTA 是2011 年发现的一种新型免疫检查点,属于Ⅰ型跨膜蛋白,其胞外段免疫球蛋白可变区(immunoglobulin variable region,IgV)结构与PD-1 相似,故又称PD-1 同源物(PD-1 homolog,PD-1H)[49-50]。VISTA 在CD11b+的髓系细胞系和CD4+、CD8+T 细胞上高表达,在B 细胞上表达较弱[49]。目前,VISTA的配体即VSIG-3(V-Set and Immunoglobulin domain containing 3),又称免疫球蛋白超家族11(immunoglobulin superfamily member 11,IGSF-11)已被发现,可以抑制T 细胞增殖和细胞因子的产生[51];另一方面,有报道VISTA 是P 选择素糖蛋白配体1(P-selectin glycoprotein ligand-1,PSGL-1)的酸性pH 选择性配体,免疫反应可通过特定于酸性环境的检查点进行调节[52]。Wang 等[49]发现了肿瘤细胞上高表达的VISTA 干扰了小鼠体内的抗肿瘤免疫反应,而在多种肿瘤中也发现了VISTA的高表达[53]。最近一项Meta 分析评估了VISTA 在10 种实体肿瘤中的预后价值,发现VISTA 的高表达与良好的总生存期以及CD8+肿瘤浸润淋巴细胞浸润相关,这表明VISTA 是一种潜在的实体瘤预后的生物标志物[54]。Flies 等[55]在接受放射治疗的小鼠脑胶质瘤模型中发现,VISTA敲除鼠比野生型鼠更能抵抗肿瘤生长,表明VISTA 在治疗脑胶质瘤方面有作为免疫调节靶点的潜力。小胶质细胞是中枢神经系统的髓系细胞,具有与组织巨噬细胞类似的功能,如抗原提呈、吞噬、细胞因子和趋化因子的释放等。最近研究发现VISTA 主要在中枢神经系统的小胶质细胞表达,可能通过促进抗炎细胞因子、免疫抑制分子和血管生成因子的产生而促进胶质母细胞瘤的进展[56]。Liu 等[57]已发现与VISTA 单敲除小鼠或PD-1 单敲除小鼠相比,双基因敲除小鼠在受到外来抗原攻击后T 细胞的反应幅度协同增加,支持了VISTA 和PD-1通路的非冗余免疫抑制作用。VISTA 和PD-1 的单克隆抗体进行联合阻断治疗,获得了最佳的肿瘤清除治疗效果。目前已有抗VISTA 单克隆抗体(JNJ-61610588/CI-8993)的Ⅰ期临床试验(NCT02671955),但未应用于脑胶质瘤疾病。
免疫检查点在脑胶质瘤中的研究见表1,其他检查点分子如B 和T 淋巴细胞衰减因子(B-and Tlymphocyte attenuator,BTLA)等在脑胶质瘤中的研究还在进行中。

表1 免疫检查点在脑胶质瘤中的研究
2 免疫检查点抑制剂在治疗脑胶质瘤中的研究
近年来,美国食品药品监督管理局(FDA)批准上市的单克隆抗体在不同的肿瘤中取得了良好的疗效(表2),为进行脑胶质瘤治疗的临床试验提供了合理的依据。这些临床试验检测免疫检查点抑制剂作为单药或联合靶向治疗、其他免疫治疗的疗效,主要集中在抗PD-1/PD-L1 和CTLA-4 的单抗研究,但大多正处于Ⅰ期或Ⅱ期临床研究阶段(表3)。
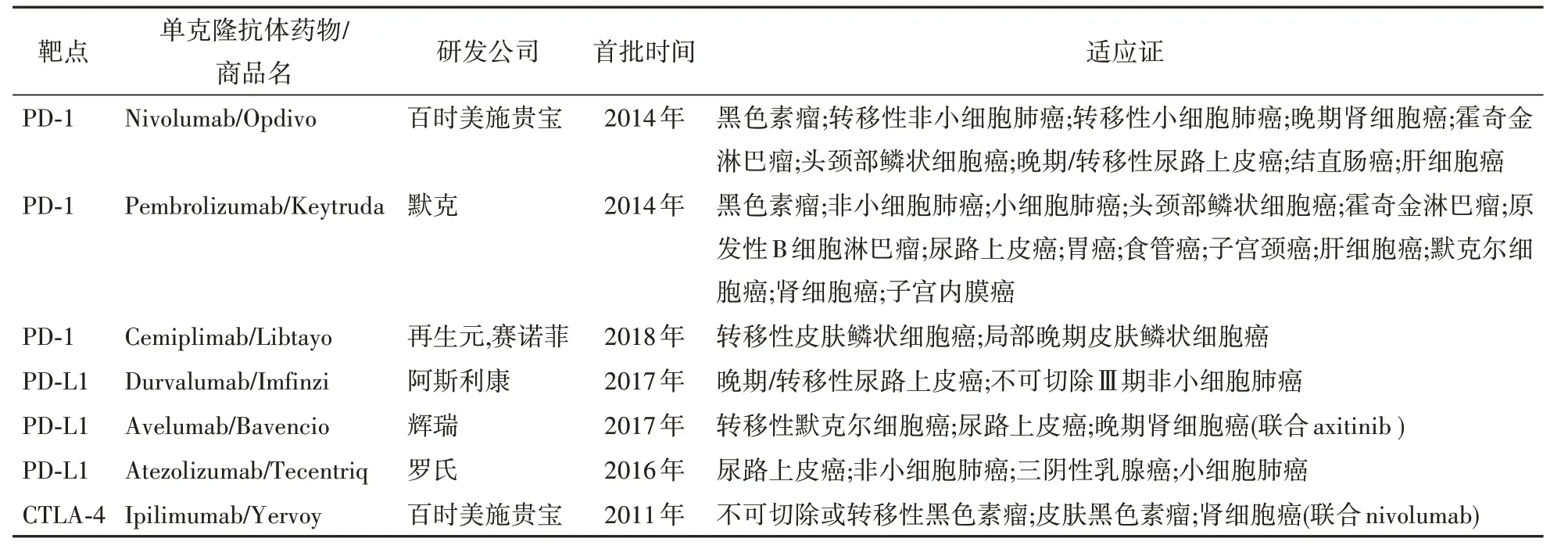
表2 FDA已批准的免疫检查点抑制剂
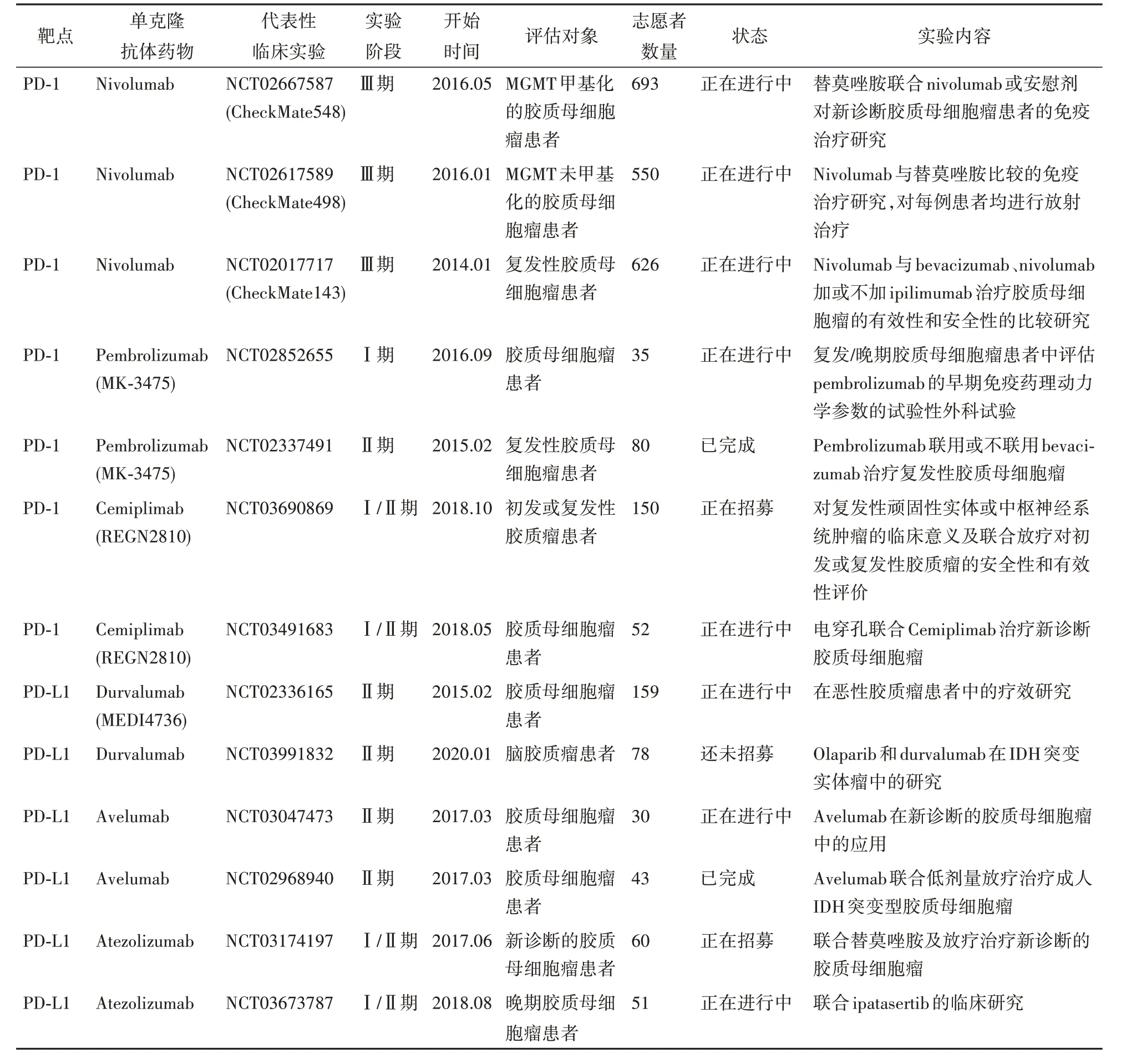
表3 免疫检查点抑制剂在脑胶质瘤中的临床研究

(续表)
在一项24 例高级别胶质瘤患者接受抗PD-1单抗派姆单抗(pembrolizumab)治疗的实验中,回顾性评估了其安全性和有效性,其中患者中位无进展生存期(progression free survival,PFS)为1.4个月,中位总生存期(overall survival,OS)为4 个月[58]。另一项Ⅰ期(NCT01375842)临床实验中,16 例复发性胶质母细胞瘤患者经过PD-L1 单抗阿特珠单抗(atezolizumab)治疗,期间耐受性良好,未报告任何严重不良事件[59]。Gorsi 等[60]对10 例复发性脑胶质瘤儿童使用nivolumab 治疗进行了回顾性分析,发现PD-L1 阳性患者的中位生存期为13.7 周,而PD-L1 阴性患者的中位生存期为4.2 周,提示nivolumab 在儿童脑瘤中的应用对高表达PD-L1 的 患 者更 有效。Carter 等[61]进 行了20 例胶质母细胞瘤患者联合使用抗CTLA-4 单抗伊匹单抗(ipilimumab)和抗血管生成药物贝伐珠单抗(bevacizumab,商品名Avastin)的研究,发现联合用药显示出良好的药物活性,其毒性远小于单用ipilimumab所产生的毒性。
然而在已报道的Ⅰ期临床试验(NCT02017717)中,Omuro等[62]将40例复发胶质母细胞瘤患者分为3组,评估nivolumab与ipilimumab单用或联用的安全性和耐受性。发现nivolumab单药治疗耐受性优于nivolumab+ipilimumab联合用药,该组合的耐受性受ipilimumab 剂量的影响。但该实验最终因使用联合用药治疗的患者产生的药物不良反应较为严重,40%的患者不能耐受治疗而被迫中止。在代号为Checkmate-143 的Ⅲ期临床试验中,进行了nivolumab 和bevacizumab 单药治疗复发性胶质母细胞瘤的效果和安全性评估,共纳入患者369 人,这是首次对PD-1 抑制剂进行的大型随机临床试验[63]。然而,2017年公布的初步结果显示,先前接受化疗和放疗的复发性胶质母细胞瘤患者用nivolumab 单药的治疗效果与bevacizumab 相比,并没有显著改善患者预后。治疗失败的原因可能是由于放疗引起的淋巴细胞减少,使得患者对PD-1的 应 答 率 较 低[64]。最 近 研 究 发 现nivolumab 和bevacizumab 的安全性一致,但联合用药并未改善患者总生存期。与此同时,两个大型Ⅲ期随机试验(NCT02617589 和NCT02667587)正 在 测 试nivolumab对甲基鸟嘌呤甲基转移酶(methylguanine methyltransferase,MGMT)甲基化或非甲基化胶质母细胞瘤患者的疗效,该类患者可能从免疫检查点抑制剂中获益[65]。
3 展 望
免疫疗法是肿瘤治疗策略中的重要组成部分,其中免疫检查点抑制剂在多种实体瘤治疗中取得了重大突破。虽然与传统的抗肿瘤药物相比,免疫检查点抑制剂不杀伤正常组织细胞,不良反应有了大幅度降低,但患者应答率相对较低,在胶质母细胞瘤中尤其如此。胶质母细胞瘤在肿瘤微环境中免疫抑制程度较高,同时免疫检查点阻断的理想治疗效果得益于患者高突变负荷,探索与免疫应答相关的候选靶点可能为提高免疫检查点阻断的临床疗效提供新的策略。
目前,免疫检查点阻断治疗脑胶质瘤的研究尚处于起步阶段。单药免疫检查点抑制剂治疗脑胶质瘤患者效果不佳,而将此疗法与其他疗法联合运用又带来严重的不良反应事件。如何在脑胶质瘤的治疗中,将检查点抑制剂与当前的放疗、替莫唑胺、bevacizumab 等的治疗标准相结合,这些药物的使用是否与积极或消极的相互作用相关,以及如何应对联合治疗引起的不良事件等问题还需研究解决。

