骨髓增生异常综合征免疫表型分析
张 伟,蒋丽君,马燕萍,包 慎,陈俊敏,魏玉萍,智 峰,李 蓉
骨髓增生异常综合征(MDS)是一组起源于造血干细胞的获得性克隆性血液病,其特点是髓系细胞病态发育,表现为无效造血、血细胞减少、造血功能衰竭,且向急性白血病转化的风险高[1]。当缺乏典型形态和细胞遗传学证据时,传统MDS的诊断方法将遇到极大的挑战。流式细胞术(FCM)在检测髓系异常造血时具有高敏感性,其逐步成为MDS诊断非常重要的辅助手段。本研究回顾性分析79例MDS以及30例非MDS患者的临床资料,评估FCM对MDS的诊断和指导治疗方面的临床价值。
1 资料与方法
1.1 一般资料:收集本院2012年1月-2020年10月初确诊MDS患者79例(低危组56例,高危组23例)和非MDS患者30例的流式免疫表型资料,非MDS为缺铁性贫血、巨幼细胞性贫血和原发免疫性血小板减少症患者。MDS患者中男42例,女37例,年龄9~86岁,中位年龄54岁;非MDS患者年龄20~82岁,中位年龄54岁。MDS 患者的诊断采用2016年WHO分型标准,其中MDS-MLD患者56例,MDS-EB1患者15例,MDS-EB2患者8例。
1.2 方法:回顾性分析所有患者的流式免疫表型资料,并对其数据进行统计分析。分析MDS患者骨髓有核细胞抗原表达情况,统计各群细胞占有核细胞比例,对比分析MDS组与非MDS组、低危组和高危组、低危组和非MDS组、高危组和非MDS组各细胞群所占比例。

2 结果
2.1 抗原表达情况
2.1.1 CD34+细胞群抗原异常表达:跨系列表达CD56(15.00%)、CD7(12.50%)、CD4(5.00%)、CD5(2.50%)、CD19(2.50%);跨期表达CD11c(22.50%)、CD15(15.00%)、CD11b(12.50%)、CD64(7.50%)、CD10(5.00%),见表1。
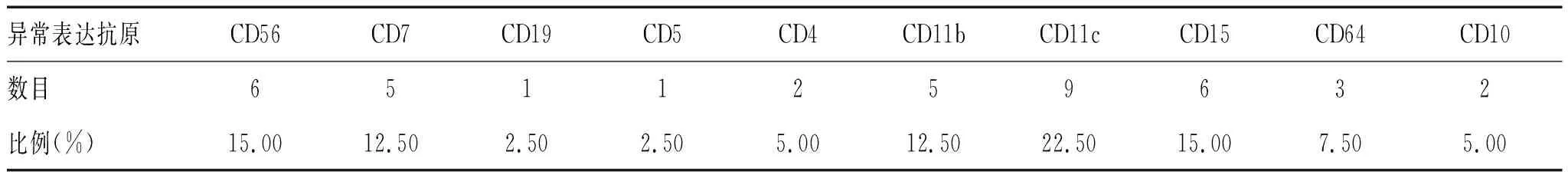
表1 CD34+细胞群抗原异常表达
2.1.2 粒细胞群抗原异常表达:CD13/16/11b发育模式异常(51.72%),跨系列表达CD56(13.79%)、CD14(2.30%)、CD36(2.30%)、CD4(1.15%)、CD7(1.15%);跨期表达HLA-DR(8.01%)、CD117(2.30%)、CD34(1.15%),表达减弱或缺失CD10(9.20%)、CD16(6.90%),见表2。

表2 粒细胞群抗原异常表达
2.1.3 单核细胞群抗原异常表达:跨系列表达CD56(75%);跨期表达CD34(15%),表达减弱CD14(10%),见表3。
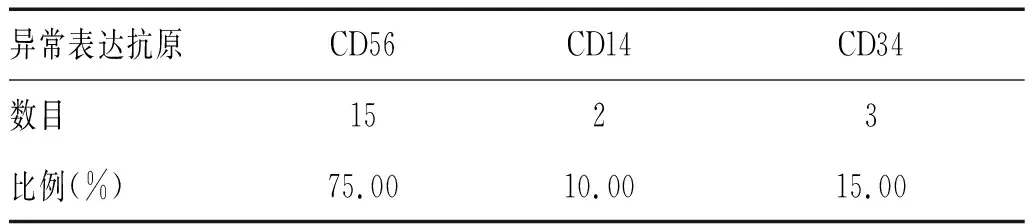
表3 单核细胞群抗原异常表达
2.2 4组患者骨髓中各细胞群所占比例比较:MDS组与非 MDS组比较,原始细胞、单核细胞、淋巴细胞明显增高(P<0.05),粒细胞明显减少(P<0.05),有核红细胞差异无统计学意义(P>0.05);低危组与高危组MDS比较,原始细胞明显减低(P<0.05),粒细胞、单核细胞、有核红细胞、淋巴细胞差异均无统计学意义(P>0.05);低危组MDS与非MDS组患者比较,单核细胞、淋巴细胞明显增高(P<0.05),原始细胞、单核细胞、有核红细胞差异均无统计学意义(P>0.05);高危组MDS与非组患者比,原始细胞、单核细胞明显增高(P<0.05),粒细胞明显减低(P<0.05),有核红细胞、淋巴细胞差异均无统计学意义(P>0.05),见表4。

表4 MDS组、低危组MDS、高危组MDS、非MDS组之间细胞群所占比例比较
3 讨论
细胞形态学和细胞遗传学检测仍是MDS诊断和分类的基石[2]。当缺乏病态造血的细胞形态表现且染色体核型正常时,应用FCM辅助诊断可疑MDS越来越受到重视。MDS系基因突变驱动的细胞发育异常,细胞形态表现为病态发育,FCM则表现为免疫表型紊乱,主要为原始细胞群较正常细胞群呈聚集性,CD45表达减弱,CD34表达呈聚集性,跨系表达CD56、CD5、CD7等;成熟粒细胞群较正常细胞群SSC减小,异常表达初期抗原CD34、HLA-DR,跨系表达CD7、CD56、CD13和CD16表达失去正常规律性;单核细胞较正常细胞表达异常,早期抗原CD34、HLA-DR、CD11b表达缺失,跨系表达 CD7、CD56[3]。
本组79例MDS患者,61例(77.22%)存在免疫表型异常,CD34+细胞群、粒细胞群、单核细胞群跨系列表达淋系抗原CD56、CD4、CD5、CD7、CD19,部分粒细胞跨系列表达CD14、CD36。Valérie Bardet等[4]研究183例MDS患者,其中31例髓系祖细胞表达淋系抗原CD5或CD7或CD56。跨期和表达缺失或减弱方面,CD34+细胞群跨期表达CD15、CD64、CD11c、CD11b、CD10;粒细胞跨期表达初期分化抗原HLA-DR、CD117、CD34、CD16,CD10减弱或缺失,CD13/16/11b发育模式异常;单核细胞主要表达早期抗原CD34、CD14减弱。MDS抗原异常表达与国内研究结果基本一致[3]。基于MDS病态造血在FCM的表现,欧洲白血病网ELN推荐FCM评估病态造血的最低要求[5]。欧阳芬等[6]采用FCM积分系统检测41例MDS患者,特异性为 90.25%,敏感性为85.40%,提示FCM对MDS免疫表型异常具有较高的敏感性和特异性。目前MDS流式积分系统正逐步完善,在鉴别可疑MDS时将会发挥越来越大的作用。
我们对各亚组数据进行对比分析发现,FCM在指导治疗上能够提供很重要信息,MDS组与非MDS组比,淋巴细胞明显增高,而低危MDS组和高危MDS组分别与非MDS组比,低危MDS组表现为明显淋巴细胞增高,而高危MDS组淋巴细胞无统计学差异。分析低危MDS组淋巴细胞增高,存在明显的免疫异常,其血细胞减少与增高的淋巴细胞介导的细胞凋亡相关,而高危MDS组更多表现为原始细胞的增殖,可能对正常骨髓造血产生抑制作用,同时提示免疫抑制治疗可能无效。Li Xiao等[7]研究34例低危MDS/16例AA患者骨髓淋巴细胞亚群,CD3+淋巴细胞百分率明显高于对照组(P<0.05),低危组MDS患者骨髓CD4+细胞向Th1和CD8+细胞向Tc1的极化状态强于AA患者(P<0.05),提示低危MDS组存在更强烈的T细胞免疫异常。凋亡是低危MDS的标志[8],可能归因于功能性T细胞反应和先天性免疫激活[9- 10 ]。以上支持低危MDS免疫抑制治疗仍是临床非常重要的治疗手段。免疫抑制剂会影响T细胞功能,研究表明免疫抑制治疗后发展为AML的风险较低[11]。
高危MDS以原始细胞增殖为主。MDS由低危MDS到高危MDS再到AML,骨髓原始细胞比例逐渐增加,即是恶性克隆逐渐扩增的过程,亦是其免疫逃逸过程。研究发现低危MDS患者细胞免疫功能亢进,随着病情进展,Th1、Ts细胞数量逐渐减少,平衡向Th2细胞偏移,机体的细胞免疫功能呈持续下降趋势,使恶性肿瘤细胞能逃避特异性的Ts细胞的杀伤而克隆增殖[12],对正常造血产生抑制。以上提示高危MDS免疫抑制治疗无效。
通过分析,FCM在诊断MDS,尤其是疑难MDS方面具有很好的临床价值。在治疗上,免疫抑制治疗对低危MDS是非常重要的治疗手段,对高危MDS无效。

