基于机器学习的重症监护病房脓毒症患者早期死亡风险预测模型
齐 霜,徐浩然,胡 婕,毛 智,胡 新,周飞虎
1 解放军医学院,北京 100853;2 解放军总医院第一医学中心 重症医学科,北京 100853
脓毒症是由宿主对感染反应失调引起的危及生命的器官功能障碍,是重症监护病房(intensive care unit,ICU)患者死亡的主要原因之一,死亡率高,短期死亡率为15%~30%,而脓毒症休克患者可高达50%[1-4]。准确的脓毒症患者死亡预测有助于临床医师判断患者疾病状态,提高治疗效率,改善不良结局,延长患者生存时间。目前有多种临床评分帮助临床医师判断脓毒症患者病情严重程度,预测不良事件的发生,如序贯性器官衰竭评分(sequential organ failure assessment,SOFA)、急性生理学与慢性健康状况评分系统Ⅱ(acute physiology and chronic health evaluation scoring system Ⅱ,APACHEⅡ)、简化急性生理学评分Ⅱ(simplified acute physiology score Ⅱ,SAPSⅡ)等。但这些评分的设定是针对整体危重症患者,并不是某种特定疾病。Knaus等[5]表示,使用患者入院初始未曾接受干预治疗的参数值计算得出的APACHE评分,对患者预后判断更加可靠。然而,脓毒症患者病情危重,要求早期采取积极有效的治疗方式以改善结局,经替代治疗后改善的生命体征或实验室检查结果,可能无法正确体现患者的实际病情。近年来,机器学习逐渐应用于医学研究中,其可根据不同临床需求及数据特征建立预测模型,与临床常用评分相比,能更好地预测不良结局的发生[6-10]。本研究基于Sepsis-3的定义筛选出重症监护医疗信息市场(Medical Information Mart for Intensive Care,MIMIC)Ⅲ数据库中符合诊断的脓毒症患者,纳入与脓毒症患者相关的生命体征、实验室检查、干预治疗等数据,建立符合脓毒症患者特点的ICU死亡风险预测模型。
资料和方法
1数据来源 从MIMICⅢ数据库中筛选患者及其信息。其包含了2001−2012年贝斯以色列女执事医疗中心(Beth Israel Deaconess Medical Center)收治的38512名成年患者(年龄≥18岁)诊疗信息,包括人口统计学信息、生命体征、实验室检查、治疗、诊断等数据,数据信息经过多次研究验证,具有较高的质量。所有遵守数据库使用要求者均可使用该数据库(https://mimic.physionet.org)[11]。MIMICⅢ数据库包含两部分数据,分别来自于CareVue系统与MetaVision系统;CareVue系统中关于患者的液体入量及部分操作记录不如MetaVision系统详细全面[12-13]。在本研究中,使用了部分液体及操作治疗信息,故只使用MetaVision系统中的数据。病例筛选流程见示意图1。

图1 病例筛选流程示意图Fig.1 Flowchart of case screening process
2脓毒症病例筛选标准 本研究采用2016年Sepsis-3标准筛选脓毒症患者,即脓毒症为怀疑感染及顺序器官衰竭评分(sequential organ failure assessment,SOFA)增加≥2分[4,12,14]。该标准适用于基于数据库的回顾性研究[15]。纳入标准:脓毒症患者,符合Sepsis-3标准。排除标准:1)年龄≤18岁;2) ICU住院时长<24 h;3)无出入量记录及数据记录不全;4)二次(或多次)入院;5)心外科监护病房,采纳同类研究的排除标准[12]。
3数据收集 参考临床经验、已发表文献及MIMICⅢ数据库数据记录情况,我们收集了以下7类数据。1)患者人口统计学信息:性别、年龄、种族、入院方式、第一次进入ICU类型等;2)进入ICU后24 h内的生命体征:心率、平均动脉压、呼吸频率、氧和指数等(最大值、最小值、平均值);3)进入ICU后24 h内的实验室检查结果:如肌酐、尿素氮、血红蛋白、INR等(最大值、最小值、平均值);4)进入ICU后24 h内的治疗情况:如经静脉补液量、尿量、是否进行机械通气治疗、肾替代治疗、利尿药物的使用等;因部分患者在入ICU24 h内使用一种以上的血管活性药物,我们使用血管活性药物评分(vasoactiveinotropic score,VIS)体现血管活性药物使用情况;5)基础疾病:如充血性心力衰竭、慢性肾病、慢性阻塞性肺疾病等;6)结局:ICU住院死亡率;7)进入ICU后24 h内的各种评分:如SOFA、SAPSⅡ等。
4数据处 对所有变量进行筛选,缺失值超过40%的变量被排除在外。缺失值插补:FiO2的缺失值均使用21%进行插补,其余缺失值均使用中位数进行插补,其中,身高及体质量缺失值分别按性别不同使用中位数进行插补。
5模型开发 我们使用了极度梯度提升(extreme gradient boosting,XGBoost)模型(1.0.0)。XGBoost是当前主流的机器学习模型,是基于树模型的提升算法,广泛应用于疾病发生的预测及患者不良结局预测等临床研究中,在多项研究中均证实XGBoost算法较其他机器学习模型的预测能力更强[16-17]。我们随机抽选数据集中70%的病例作为训练集,另30%病例作为验证集。
6统计学分析 应用PostgreSQL数据库系统提取数据。统计分析采用SPSS22.0,数据清洗、模型构建与性能评估则采用 Python(3.6.5)进行。所有连续变量以中位数(四分位数)表示,计数资料以例数(百分比)表示;连续变量单因素分析采用Mann WhitneyU检验,分类变量单因素分析使用Pearson χ2检验或Fisher精确检验。P<0.05为差异有统计学意义。选择受试者工作特征(receiver operating characteristic,ROC)曲线作为模型的评价指标。使用预测模型校准曲线判断模型的临床使用价值。
结 果
1基线特征 在MIMICⅢ数据库中共筛选出4939例患者进入队列研究,其中ICU住院期间内死亡551例,存活4388例(图1)。在研究队列中,相比存活组,死亡组年龄更高(72.90岁vs65.90岁,P<0.001),SOFA 评分(7分vs4分,P<0.001)及SAPSⅡ评分(53分vs37分,P<0.001)更高;死亡组患者合并症比例更高,如充血性心力衰竭(28.68%vs24.20%,P=0.022)、慢性阻塞性肺疾病(17.79%vs13.13%,P=0.003)、脑卒中(15.61%vs9.41%,P<0.001)、恶性肿瘤(27.04%vs22.38%,P=0.014)、肝病(13.61%vs10.80%,P=0.048);同时,死亡组入ICU后24 h内经静脉输注液体量更多(3828mLvs2 823mL,P<0.001),排出尿量更少(987 mLvs1 630 mL,P<0.001),接受更多的治疗措施,如机械通气治疗(74.95%vs46.54%,P<0.001)、连续肾替代治疗(8.17%vs3.49%,P<0.001),静脉输注氢化可的松(9.62%vs2.83%,P<0.001);死亡组在入ICU后24 h内输注白蛋白(12.70%vs6.02%,P<0.001)及血制品(28.31%vs21.44%,P<0.001)比例更高。见表1。

表1 ICU存活组及死亡组脓毒症患者基线特征比较Tab. 1 Comparison of baseline characteristics between the two groups in ICU
2XGBoost模型 脓毒症患者ICU死亡风险的XGBoost预测模型的主要超参数设置如下:max_depth=10,树的棵数n_estimators=1000,学习率learning_rate=0.1,正则化系数alpha=0、lambda=0。对特征的重要程度进行了排序(图2),排名前10位的分别是入ICU后24 h内血乳酸平均值、VIS、是否患有恶性肿瘤、天冬氨酸氨基转移酶(aspartate aminotransferase,AST)、阴离子间隙(anion gap,AG)、是否接受机械通气治疗、国际标准化比值(international normalized ratio,INR)、格拉斯哥昏迷指数(Glasgow coma scale,GCS)、重症监护病房类型、入ICU后24 h内血乳酸最大值。

图2 XGBoost模型中重要特征排名(前20名)Fig.2 Ranking of important features in the model (Top 20)
3模型预测性能评价 XGBoost模型预测脓毒症患者ICU住院死亡风险率的ROC曲线下面积(area under the curve,AUC)为0.848,敏感度0.841,特异性0.711,准确性0.726,F10.621(图3);模型性能较SAPSⅡ、SOFA、全身炎症反应综合征(systemic inflammatory response syndrome,SIRS)评分、快速序贯器官功能衰竭评分(quick sequential organ failure assessment,qSOFA)等明显提升(图4)。模型的校准曲线显示,XGBoost模型的拟合优度高于其他各项评分。当实际死亡率<30%或为55%~80%时,XGBoost模型会高估脓毒症患者死亡风险;其他情况下,该模型会低估脓毒症患者死亡风险(图5)。

图3 XGBoost模型预测测试集患者死亡风险的混淆矩阵Fig.3 Confusion matrix of the model in predicting the risk of death in the test set
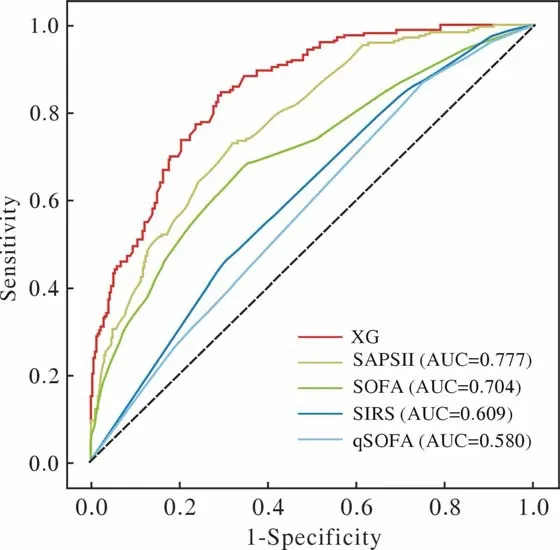
图4 XGBoost模型与各临床评分的ROC曲线Fig.4 ROC curves of XGBoost model and SAPSⅡ,SOFA,SIRS,qSOFA scores (AUC:area under the curve)
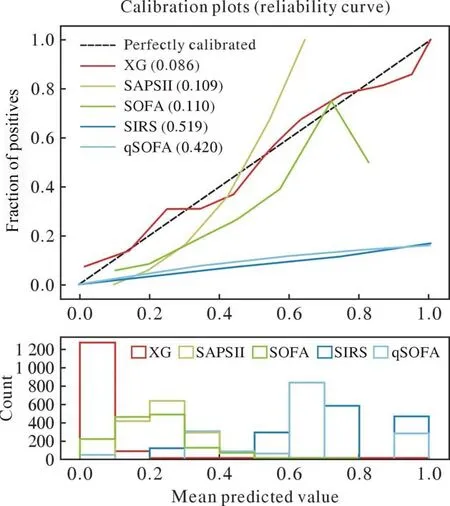
图5 用于评估XGBoost模型及各评分拟合优度的校准曲线Fig.5 Calibration curves for assessing the goodness of fit for each score and XGBoost model
讨 论
本研究建立了针对脓毒症患者的XGBoost模型预测ICU住院死亡风险,该模型AUC 0.848,敏感度0.841,特异性0.711,准确性0.726,较临床常用评分具有更好的性能。同时,研究进一步验证了血管活性药物的使用及血乳酸水平是预测脓毒症患者死亡的显著特征。
脓毒症常继发于严重创伤、感染、大手术等,其发病机制及临床表现较复杂,发病率及死亡率较高。现有的临床评分,如APACHEⅡ、SAPSⅡ、SOFA、qSOFA、SIRS等广泛应用于危重症患者病情的危险程度评估及不良预后预测。但这些评分未能针对脓毒症患者的特点,对于脓毒症患者死亡率的预测效果较差(ROC曲线下面积数值较低)[18-19]。研究表明,在原有危重病评分的基础上联合疾病诊断、治疗相关指标或联合其他评分可提高对脓毒症患者不良结局的预测效果[20-21]。模型的临床价值在于其高敏感度和高准确性,可用于识别不良结局风险较高的患者。近年来,机器学习被不断应用于临床医学中的疾病发生及不良结局的预测,如脓毒症患者心脏骤停的预测[22]、脓毒症的预测[23-24]、老年多器官功能不全患者早期死亡风险预测[25]、重症监护患者再入院结局预测等[26]。机器学习模型的预测效果明显优于危重病患者常用评分。
本研究开发的XGBoost模型发现,血乳酸水平及VIS位于模型重要特征排名的第1及第2位。Sepsis-3已表明,使用血管活性药物及血乳酸水平>2mmol/L提示脓毒症休克的发生[4]。乳酸是脓毒症休克患者死亡的独立预测因子,患者死亡率可随乳酸水平的增高而增高[27-29]。乳酸不仅预示高死亡风险,也可用于指导脓毒症治疗[30-31]。然而现有的评分中,几乎均未纳入该项指标。脓毒症的临床治疗中,常使用血管活性药物维持循环功能的稳定。在此次研究中我们采用了VIS。VIS最初被作为婴儿体外循环术后发病率和死亡率的预测因子[32]。近年来也被用于成人患者及脓毒症患者[33]。我们引入VIS以期能够更加客观地评价血管活性药物对于脓毒症患者预后的影响。同时,我们发现排名前10位的重要特征涉及凝血系统、呼吸系统、代谢系统、神经系统、肝等方面。这与脓毒症的定义是一致的。
本研究存在一定的局限性。首先,本研究是基于MIMICⅢ数据库进行的单中心研究,未进行外部数据库的验证,模型的性能需要前瞻性的研究进一步验证。其次,XGBoost模型可解释性不佳,虽然进行了特征重要性排序,但是无法评价这些特征与脓毒症患者ICU住院死亡率的因果关系。最后,因为MIMICⅢ数据库中可用数据类型的限制,一些与感染或脓毒症相关的指标(如降钙素原、白细胞介素-6等)无法纳入模型中。之后,我们将进一步将现有模型与本地数据库相结合,验证模型性能;调整参数,提高模型性能,并使模型更好地适应本地数据库。同时,延长研究时间窗,建立脓毒症患者死亡风险预测模型。
综上所述,我们使用患者的临床数据建立了XGBoost模型用于预测脓毒症患者的ICU住院死亡率,该模型的预测性能优于传统的SOFA、SAPSⅡ、SIRS、qSOFA等评分。未来,经过本地数据库的验证及不断的参数调整后,该模型可以更好地辅助临床医生进行临床决策,调整治疗方案,更好地分配医疗物资,减少不良结局的发生。考虑到MIMIC数据库中亚裔人群所占比例较低,我们将在后期的工作中纳入本地患者数据,调整模型使其更符合亚裔人群的特点。

