循环肿瘤细胞在晚期乳腺癌中的应用价值*
欧阳航,陈德波,骆时木,杨培东,吴一波,张志珊△
福建医科大学附属泉州第一医院:1.检验科;2.乳腺外科,福建泉州 362000
乳腺癌是女性最常见的恶性肿瘤,全球每年约有170万例乳腺癌新发病例,其发病率处于较高水平[1]。在我国,女性乳腺癌的发病率同样处于较高水平,发病例数及死亡例数分别占全球乳腺癌总发病例数和总死亡例数的11.2%和9.2%[2]。尽管近年来通过手术、放化疗及分子靶向治疗等方法使晚期乳腺癌的治疗效果有了较大提升,但患者5年总体生存率依然不够理想,大多数患者死于复发、转移。研究发现,在患者血液、骨髓和淋巴结中难以检测出的微小转移病灶是引起患者不良预后的重要因素[3]。当乳腺癌进展到晚期或出现复发、转移时,治疗效果非常不理想。研究表明,在早期乳腺癌患者中便可发现肿瘤细胞直接或间接通过淋巴途径进入到外周血中[4],这部分由原发灶或转移灶播散进入血液循环并存活下来的肿瘤细胞被称作循环肿瘤细胞(CTC)。在治疗期间对CTC数量进行监测能够及时反映治疗效果,可为治疗方案的可行性及患者的预后评估提供参考依据[5]。目前,关于利用CTC对晚期乳腺癌患者进行治疗效果评价的研究较少,且存有争议,因此,有必要进一步探究CTC动态变化在晚期乳腺癌中的应用价值,现将结果报道如下。
1 资料与方法
1.1一般资料 选择2018年6月至2020年1月本院乳腺外科收治的经病理检查确诊为晚期乳腺癌的女性患者43例为研究组,平均年龄(49.6±9.3)岁;临床分期:Ⅳ期27例,Ⅲ期16例;已绝经28例,未绝经15例;Ki67标记指数≥15%的有38例,<15%的有5例;雌激素受体(ER)阳性23例,阴性20例;孕激素受体(PR)阳性23例,阴性20例;人类表皮生长因子受体-2(HER-2)阳性19例,阴性24例。纳入标准:(1)女性,年龄≥18岁,具有完整的临床资料;(2)依从性好,ECOG评分为0、1或2分;(3)根据实体肿瘤的疗效评价标准1.1(RECIST 1.1),至少有1个可测量病灶。排除标准:(1)不符合晚期乳腺癌诊断标准;(2)合并其他类型肿瘤及心脑血管、肝、肾和血液系统严重疾病;(3)患者在参加本研究期间接受切除转移病灶的手术或放疗。另选取健康体检女性15例为对照组,平均年龄(38.8±8.9)岁。TNM分期采用美国癌症联合委员会(AJCC)第8版标准。本研究经本院医学伦理委员会审核批准,所有研究对象对本研究知情同意并签署知情同意书。
1.2仪器与试剂 循环肿瘤细胞差相富集试剂盒和荧光原位杂交试剂盒购自美国Cytelligen公司,正置荧光显微镜购自日本尼康公司,ThermoBrite原位杂交仪购自美国雅培公司。血清癌胚抗原(CEA)、糖类抗原125(CA125)及糖类抗原15-3(CA15-3)检测使用I2000SR全自动化学发光免疫分析仪及配套试剂盒(美国雅培公司)。
1.3方法 采用差相富集-免疫荧光原位杂交计数法(SE-iFISH)检测CTC。收集研究对象血液标本时为防止上皮细胞污染,在弃掉前2 mL静脉血后收集静脉血7.5 mL于枸橼酸钠抗凝管中,混匀,4 h内处理。通过差相富集法及试剂配套的特殊离心介质可去除血液标本中的红细胞和血浆蛋白,然后利用偶联CD45的免疫磁珠去除血液标本中的白细胞,进而富集得到CTC。进一步结合免疫荧光染色与染色体原位杂交,使用CEP8探针杂交肿瘤细胞,使用抗CD31抗体结合血管内皮细胞,从而有效鉴定出CTC。
1.3.1CEA、CA125及CA15-3检测 使用促凝真空采血管采集研究对象静脉血3 mL,2 100×g离心10 min分离血清,置于I2000SR全自动化学发光免疫分析仪中进行检测。
1.3.2结果判定 (1)CTC鉴定标准:将DAPI+、CD45-、CD31-且CEP8≠2鉴定为CTC,以CTC≥1个/7.5 mL为外周血CTC阳性。鉴定CTC需排除白细胞及异倍体循环血管内皮细胞(CEC)的干扰,白细胞鉴定标准:DAPI+、CD45+、CD31-且CEP8=2;CEC鉴定标准:DAPI+、CD45-、CD31+且CEP8≠2。(2)CEA、CA125及CA15-3阳性判断标准:CEA>3.0 ng/mL为阳性;CA125>35 U/mL为阳性;CA15-3>14 U/mL为阳性。
1.4乳腺癌患者疗效评定标准 影像学评定标准:患者治疗2个周期后通过超声或者CT 等影像学检查测量实体肿瘤的最大经,比较治疗前后差异。治疗效果分为4类,疾病进展:基线病灶最大径总和增加≥20%或者出现新的病灶;疾病稳定:基线病灶最大径总和有缩小但未达到部分缓解,或者有增加但未达到疾病进展;部分缓解:基线病灶最大径总和缩小≥30%;完全缓解:所有目标病灶消失。以部分缓解、完全缓解为治疗有效,疾病进展、疾病稳定为治疗无效。

2 结 果
2.1CTC检测结果 荧光显微镜下可见白细胞、CEC及CTC,见图1。
2.2治疗前晚期乳腺癌患者CTC检测结果 研究组43例晚期乳腺癌患者中,CTC阳性的有37例,阳性率为86.05%。阳性患者CTC的个数为(1~23)个/7.5 mL,检出的CTC总数为147个,平均值为4(1,5)个/7.5 mL。对照组15例健康体检女性中仅发现1例三倍体CTC,阳性率为6.67%。研究组与对照组CTC阳性率比较,差异有统计学意义(χ2=31.017,P<0.05)。
2.3治疗前CTC与常用肿瘤标志物诊断晚期乳腺癌的效能比较 ROC曲线分析结果显示,与CEA、CA15-3、CA125相比,CTC诊断晚期乳腺癌的曲线下面积(AUC)最大,为0.897,特异度、灵敏度、准确度分别为93.33%、86.05%、87.93%,见表1、图2。
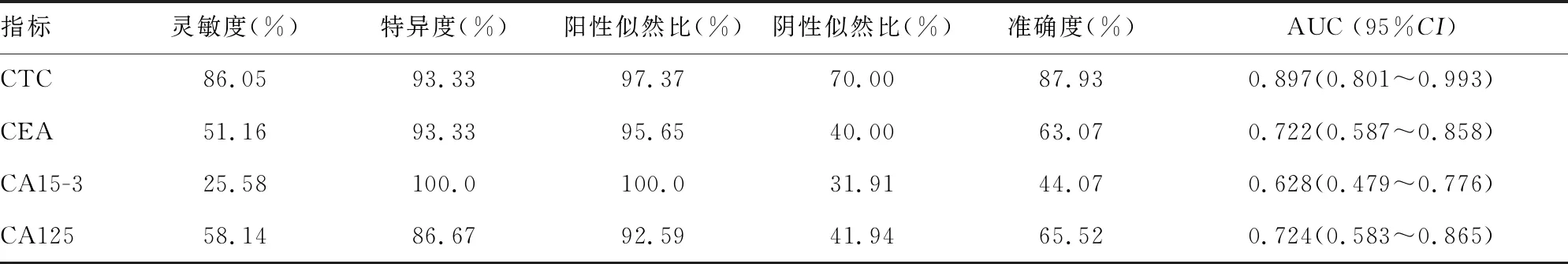
表1 治疗前CTC与常用肿瘤标志物诊断晚期乳腺癌的效能比较
2.4治疗前CTC阳性率与晚期乳腺癌患者临床特征的关系 治疗前CTC阳性率与晚期乳腺癌患者的年龄、绝经状态、临床分期、ER、PR、Ki67标记指数、HER-2均无关(P>0.05),见表2。

表2 治疗前CTC阳性率与晚期乳腺癌患者临床特征的关系(n)
2.5治疗前后CTC阳性率与患者疗效的关系 43例晚期乳腺癌患者中,有38例患者在治疗后根据影像学检查结果评估了疗效。33例治疗前CTC阳性患者中,治疗有效的有20例,治疗有效率为60.61%(20/33),5例治疗前CTC阴性患者中,治疗有效的有2例,治疗有效率为40.00%(2/5)。治疗前CTC阳性与阴性患者的治疗有效率比较,差异无统计学意义(P>0.05)。19例治疗后CTC阳性患者的治疗有效率为36.84%(7/19),低于19例治疗后CTC阴性患者的治疗有效率[78.95%(15/19)],差异有统计学意义(P<0.05)。
2.6治疗前后CTC数量变化与患者疗效的关系 在38例可随访的患者中,治疗前CTC阳性率为86.84%(33/38),治疗后CTC阳性率为50.00%(19/38),治疗后CTC阳性率较治疗前明显下降,差异有统计学意义(P<0.05)。
治疗后,57.89%(22/38)的患者治疗有效,42.11%(16/38)的患者治疗无效。与治疗前相比,治疗后CTC数量减少的有25例,治疗有效率为72.00%(18/25);治疗后CTC数量未发生改变的有6例,治疗有效率为50.00%(3/6);治疗后CTC数量增加的有7例,治疗有效率为14.29%(1/7)。治疗后CTC数量减少患者的治疗有效率明显高于CTC数量增加的患者,差异有统计学意义(P<0.05)。
3 讨 论
乳腺癌作为女性最常见的一种恶性肿瘤,因其死亡的患者占所有因肿瘤死亡患者的14%[6]。在每年新发的乳腺癌患者中,3%~10%确诊时就已经属于晚期,短期内复发、转移是导致晚期乳腺癌患者预后差及死亡的主要原因,而影像学和传统的血清学标志物难以及时有效地监测到肿瘤复发及转移情况,从而影响临床的及时治疗。近年来,CTC作为“液体活检”的良好指标,已成为乳腺癌及其他恶性肿瘤诊疗和预后评估的一个研究热点,其在外周血中的水平变化与患者发生远处转移有关。此外,在人体的骨髓中也发现存在肿瘤细胞,这些细胞被称为弥散肿瘤细胞(DTC)[7]。虽然有研究表明,DTC对乳腺癌患者具有独立的预后评估价值,存在DTC的乳腺癌患者中有30%~50%可能在10年内发生转移[8-9],但DTC的检测标本需要通过骨髓穿刺获得,这对患者来说接受度较低。而外周血标本更容易获得且可反复采集,因此,外周血中的CTC更适用于临床常规检测。已有研究表明,CTC用于预测早期乳腺癌及转移性乳腺癌患者的预后时具有较高的临床价值[5]。CRISTOFANILLI等[10]通过多中心的前瞻性研究证明了外周血CTC≥5个/7.5 mL可提示转移性乳腺癌患者预后不良,且无论是在治疗前后CTC都是乳腺癌患者预后的独立预测指标。检测CTC不仅对患者预后有提示意义,还可以辅助乳腺癌早期诊断、预测疾病进展、评估疗效,并且对临床治疗方案的选择也具有重要的指导意义[11]。
本研究采用的SE-iFISH是利用免疫磁珠筛除非肿瘤细胞,进而达到富集CTC的目的。此外,该法无须裂解去除红细胞,从而避免了低渗对CTC的损伤,其相比阳性富集法拥有更高的检出率[12],且特殊制备的免疫磁珠对非目标细胞具有极低的非特异吸附性,可提高检测的特异性。本研究发现,在43例晚期乳腺癌患者外周血中,治疗前已有37例检测到CTC阳性,证明在大部分晚期乳腺癌患者中存在CTC。治疗前CTC诊断晚期乳腺癌的灵敏度为86.05%,特异度为93.33%,AUC为0.897,均高于其他常用的肿瘤标志物(CEA、CA125、CA15-3),提示CTC对晚期乳腺癌具有较高的诊断价值。相对于LI等[13]采用CellSearch技术检测出的进展期胃癌患者CTC 阳性率为54.8%,以及李健斌等[14]采用CellCollector技术检测出的治疗前转移性乳腺癌患者CTC阳性率为74.8%,本研究中CTC的阳性率较高。这一方面可能与所采用的SE-iFISH检出率较高有关。GE等[15]采用SE-iFISH对肺癌和食管癌患者外周血中的CTC 进行检测,分别有92%和87%的检出率。GAO等[16]采用SE-iFISH检测胰腺癌患者的CTC时,检测灵敏度和特异度分别为88%和90%。另一方面可能与本研究纳入的研究对象均为病情较重的晚期乳腺癌患者有一定关系。
CTC与乳腺癌患者的预后密切相关,然而CTC与患者治疗疗效及临床特征之间的关系目前仍存在较大争议。本研究进一步分析了43例晚期乳腺癌患者的CTC阳性率与临床特征间的关系,结果显示,治疗前CTC阳性率与患者年龄、绝经状态、临床分期、ER、PR、Ki67标记指数、HER-2均无关(P>0.05),与LUCCI等[17]发现的CTC阳性率与HER-2及Ki67标记指数有关的结果存在差异。RACK等[18]研究表明,乳腺癌患者的分子分型与CTC阳性率无关。但有学者发现,Lum A型和Lum B型乳腺癌患者中HER-2阴性患者的CTC数量更多[19]。
有研究认为,CTC可监测转移性乳腺癌患者的治疗效果,在患者接受有效治疗后,外周血中的CTC数量将减少[20]。JIANG等[21]的研究表明,CTC可用于乳腺癌的疗效监测,CTC数量增加与乳腺癌的转移相关。但也有研究发现,晚期乳腺癌患者在治疗过程中CTC数量的变化与患者的疗效无关,尽管治疗后患者CTC数量下降,但这并不代表患者的治疗是有效的[22]。本研究发现,治疗后患者CTC阳性率明显低于治疗前(P<0.05),治疗后CTC阴性患者的治疗有效率高于治疗后CTC阳性患者(P<0.05),且治疗后CTC数量减少患者的治疗有效率明显高于CTC数量增加的患者(P<0.05),提示CTC可用于监测晚期乳腺癌患者的治疗效果。当出现通过影像学或仅存在非可测量病变而难以判断患者疗效的情况时,CTC监测可用于患者的疗效评估。有研究发现,治疗前CTC阴性的乳腺癌患者治疗有效率高于治疗前CTC阳性的患者[23],而本研究治疗前CTC阳性与阴性患者的治疗有效率比较,差异无统计学意义(P>0.05),推测出现结果不一致的原因可能与本研究入组患者均为晚期乳腺癌患者,治疗前具有较高的CTC阳性率,导致结果可能存在偏倚有关。
综上所述,CTC在晚期乳腺癌的诊断及疗效评估方面具有一定的临床应用价值。但本研究纳入的样本量较少,该结论还需大样本、多中心的临床研究进一步证实。

