胸主动脉腔内修复术后血管重塑的血流动力学仿真分析
杨 睿,许欢明,张薛欢,郭 伟,陈端端,熊 江
1 解放军总医院第一医学中心 血管外科,北京 100853;2 运城市第一医院 血管外科,山西运城044000;3 北京理工大学 生命学院,北京 100081
主动脉夹层(aortic dissection,AD)是由于主动脉任何部位内膜破裂导致血液通过破口流入血管壁内膜和中膜之间形成真假两腔的血管疾病,是血管外科急危重症,未经治疗患者死亡率高达80%[1]。根据夹层是否累及升主动脉,临床上将主动脉夹层分为Stanford A型(累及升主动脉)和B型(未累及升主动脉)。目前针对B型AD的治疗方法主要包括药物保守治疗和胸主动脉腔内修复术(thoracic endovascular aortic repair,TEVAR)[2]。近年来以TEVAR为主的血管腔内治疗方案因其良好的血管重塑效果和较低的围术期死亡率已成为B型AD的一线治疗手段[3-5]。有研究表明,TEVAR后假腔完全血栓化这种良好的血管重塑现象可作为较好长期结果的预测因子[6-7]。然而对于一些累及到腹主动脉甚至髂动脉的长段夹层,TEVAR后假腔重塑不尽如人意,部分病例腹段残余假腔持续通畅甚至形成夹层动脉瘤有主动脉破裂猝死的风险[8-9]。因此在术后早期如何准确预判血管重塑趋势及如何对预测不良的病例进行二次干预是临床亟需解决的问题。主动脉疾病的病理生理学及TEVAR后效果与流体力学关系密切[10],特别是近年来计算流体力学(computational fluid dynamic,CFD)技术在模拟主动脉夹层发生发展及治疗转归方面的技术优势与应用前景受到关注[11-14]。该技术基于临床采集的血管造影检查(computed tomography angiography,CTA)资料进行数值模拟研究,可提供主动脉内血液动力学参数的具体分布,包括速度、压力和壁面切应力等,由此衍生出的个性化参数可早期预测TEVAR后中远期血管重塑效果[15-16]。本研究选取两例B型AD经TEVAR治疗后主动脉远端存在多个残余裂口的病例,均完成2年以上的CTA随访。通过CFD数值模拟技术分析术后早期血液动力学参数以预测血管重塑趋势并与真实世界的中长期随访结果进行比较,通过在真实模型上封闭肾下腹主动脉残余裂口得到两个修改模型并分析相应参数的变化趋势,以期为临床二次干预的手术方式和时机提供参考。
资料和方法
1 资料 选取2016年就诊于解放军总医院血管外科的B型主动脉夹层患者2例。病例1,32岁男性,入院诊断:主动脉夹层(Stanford B型)、高血压病。术前CTA显示夹层主裂口位于左锁骨下动脉(left subclavical artery,LSA)以远26 mm,Ⅱ型主动脉弓,LSA对应主动脉弓直径29 mm。夹层向下累及右髂总动脉,腹腔干、肠系膜上动脉、左肾动脉真腔供血,右肾动脉真假腔供血。于2016年1月21日接受TEVAR治疗,所用支架为32-28-160 mm (Lifetech,China),术后随访32个月。在第18个月时因腹段真腔持续塌陷并出现下肢间歇性跛行(中度)症状遂决定二次干预,应用支架移植物封闭腹主动脉和髂动脉段残余裂口,腹段真腔重塑有所改善。
病例2,47岁男性,入院诊断:主动脉夹层(Stanford B型)、高同型半胱氨酸血症。术前CTA显示夹层主裂口位于LSA以远22 mm,Ⅱ型主动脉弓,LSA对应主动脉弓直径26 mm。夹层向远端延伸至腹主动脉分叉水平,腹腔干动脉、肠系膜上动脉、右肾动脉均为真腔供血,左肾动脉为真假腔供血,胸降主动脉远端、腹主动脉分叉附近区域假腔内可见血栓形成。于2016年9月5日接受TEVAR治疗,所用支架为28-24-160 mm(Lifetech,China)。术后随访期37个月。
2 三维形态学参数测量 本研究基于2例患者术前及术后2年内CTA影像资料,通过Mimics(Materialise,Leuven,Belgium)软件构建出两组三维几何模型(图1)。范围包括升主动脉至髂动脉远端,每个模型至少保留9个主动脉分支(头臂干、左颈总动脉、LSA、腹腔干、肠系膜上动脉、左右肾动脉、左右髂动脉)。将所有重建好的三维几何模型导入Magics软件测量三维形态学参数,包括真假腔容积、裂口的位置和大小。
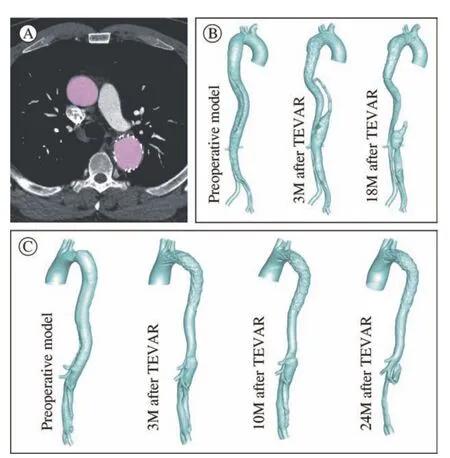
图1 主动脉三维几何模型的重建 A:CTA图像分割;B:病例1模型;C:病例2模型Fig.1 Reconstruction of 3-dimensional geometric model of aorta A: Image segmentation; B: Case 1; C: Case 2
3 血流动力学参数计算 通过比较术前和术后3个月的血流动力学参数预测真假腔转归趋势,将该趋势与最后一次随访的结果进行整体比较,以评估参数预测的有效性。同时,本研究将人为封闭残余裂口后的血流动力学参数与修改前进行比较,通过判断血流获益情况分析封闭残余裂口对血管重塑的影响。血流动力学参数计算包括模型建立、网格离散化、流体模型选择、边界条件设定和计算求解这5个主要过程。将模型导入有限体积求解器CFD-ACE+(ESI Group,Paris,France)中计算,通过求解连续性方程、动量守恒方程和N-S方程,获得模型内每个位置的速度和压强结果,并绘制相应的收缩期管壁压强分布图、峰值流速及流线分布图。计算过程中心动周期取0.89 s,计算时每个心动周期离散为100步,故时间间隔为0.089 s。为了获得稳定的计算结果,本研究对每个模型均进行连续4个心动周期的模拟,提取最后一个周期的结果作为后续分析数据。
4 个性化参数计算 首先计算真假腔压强差曲线,具体方法:沿主动脉血管方向提取真腔中心线,起点为左锁骨下动脉与主动脉弓中心线的相交位置,终点为夹层结束位置;接着在真腔中心线等距(间隔5 mm)取一系列垂直于真腔的截面,并在每一个截面中分别计算一个心动周期内真腔与假腔压强之差的平均值,从而得到真假腔压强差沿着真腔中心线方向变化的曲线。真假腔压强差曲线上第一个数值为零的位置,即真腔与假腔之间首次形成压力平衡的位置,称之为压力差第一平衡位置(first balance position,FBP)。本研究计算了TEVAR前后FBP的移动距离,以量化手术对血管重塑趋势造成的影响。
由于使用的入口血流量边界条件为设定常数,并非来自病例本身,计算时的绝对量值与病例真实值存在一定差异,故本研究沿用此前研究中已验证可行的方法[16],即将入口总心输出量定为4.5 L/min,使用血液分流比这一数值表征进入分支血管或假腔的血流量大小。通过数值模拟计算可以获得一个心动周期内进入某个裂口或分支血管的血流量,该血流量与入口一个心动周期内总血流量的比值计为相应的分流比。
5 修改模型参数计算 本研究将两个病例术后3个月的真实数值模型进行修改,模拟封闭肾下腹主动脉(包括髂动脉)上的残余裂口后得到的两个数值模型即为修改模型。真假腔压强差曲线的计算方法如前所述。已有研究证明,血液成分(粒子)在血管内皮细胞附近的滞留时间对血小板聚集、流场内血栓形成的作用至关重要[17]。由此衍生出的相对粒子滞留时间(relative residence time,RRT)可基于平均壁面切应力(time average wall shear stress,TAWSS)和震荡剪切指数(oscillatory shear index,OSI)计算得出[18-19],该参数越大表明附近形成血栓的可能性越高[17],对修改模型RRT的计算可量化假腔血栓化的速度,数值越高表明假腔内生成血栓的速度越快。具体计算方程如下。

结 果
1 三维形态学参数 通过对两个病例术前与术后3个月真假腔容积进行比较后发现,总的真腔容积增加,假腔容积减少(图1)。随着随访时间的延长,病例1在术后3 ~ 18个月假腔容积持续减少(由89.6 cm3降至49.4 cm3),而真腔容积不仅没有增加反而减少(从148.3 cm3降至142.8 cm3)。病例2在术后3 ~ 24个月假腔容积明显下降(由36.2 cm3降至8.2 cm3),而腹段真腔容积,即低位肾动脉至腹主动脉分叉之间的真腔容积,仅有少量增加(从7.9 cm3增至8.5 cm3)。
在裂口的变化上,病例1有1个主裂口和4个残余裂口,主裂口如前文所述,残余裂口分别位于腹腔干近端20 mm处、右肾动脉平面、肾下腹主动脉中段、髂总动脉远端,病例1右肾动脉被累及;在术后3 ~ 18个月,第1和第3残余裂口自动闭合。病例2术前有1个主裂口和3个残余裂口,主裂口如前文所述,残余裂口分别位于左肾动脉平面、肾下腹主动脉中下段、腹主动脉分叉附近,病例2左肾动脉被累及;术后第10个月时,第2个残余裂口同样出现自动闭合的现象。两个病例不同之处是,病例1的流出道较为典型,不会影响血液的通过,而病例2在夹层结束处的流出道裂口面积较小,仅约10 mm2。
2 压强和真假腔压强差曲线 在血流动力学方面,两个病例在术前主动脉近端均表现为真腔压力比假腔压力大,而在远端,特别是腹主动脉段,则出现假腔压力比真腔压力大的现象。尤其是病例2,腹段真假腔压强差下降尤其明显(图2)。经过TEVAR治疗后腹段假腔压力大于真腔的情况得到了明显改善,两个病例真假腔压强差大于0的区域均明显扩大。病例1的FBP移动了17.15 cm,占整个夹层长度的3.46%;病例2移动了15.47 cm,占夹层长度的3.77%。通过观察真假腔压强差曲线移动的方向和距离(图2中蓝色线-绿色线)可以看出,两个病例TEVAR后的曲线均整体向上移动且病例2的纵向移动距离明显大于病例1。从病例2收缩期压强分布图可以看出,术前假腔内压强偏大,术后残余夹层的假腔内压强明显下降(图3)。
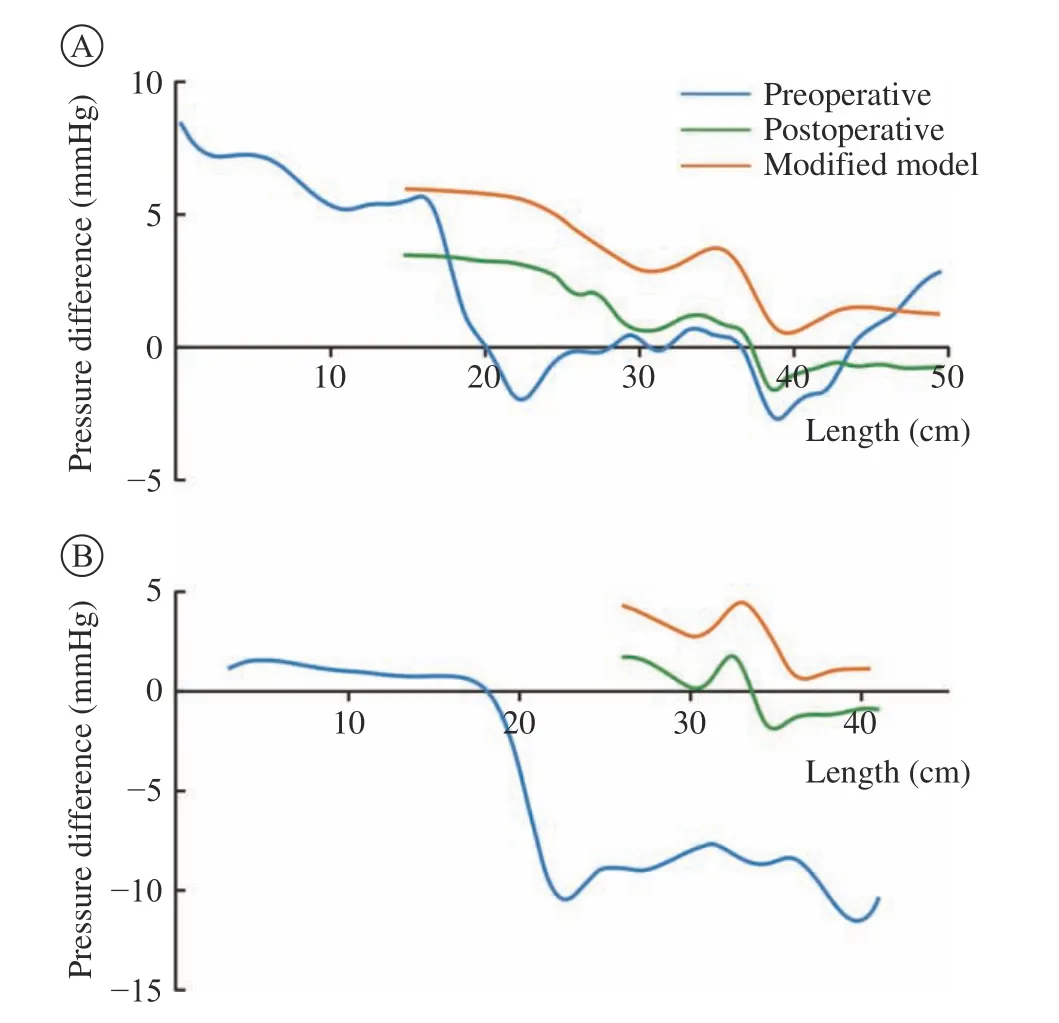
图2 病例1(A)与病例2(B)真假腔压强差曲线,横轴表示以左锁骨下动脉与主动脉血管中心线相交位置为起点,沿血管中心线延伸的距离;纵轴表示真假腔压强差数值Fig.2 Pressure difference curve between TL and FL in case 1 (A)and case 2 (B).The horizontal axis represents the distance extending along the center line of the aorta starting from the intersection of the LSA and the center line of the aorta
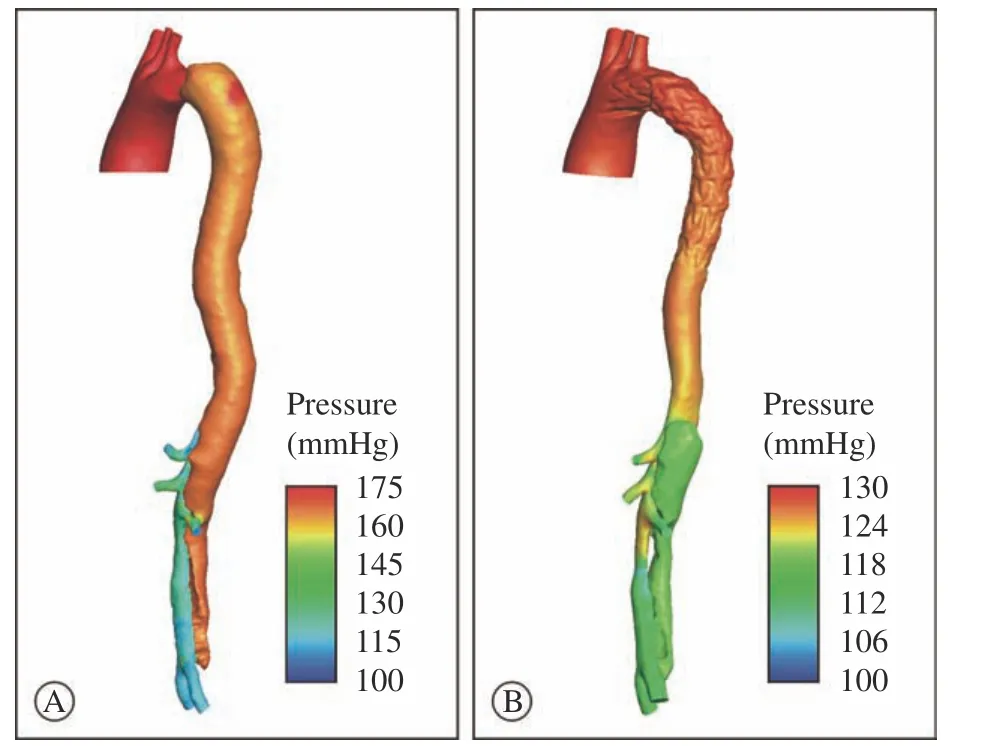
图3 病例2术前(A)与术后(B)收缩期血管壁压强分布图(红色压强最大,蓝色压强最小)Fig.3 Distribution of preoperative (A) and postoperative (B) systolic vessel wall pressure in case 2 (the red pressure is the largest and the blue pressure is the smallest)
3 流线和分流比 两个病例术前模型中真腔血流均较为稳定,部分区域流速较快,而假腔内血流紊乱(图4A左、图4B左);TEVAR后主裂口被封闭,假腔内血流主要通过远端裂口流入,在肾动脉残余裂口区域,两个病例均观察到高速喷射状血流(图4中红色箭头所示)。为了量化血流对假腔的影响,本研究计算了血流从裂口进入假腔的分流比。病例1和病例2术前经各裂口进入假腔的分流比分别为19.9%和17.3%。经TEVAR治疗后,病例1分流比降至7.22%,病例2降至2.45%。病例2假腔分流比下降更为明显与其远端流出道较小有关。从真腔进入髂总动脉的血液分流比,病例1为29.3%,病例2为37.53%。
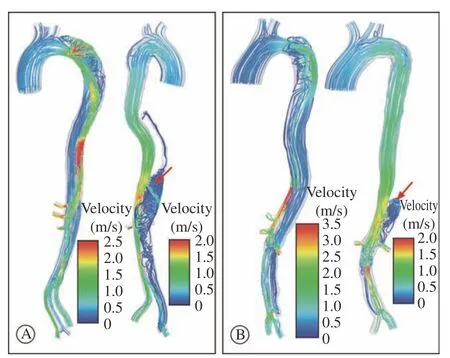
图4 病例1(A)与病例2(B)收缩期主动脉血流峰值流速及流线分布图(左为术前、右为术后;红色速度最快,蓝色速度最慢)Fig.4 The peak velocity and streamline distribution of aortic blood flow during systole in case 1 (A) and case 2 (B) (the left is preoperative and the right is postoperative; the velocity is fastest in red and slowest in blue)
4 修改模型的真假腔压强差及RRT变化 图2中黑色虚线部分是修改模型中残余夹层段的真假腔压强差计算结果,整个残余夹层段的曲线范围均大于零,表明两个修改模型在真假腔压强差获益上较真实模型更大。图5可以看出,两个病例在封闭肾下残余裂口后,假腔血流主要通过累及肾动脉的裂口流入,两个修改模型中假腔RRT的数值均较真实模型明显变大,意味着在修改模型中假腔内血栓形成更加迅速,这将有利于假腔血管的重塑。
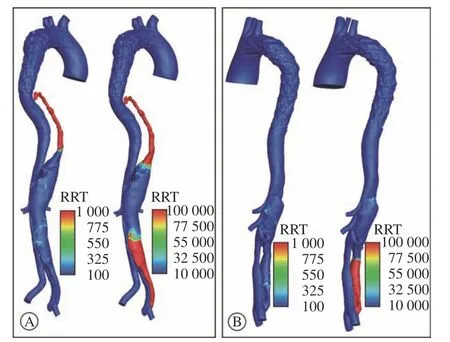
图5 病例1(A)与病例2(B)TEVAR术后RRT分布(左为真实模型,右为封闭裂口后的修改模型;红色表示数值最高,蓝色表示数值最低)Fig.5 Distribution of RRT after TEVAR in case 1 (A) and case 2(B) (the left is the real model and the right is the modified model after sealing the residual tears; red means the highest value; blue means the lowest value)
讨 论
TEVAR后血管重塑不良预测因素一直是主动脉夹层领域研究的热点[20-22]。此前的形态学研究将TEVAR后残余裂口的数量、部位、支架移植物长度等作为血管重塑的预测因素[23-25]。尽管如此,目前仍不确定哪些因素是影响个体化病例TEVAR后血管重塑的关键因素。近期一项研究表明,腹部残余裂口是腹部假腔转归不良的唯一确定的风险因素[26]。但夹层裂口在个体化病例中的具体力学表现、何时以何种方式处理腹部残余裂口、处理后将得到何种结果,目前仍不明确。本研究通过修改模型模拟二次干预的过程进行研究。
血流动力学特性对血管重塑的影响往往要早于形态学特性。近期的一项血流动力学研究通过术后早期的血流动力学相关参数预测假腔的形态变化,其结果与远期实际的形态变化具有较好的一致性[13]。因而本研究仅对术前和术后3个月获得的随访资料进行血流动力学计算和比较。
与以往形态学研究仅关注二维指标不同,本研究关注了裂口面积及真假腔容积等三维参数。此外,大部分研究仅关注术后假腔的重塑效果,而本研究同时考虑到真腔的转归,对所有随访时间点的真腔容积也进行了量化。通过容积分析发现,尽管两个病例术后早期与术前相比,总假腔容积减小、真腔容积增加,但随着随访期的延长,病例1的真腔容积没有增加反而出现了减少,而病例2腹段真腔容积的增加也并不明显。通过三维几何模型可以看出,两个病例术前均有真腔高度受压的情形,特别是在腹主动脉区域。这种情形在真假腔压强差曲线结果上得到进一步的体现。两个病例术前主动脉远端假腔压力明显大于真腔压力,特别是病例2。造成这一现象的原因一方面是近端流入道不断有血流涌入假腔对血管壁形成冲击,另一方面假腔内的血液无法及时顺畅排出,使得假腔血管壁承受的压力不断增加。而病例2的远端流出道过小(仅10 mm2),使得这种情形更为明显。这种远端流出道过小使假腔内压力增加从而不利于血管重塑的情形与此前理想模型的研究结果相似[27]。临床上此类患者如不进行手术干预极易因假腔持续高压而导致不良预后。
本研究2例患者TEVAR后进入假腔的血流均大大减少,假腔高压的状况得到了明显改善。然而,通过对TEVAR前后压强差曲线纵向移动距离的比较发现,病例1术后压力获益可能不如病例2。此外,本研究还发现病例1术后早期经真腔进入髂总动脉的血液分流比明显低于病例2(29.3%vs 37.53%)。这预示着病例1术后出现真腔扩张不良导致远端灌注不足的风险更大。而病例1在随访期间发生的情况恰恰印证了上述判断。这说明,对于远端真腔高度受压的长段夹层案例,随着术后假腔血栓化范围的扩大,残余夹层的真腔持续受到来自假腔血栓的挤压,仅行单纯TEVAR并不能改善这种真腔难以恢复扩张的窘境。
此前的研究中,笔者所在团体提出FBP这一个性化血流功能参数可在TEVAR后早期预测中远期血管重塑效果,同时可作为手术相关并发症的预测因子(如内漏、逆撕夹层),获得了国际学术界的高度评价[16,28]。两个病例术后早期FBP均向远端移动(3.46% vs 3.77%),预示着两个病例整体将获得良性转归且假腔会出现良好的重塑,而涉及真腔重塑时,则需要根据术前真腔是否受压综合考量。考虑到血液流动特点是腔内血压关系的深层原因,本研究基于流速计算绘制了收缩期峰值流线分布图并进行了分析,两个病例在术后早期肾动脉残余裂口附近均观察到高速喷射状血流,这种状态将对假腔血管外壁造成一定冲击,意味着该区域假腔不易完全闭合。两个病例在最后一次随访时均存在残余假腔且均位于肾动脉附近,印证了这一推断。
目前临床对于TEVAR后残余夹层二次干预的手术指征和时机并未形成统一的共识。有研究将真腔塌陷作为二次干预的指征之一[8]。本文将除累及肾动脉以外的残余裂口进行封闭,是为了更加真实地模拟施行二次干预的过程。目前内脏动脉区域的残余裂口处理起来困难且复杂[26,29],而封闭肾下残余裂口并不难实现。通过在术后早期模型中人为封闭肾下残余裂口构建出两个修改模型,随后进行的真假腔压强差及RRT计算表明整个残余夹层段的曲线范围均大于零,即真腔压力均大于假腔压力,修改模型压强差获益比真实模型更大,且修改模型更有利于假腔内血栓的形成。这些结果表明,修改模型将获得更好的腹段真假腔重塑效果。此外,在二次干预的时机上,应当充分考虑到夹层血管的可塑性。夹层血管壁及撕裂的内膜片随着时间会逐渐趋于僵化,这将使得二次干预的效果大打折扣。已有研究表明,急性期实施TEVAR血管重塑效果优于慢性期[4],而术后半年内不能实现血管良性重塑则预示着远期发生血管重塑不良的风险[30]。事实上,病例1虽然在TEVAR后18个月进行了二次干预,但其后的8个月,远端真腔重塑虽有改善但仍未达到理想的管径。对于真腔高度受压的长段夹层案例TEVAR后应严密随访,封闭肾下残余裂口的二次干预方案可以在血流动力学上带来较大获益;初始干预半年内接受二次干预可能更有利于远端真腔重塑。
综上,TEVAR后血管重塑是个复杂的过程,仅依靠传统影像学检查获得的形态学参数不能准确预测具体案例的转归特征,需要借助部分血流功能学参数进行判断。本课题的初步研究发现,术后早期(3个月左右)血流动力学参数或可有效预测夹层中远期血管重塑趋势,早期封闭(术后半年内)肾下残余裂口可使腹段残余夹层获得更好的重塑效果,特别是远端真腔高度受压的病例。本文存在一些不足:一方面,本课题仅选取两个长期随访病例,所得结论需要更多病例佐证;另一方面,在CFD仿真计算中,对模型做的一些理想化处理,如将血管壁视为刚性壁面,血液视为不可压缩的牛顿流体,也会对计算参数的绝对量值产生一定影响。

