利用生物信息学分析酪氨酸激酶抑制剂治疗斑秃的效应机制
王小莉 ,王用峰 ,连莉阳 ,王李雯 ,屈煦 ,张荣强 ,张志刚
(1.陕西中医药大学附属医院,陕西 咸阳 712000;2.陕西中医药大学,陕西 咸阳 712046)
斑秃(Alopecia areata,AA)是一种突然发生的局限性斑片状脱发,可发生于身体任何部位,任何年龄均可发病,人群发病率为0.9%~6.9%[1-2]。随着经济的发展和生活工作压力的增大,AA发病率逐年增加。研究表明,C3H/HeJ AA小鼠经酪氨酸激酶(JAK)抑制剂全身给药后消除了干扰素(IFN)特征并阻止了AA的发展,局部给药促进了AA皮损部位毛发再生和疾病的逆转[3]。临床实践中,AA虽有多种疗法,但目前尚无美国食品和药物管理局批准的抗AA疗法或针对AA的循证疗法[4]。临床研究发现,中重度患者经口服鲁索利替尼治疗3~6个月后,75%患者的AA皮损部位毛发几乎完全再生(92%的毛发再生),AA得到显著改善[5]。那么,JAK抑制剂治疗AA的可能效应机制是什么呢?本研究采用生物信息学技术对AA小鼠经JAK抑制剂鲁索利替尼、托法替尼治疗前后皮损皮肤组织的基因芯片数据进行分析,以期获得JAK抑制剂治疗AA的关键信号通路和生物学标志物,为JAK抑制剂治疗AA的临床应用及其机制研究提供参考依据。
1 材料与方法
1.1 数据来源 在PubMed GEO DataSets中以“Alopecia areata”为检索词检索,获得Jabbari等[6]2013年3月26日提交并于2018年8月23日更新的基因芯片数据 GSE45514(ID:5273),该数据采用Affymetrix Mouse Genome 430 2.0 Array平台GPL1261检测。该数据集共有45 101个基因表达数据,包含31个样本。根据研究设计和结果,本研究中选取鲁索利替尼(Skin-J1组)、托法替尼(Skin-J3组)干预前和干预12周皮损皮肤组织基因芯片数据,进一步深入分析。
1.2 差异表达基因的筛选和聚类分析 采用R软件(v.3.6.1)筛选Skin-J1组、Skin-J3组AA小鼠干预12周后较干预前皮损皮肤组织的差异表达基因(标准:P<0.05,q<0.05,差异倍数>2),然后通过韦恩图获得2组共同的差异表达基因,视为对该类药物均敏感的基因;采用Heatmap Illustrator在线分析绘制聚类热图。
1.3 2组共同差异表达基因本体论(Gene ontology,GO)和京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)信号通路富集分析采用Cytoscape软件对2组共同差异表达基因进行GO功能和KEGG信号通路富集分析,了解2组共同差异表达基因的生物学功能及其涉及的关键信号通路。
1.4 2组共同差异表达基因蛋白-蛋白相互作用网络(Protein-protein interactions network,PPI)的建立将2组共同差异表达基因相应的蛋白名称上传至在线分析软件 STRING 11.0(https://string-db.org/),调节可信度和附加节点参数,建立PPI网络。
1.5 GCBI基因雷达分析基因的调控网络 采用GCBI基因雷达分析(https://www.gcbi.com.cn/gcanalyze/html/generadar/index)关键基因的生物学功能。
2 结果
2.1 JAK抑制剂干预前后2组皮损皮肤组织样本差异表达基因分析 与干预前比较,Skin-J1组干预12周后皮损皮肤组织有212个基因表达水平发生显著改变,Skin-J3组干预12周后皮损皮肤组织有210个基因表达水平发生显著改变,见图1。2组皮损皮肤组织样本差异表达基因前20位分别为:Skin-J1 组(2610528A11RIK、GZMB、SLC26A7、ALDH1A3、CYP2E1、MMP13、SCGB1A1、CES1D、CCL5、APOL9A、ISG15、ADIPOQ、IFI44、IFITM6、RBP4、ALDHLA3、ZBP1、TRAV9D-3、CD8A、OASL2),Skin-J3组(KRTAP12-1、GZMA、PADI3、VSIG8、KRTAP26-1、UBD、CXCL9、PINLYP、KRT81、GPRC5D、GZMC、WFDC18、SCGB1A1、ADAMTS20、CCL5、APLNR、CXCL9、MS4A4B、CD8A、GGT1)。

图1 Skin-J1组和Skin-J3组干预12周后皮损皮肤组织差异基因火山图
2.2 2组共同差异表达基因的聚类分析 2组共同差异表达基因有18个,其中13个表达增高(CYP2J6、DLG2、DST、ESR1、GDPD2、GM20300、GUCY1A3、IL20RA、IL34、MUP10、SCGB1A1、ZFYVE21),5 个表达降低(ACOT7、BDH1、CCL5、CD8A、CXCL9),但经不同药物干预后皮损皮肤组织中各基因表达水平存在一定的差异,见图2。
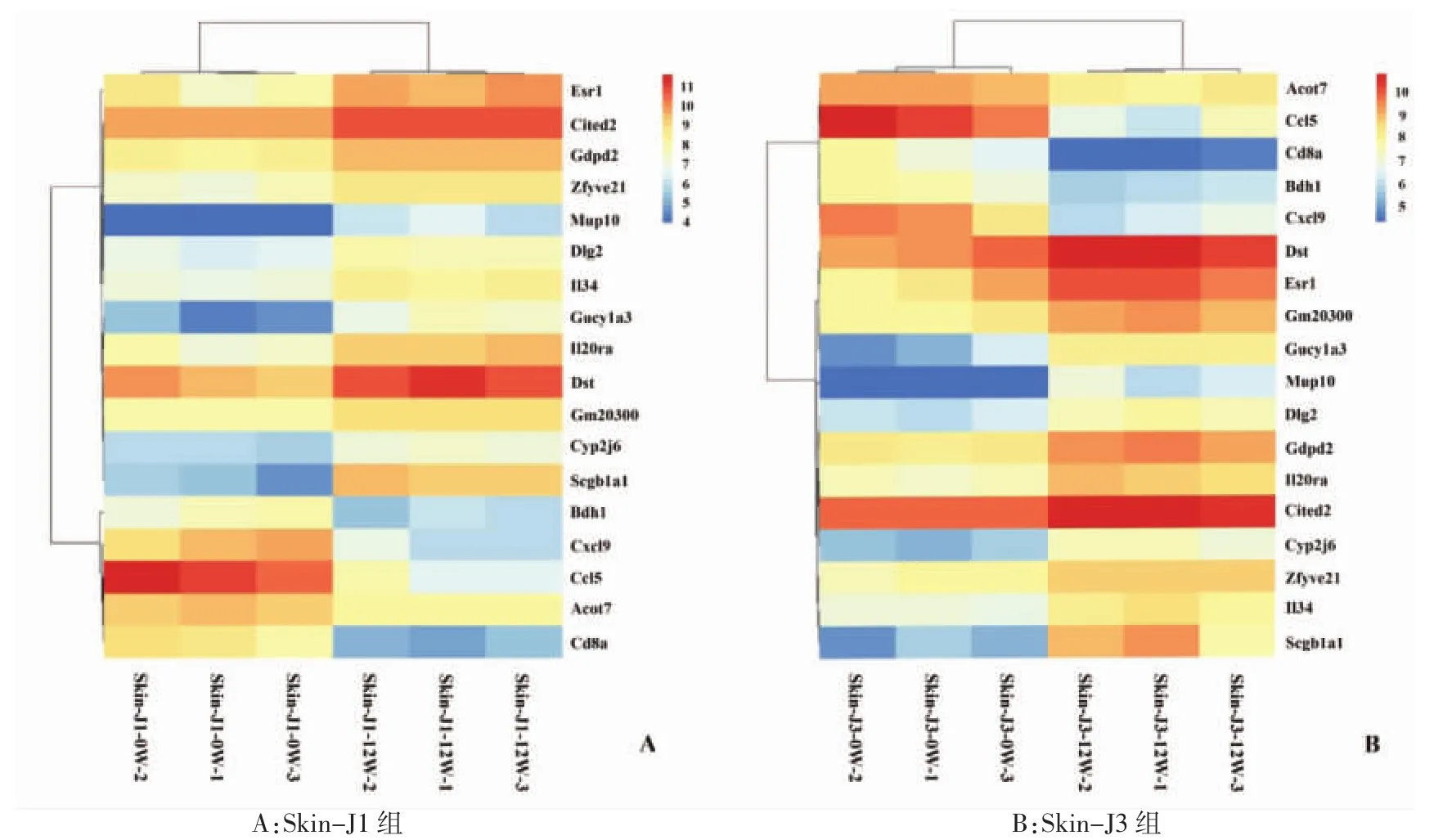
图2 Skin-J1组和Skin-J3组共同差异表达基因的聚类热图
2.3 2组共同差异表达基因的GO功能富集和KEGG信号通路分析结果 GO功能富集分析显示,2组共同差异表达基因涉及免疫系统过程调节、免疫应答、趋化因子介导信号通路、白细胞分化的正向调节等生物过程,主要发生在细胞外周、质膜、细胞表面等部位。
KEGG信号通路分析表明,2组共同差异表达基因共涉及60条信号通路(前15条见图3),主要参与细胞因子-细胞因子受体相互作用(CCL5、CCR1、CCR2、CCR3、CCR5、CSF1、CSF1R、CXCL9、CXCL10、CXCR3、IL20、IL20RA、IL20RB)、趋化因子信号通路(CCL5、CCR1、CCR2、CCR3、CCR5、CXCL9、CXCL10、SRC)等信号通路。
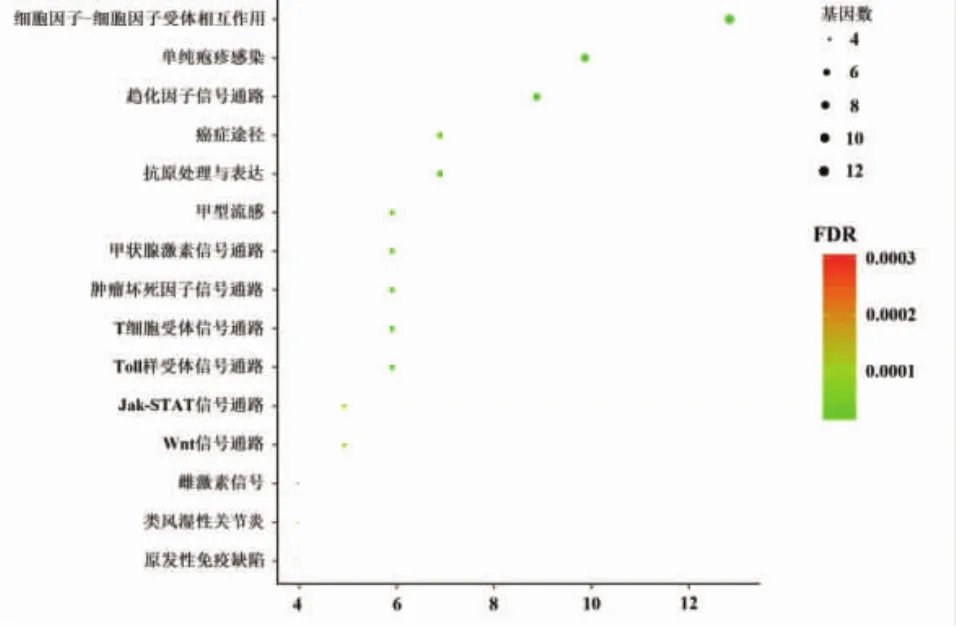
图3 2组共同差异表达基因的信号通路
2.4 2组共同差异表达基因的PPI网络 2组共同差异表达基因的PPI网络可见,差异基因形成了5个以 CCL5、CD8A、ESR1、CITED2 和 IL20RA 为支撑的子网络,其中CCL5基因通过JUN基因将以CD8A、ESR1、CITED2为支撑的子网络相互连接,见图4。提示,CCL5可能在PPI网络发挥着较为重要的作用。
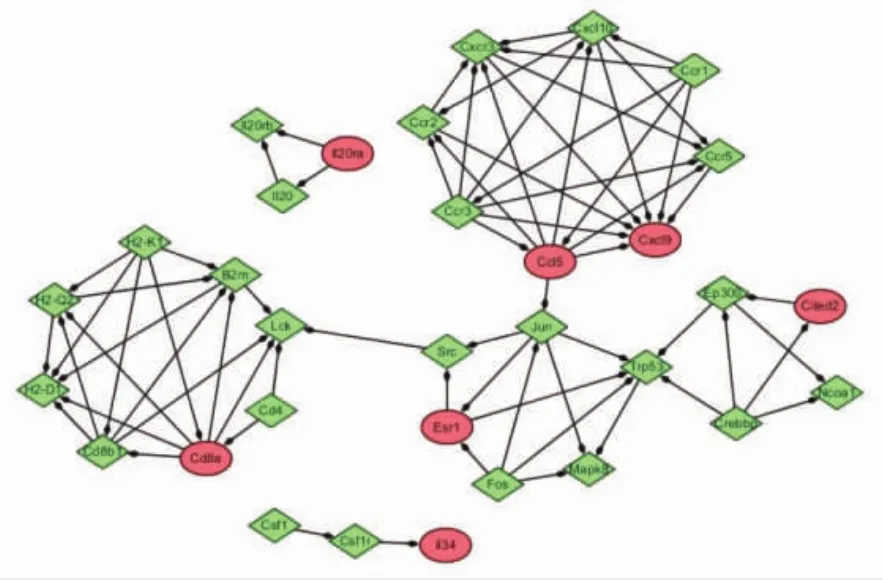
图4 2组共同差异表达基因的PPI网路
2.5 CCL5基因功能的调控网络 GCBI基因雷达对CCL5基因的功能分析显示,CCL5基因激活下游基因 CCR1~10、CXCR1~6、XCR1、CX3CR1,与炎性反应、自身免疫性疾病等相关,见图5。
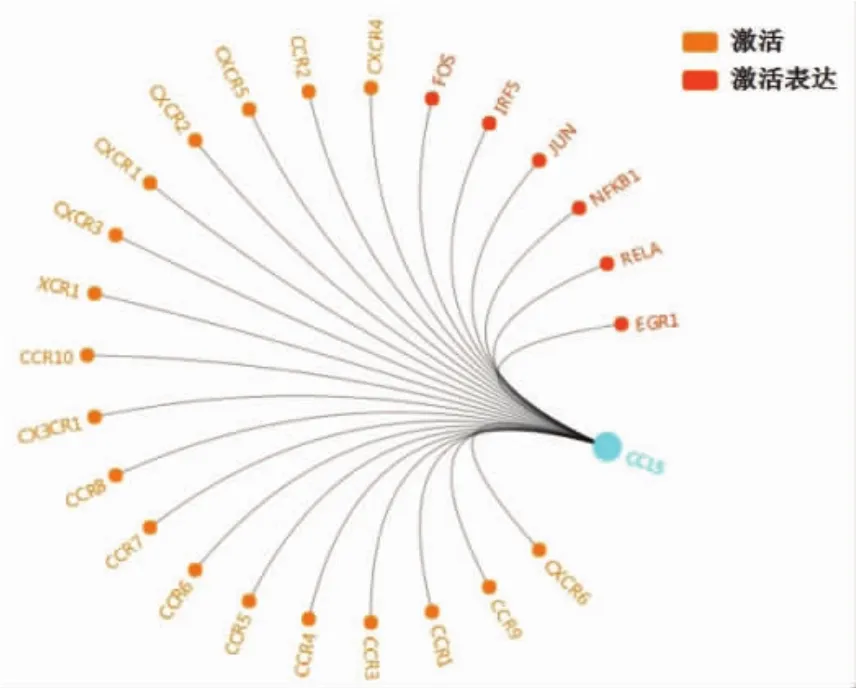
图5 CCL5基因雷达调控网络
2.6 JAK抑制剂治疗前后AA小鼠皮损皮肤组织中CCL5基因表达水平 经2种药物治疗后AA小鼠皮损皮肤中CCL5基因表达水平显著降低,见图6。

图6 2组经JAK抑制剂治疗12周后皮损皮肤组织CCL5基因表达水平情况
3 讨论
AA典型表象为突然出现的圆形或椭圆形的脱发区,可从局限性斑片状脱发继续发展出现头发全部脱失,发病年龄越小,恢复的可能性也越小。AA虽然不会危及生命,但给患者带来巨大的精神心理负担,严重影响其生活质量[7-8]。
临床实践中,AA的治疗包括局部治疗、系统治疗和物理治疗等方法,但传统方法疗效不尽如人意,部分患者病情反复发作。目前,一些新的治疗方法如JAK抑制剂、肿瘤坏死因子(TNF)抑制剂、调节性T细胞、免疫调节剂、308 nm准分子激光等逐渐在临床应用并取得较好的疗效[9]。研究表明,C3H/HeJ AA小鼠经JAK抑制剂(鲁索利替尼、托法替尼)治疗12周后毛发得到再生;3例AA患者经口服鲁索利替尼治疗5个月后头发几乎完全再生[3]。AA是一种由T淋巴细胞介导的以毛囊为靶器官的自身免疫性疾病,发病过程中炎性反应发挥着重要作用[10-11]。通过抑制JAK激酶,可抑制T细胞介导的炎性反应[12];而炎性反应由炎性反应系统和免疫细胞介导,涉及生物学信号通路及相关因子复杂。
本研究发现,AA小鼠分别经鲁索利替尼和托法替尼干预12周后,前者皮损皮肤组织中212个基因表达水平发生显著改变,后者210个基因表达水平发生显著改变,提示JAK抑制剂可通过改变这些基因表达促进AA的好转。2种药物共同差异表达基因中 CYP2J6、DLG2、DST、ESR1、GDPD2、GM20300、GUCY1A3、IL20RA、IL34、MUP10、SCGB1A1、ZFYVE21表达增高,而 ACOT7、BDH1、CCL5、CD8A、CXCL9,ACOT7、BDH1、CCL5、CD8A、CXCL9 表达降低,且各基因表达水平高低存在一定的差异,说明共同差异表达基因在鲁索利替尼和托法替尼治疗AA中的作用不同,需作进一步研究确定关键基因。
GO分析显示,2种药物治疗AA与细胞因子受体活性、免疫系统过程调节、免疫应答、趋化因子信号通路等生物学过程关系密切。这可能与AA患者皮损处毛囊周围CD4+T细胞浸润和毛囊内CD8+T细胞浸润、免疫活性水平高,而JAK抑制剂可抑制T细胞介导的炎性反应有关[12-13]。进一步分析发现,共同差异表达基因涉及的信号通路主要为细胞因子-细胞因子受体相互作用和趋化因子信号通路,且均与 CCL5、CCR1、CCR2、CCR3、CCR5 有关,可见细胞因子-细胞因子受体相互作用和趋化因子信号通路是JAK抑制剂治疗AA的重要信号通路,但需进一步明确具体的信号通路。
PPI网络可见,CCL5基因通过JUN基因将以CD8A、ESR1、CITED2为支撑的子网络相互连接。CCL5是一类调节正常T细胞表达和分泌的细胞因子,属于趋化因子CC类亚族,主要在T淋巴细胞、巨噬细胞、血小板以及特定的肿瘤细胞等表达,在炎性反应刺激时可募集先天免疫效应物和驱动适应性免疫来参与机体免疫应答,诱导白细胞向炎性反应部位浸润,在炎性疾病中发挥重要作用[14-15]。动物实验表明,兔耳增生性瘢痕组耳缘静脉血CCL5水平高于正常组[16]。临床研究发现,银屑病患者外周血CCL5、CXCL9水平均高于健康者[17-18]。本研究表明,经鲁索利替尼和托法替尼治疗后AA小鼠皮损皮肤组织中CCL5水平显著降低,说明JAK抑制剂对AA的治疗有一定的作用。GCBI基因雷达分析显示,CCL5 可激活下游基因 CCR1~10、CXCR1~6、XCR1、CX3CR1。CCL5通过与其相应受体(CCR1、CCR3、CCR4、CCR5等)结合影响自身免疫疾病的细胞免疫、体液免疫以及炎性反应过程,对免疫性疾病的发生、发展有重要作用[19-20]。其中CCR5是其最主要的受体,二者构成了CCL5/CCR5生物轴[21-22],引起下游一系列效应物的活化并产生相应级联反应。多种炎性疾病或反应都伴随着CCL5、CCR5的高表达[23-24]。本研究也发现,CCL5与炎性反应、自身免疫性疾病等相关,可考虑将CCL5作为JAK抑制剂治疗AA的生物标志物。
综上可知,AA小鼠经鲁索利替尼和托法替尼干预后皮损皮肤组织基因表达谱发生了改变,促进了AA的好转,考虑将CCL5作为2种药物治疗AA的关键生物标志物,但需进一步通过实验进行验证,并将其作为JAK抑制剂治疗AA以及其他自身免疫性疾病和皮肤病的关键生物标志物。

