丛枝菌根真菌对汞胁迫下水稻叶片生理和光合特性的影响
李信茹, 苏海磊, 周 民,2, 米屹东,2, 王凡凡, 柳慧芳, 沈亚琴, 魏 源*
1.中国环境科学研究院, 环境基准与风险评估国家重点实验室, 北京 100012 2.河海大学环境学院, 江苏 南京 210098
中国是世界上最大的稻米生产和消费国,水稻种植面积可达 3 018.9×104hm2,总产量达2.1×108t/a,约占我国粮食总产量的1/3[1]. 提高水稻产量及其抗逆性对国家粮食安全保障具有重要意义. 汞是环境中毒性最强的重金属之一,在自然界中主要以单质汞、无机汞和有机汞的形态存在,其中有机汞尤其是甲基汞的毒性最强[2]. 甲基汞和无机汞都具有很强的肾脏毒性、生殖系统毒性、免疫系统毒性和神经系统毒性[3]. 在水-土-大气的环境介质中,即使是低剂量的汞也能通过生物放大效应沿食物链进入人体,严重危害人体健康[4]. 水稻对汞具有较强的富集能力,水稻特殊的淹水生长环境有利于硫酸盐还原菌(SRB)等甲基化微生物将无机汞还原为甲基汞,极大地增加了汞在水稻中的毒性[5]. 研究表明,我国贵州万山汞矿区内稻米中总汞含量为 0.002 8~0.295 5 mg/kg,平均值可达 0.050 8 mg/kg,甲基汞含量最高可达 0.019 0 mg/kg[6-7],均高于GB 2762—2005《食品中污染物限量》规定的粮食污染物标准限值(0.02 mg/kg). 食用稻米逐渐成为我国贵州、陕西和四川等汞矿区居民汞摄入的最主要途径. 我国汞矿资源丰富,汞矿开采历史悠久,对土壤尤其是西南矿区农田造成了严重的汞污染,因此,增强水稻对汞的耐受性,减少水稻籽粒中汞富集含量对减轻人体汞暴露风险具有重要意义.
AM真菌能与80%的陆生植物形成良好的共生体系[8]. AM真菌侵染植物后形成的菌丝体极大地增加了植物根系与土壤的接触面积,促进了宿主植物吸收营养物质和水分[9-10],减少植物病害,提高植物抗病性,保证甚至促进植物在逆境中的生长发育[11-13]. 有研究表明,AM真菌能有效降低As、Cd对水稻生长的毒害作用[14-15],通过接种AM真菌,水稻生物量明显增加,净光合速率和叶绿素含量均有增加,水稻地上部重金属含量明显降低,有效降低了重金属通过食物链传递的潜在危害.
目前有关AM真菌的研究大多集中在As、Cd等重金属,有关Hg、水稻和AM真菌三者之间关系的研究较少. 为此,该文通过接种AM真菌进行温室盆栽试验,设置低、中、高3个Hg投加量梯度,选取接种和未接种AM真菌的水稻作为研究对象,测定水稻光合生理指标和抗氧化酶系指标,比较不同Hg投加量下AM真菌对水稻生长的影响,旨在探索AM真菌对不同Hg投加量下水稻生长的影响,以期为更好地将AM真菌应用在水稻生长及提高水稻抗逆性方面提供理论指导.
1 材料与方法
1.1 供试材料
所用水稻品种为镇糯20,来自安徽省铜陵市义安区农业农村局的友情馈赠.
选用菌种为摩西球囊霉(BGC BJ05A)和幼套球囊霉(BGC XJ04B)混合菌种,购自北京市农林科学院植物营养与资源研究所,每10 g菌种中含282个孢子,接种菌剂为含有孢子和菌丝的菌根真菌及寄主植物根段的根际混合土壤,并按照10 g/kg AM真菌菌剂的比例进行接种.
土壤采自江苏省常熟市某农田. 将土壤风干,过2 mm筛,高压灭菌锅121 ℃下灭菌2 h备用,土壤理化性质见表1. 试剂盒购自青岛科创质量检测公司.
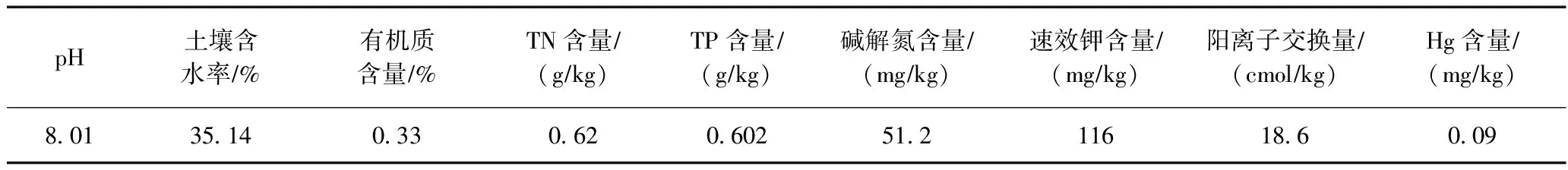
表1 供试土壤理化性质
1.2 试验设计
试验地点位于中国环境科学研究院温室,温度为22~30 ℃,湿度为50%~90%,恒温箱人为光照(10 000 lx)12 h. 选择颗粒饱满的水稻种子,在气候箱内进行恒温育苗,育苗时间为20~30 d,育苗结束后,挑选长势相近的水稻苗备用. 水稻苗移栽前用10%的过氧化氢灭菌,再用清水洗净. 种植容器为高20 cm、直径16 cm的不漏水圆形聚乙烯花盆,使用前用10%的过氧化氢及75%的酒精擦拭2~3次. 每盆装2.5 kg土,提前加入配制好的氯化汞(HgCl2)老化1个月. 老化结束后,水稻移栽同时,向每盆接种组加入25 g AM真菌〔土样(kg)与AM真菌(g)质量比为1∶10〕,AM真菌放置于土面之下10~15 cm处. 试验共设置4个Hg投加量梯度,分别为0、0.1、1.0和2.0 mg/kg. 每个梯度分别设置AM真菌接种组和未接种组,每组各设置3组平行,共24盆,定期浇Hoagland营养液.
1.3 试验指标测定
1.3.1菌根侵染率
水稻生长到第30天时取水稻根系进行菌根侵染率的测定. 采用曲利苯蓝染色法测定菌根侵染率[16].
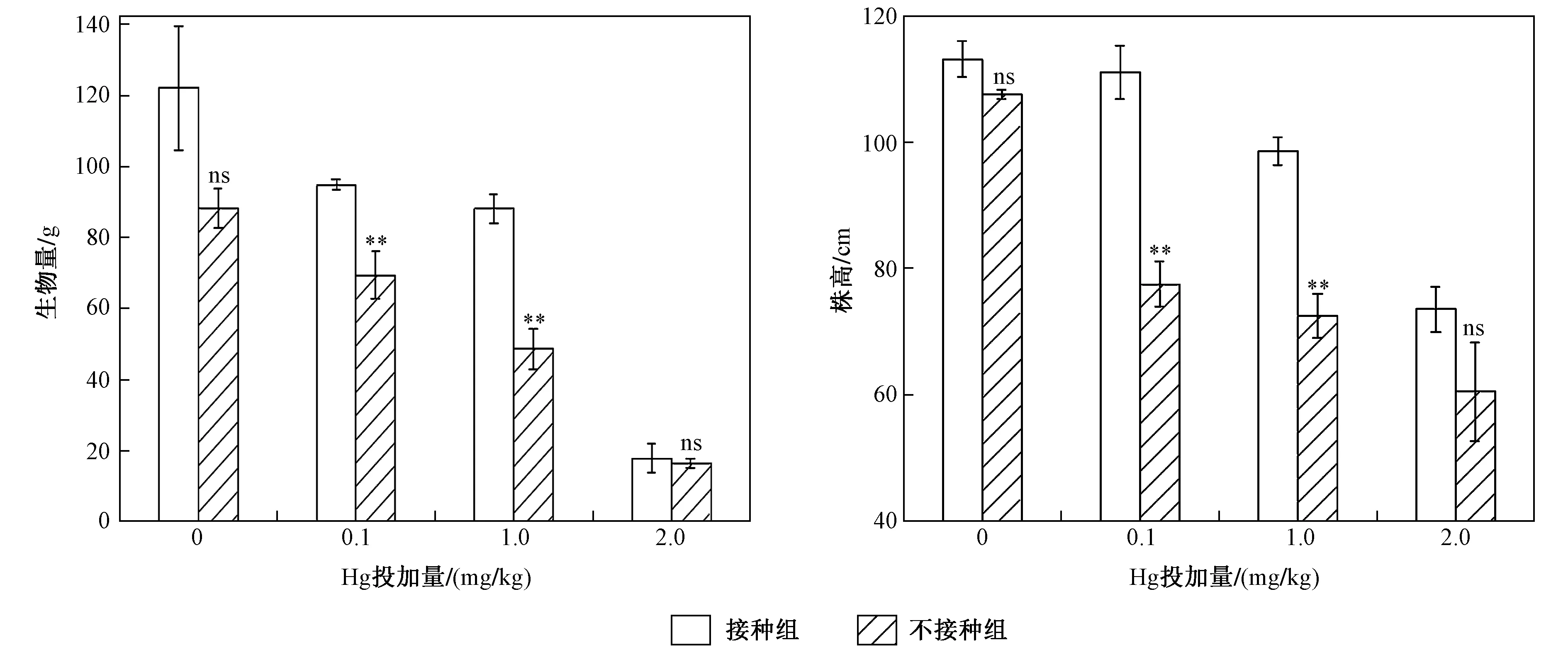
注: 数据为3次重复的平均值±标准偏差. ns表示无显著差异,*为P<0.05,表示差异显著;** 为P<0.01,表示差异非常显著; *** 为P<0.001,表示差异极显著. 下同.图1 不同Hg投加量下接种AM真菌对水稻植物株高和生物量的影响Fig.1 Effects of rice biomass and height inoculation with/without AM fungi on under different Hg addition levels
1.3.2水稻株高、生物量的测定
水稻生长到第150天时,收获水稻,并用卷尺测定水稻株高,70 ℃下烘干至恒质量,称量水稻生物量.
1.3.3叶绿素相对含量测定及光合指标测定
水稻生长到第60天时采集水稻叶片进行水稻叶片叶绿素相对含量及光合指标的测定.
采用手持式叶绿素测定仪(托普TYS-B,浙江托普云农科技股份有限公司)测定叶片总叶绿素含量. 每盆水稻选取3片顶叶测定叶绿素相对含量(SPAD),重复测定4次,取平均值.
采用光合作用测定仪(托普3051D,浙江托普云农科技股份有限公司)测定净光合速率(Pn)、气孔导度(Gs)、胞间CO2浓度(Ci)、水分利用效率(WUE). 光合指标测定时间为10:00—12:00.
1.3.4水稻叶片抗氧化酶系及MDA含量测定
水稻生长到第60天时采集水稻叶片进行水稻叶片抗氧化酶系的活性及MDA含量的测定.
水稻SOD酶、POD酶、CAT酶、APX酶的活性及MDA含量均采用植物酶联免疫分析法测定. 具体试验步骤按酶试剂盒说明进行.
1.3.5水稻叶片可溶性糖和可溶性蛋白含量测定
水稻生长到第60天时采集水稻叶片进行水稻叶片可溶性糖和可溶性蛋白含量测定.
水稻叶片可溶性糖含量采用蒽酮法测定[17]. 水稻叶片可溶性蛋白含量采用考马斯亮蓝法测定[18].
1.4 数据处理方法
所有统计分析数据采用Origin 2018进行均值、标准误计算及制图;采用统计分析软件SPSS 25对数据进行单因素方差分析.
2 结果与分析
2.1 AM真菌接种对水稻生长的影响
不同Hg投加量下AM真菌接种组均在一定程度上被侵染,当Hg投加量分别为0、0.1、1.0和2.0 mg/kg时,接种组菌根侵染率分别为24.04%、19.45%、16.40%和15.54%. 结果显示,AM真菌与水稻已形成共生体系,并通过这一共生体系对水稻产生直接或间接影响.
不同Hg投加量下水稻植株生物量与株高如图1所示. 由图1可见,在不同Hg投加量下接种AM真菌均可以提高水稻生物量及株高,当Hg投加量分别为0、0.1、1.0、2.0 mg/kg时,水稻生物量分别增加了38.66%、36.89.%、81.68%和8.51%,水稻株高分别增加了5.12%、43.23%、35.86%和22.49%. 显著性差异分析结果表明,外源Hg投加量为0和2.0 mg/kg时,AM真菌对水稻株高和生物量并没有显著影响,而当Hg投加量为0.1和1.0 mg/kg时,AM真菌能显著提高水稻生物量和株高.
2.2 AM真菌对不同Hg投加量下水稻光合生理特性的影响
如图2所示,与未接种AM真菌组相比,接种AM真菌导致水稻叶片净光合速率增加,且不同Hg投加量下接种组净光合速率的增幅不同. 与对照组相比,Hg投加量分别为0、0.1、1.0和2.0 mg/kg时,净光合速率增幅分别为15.11%、48.18%、135.85%和134.88%,其中Hg投加量为1.0和2.0 mg/kg时净光合速率增幅最大. 与未接种AM真菌组相比,接种AM真菌增加了水稻叶片气孔导度,且不同Hg投加量下气孔导度增幅不同. 与对照组相比,Hg投加量分别为0、0.1、1.0和2.0 mg/kg时,气孔导度增幅分别为40.00%、200.00%、133.33%和42.86%,其中Hg投加量为0.1 mg/kg时气孔导度增幅最大. 与未接种AM真菌组相比,接种AM真菌导致水稻叶片水分利用效率增加,且不同Hg投加量下水分利用效率增幅不同. 与对照组相比,Hg投加量分别为0、0.1、1.0和2.0 mg/kg时,水分利用效率增幅分别为76.93%、5.08%、35.12%和74.79%. 其中Hg投加量为0 mg/kg时水分利用效率增幅最大,Hg投加量为0.1 mg/kg时水分利用效率变化最小. 与未接种AM真菌组相比,接种AM真菌对水稻叶片胞间CO2浓度的影响各有不同. 其中,与未接种组相比,未添加Hg的接种组胞间CO2浓度有所增加,而在Hg胁迫条件下,水稻胞间CO2浓度均较未接种组有所降低,Hg投加量分别为0.1、1.0、2.0 mg/kg时,胞间CO2浓度降幅依次为14.58%、1.94%、9.86%.
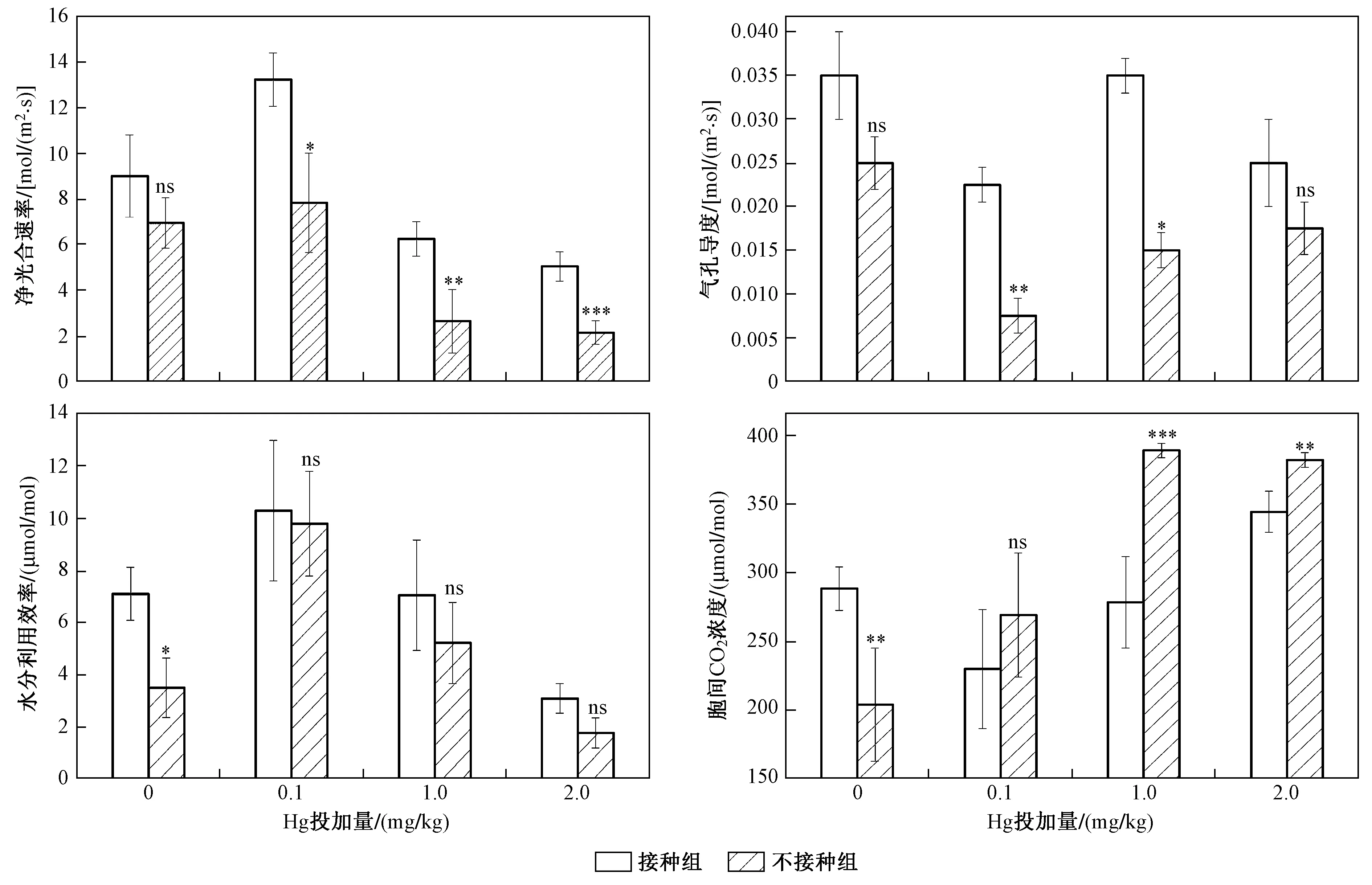
图2 不同Hg投加量下接种和未接种AM真菌对水稻光合特性的影响Fig.2 The photosynthetic characteristics of rice inoculated with/without AM fungi under different Hg addition levels
对于叶绿素相对含量(SPAD),在不同Hg投加量下,AM真菌均能增加水稻叶片叶绿素相对含量,当Hg投加量为0、0.1、1.0和2.0 mg/kg时,叶绿素相对含量增幅依次为8.17%、28.79%、17.92%和12.96%. 当Hg投加量为0.1 mg/kg时,接种AM真菌后,水稻叶绿素相对含量增幅最大(见图3),说明AM真菌极有可能通过促进水稻叶片光合色素的分泌来促进光合速率.
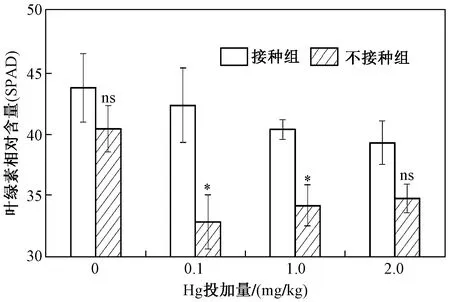
图3 不同Hg投加量下接种和未接种AM真菌对水稻叶绿素相对含量的影响Fig.3 The chlorophyll content of rice inoculated with/without AM fungi under different Hg addition levels
2.3 AM真菌对不同Hg投加量下水稻叶片抗氧化酶活性和膜系统的影响
在不同Hg投加量下接种AM真菌对水稻叶片抗氧化酶活性的影响如图4所示. 由图4可见,与未接种组相比,接种AM真菌能提高水稻叶片SOD活性,且不同Hg投加量下接种AM真菌对水稻叶片SOD活性的影响不同. 其中,Hg投加量为0.1 mg/kg时,SOD活性增幅最大,为19.06%,其次是Hg投加量分别为1.0、0和2.0 mg/kg时,增幅依次为8.24%、1.07%、1.00%. 与未接种组相比,接种AM真菌能提高水稻叶片POD活性,且不同Hg投加量下接种AM真菌对水稻叶片POD活性的影响不同. 其中,Hg投加量为0 mg/kg时AM真菌能显著增加POD活性,增幅为15.82%,Hg投加量为0.1 mg/kg时水稻叶片POD活性增加最少,增幅为2.17%,当Hg投加量分别为1.0和2.0 mg/kg时,POD活性增幅依次为5.97%和11.88%. 与未接种组相比,接种AM真菌能提高水稻叶片CAT活性,但增长差异不明显,Hg投加量为0、0.1、1.0和2.0 mg/kg时,水稻叶片CAT活性增幅依次为4.28%、3.00%、9.96%和4.73%. 对于APX,接种AM真菌能显著提高水稻叶片APX活性,当Hg投加量分别为0、0.1、1.0和2.0 mg/kg时,与未接种组相比,接种AM真菌时水稻叶片APX活性的增幅依次为33.03%、11.05%、13.45%和23.58%,其中,Hg投加量为0.1 mg/kg时,APX活性增幅最少,Hg投加量为0 mg/kg时增幅最大.

图4 不同Hg投加量下接种和未接种AM真菌对水稻抗氧化酶系的影响Fig.4 The antioxidant enzyme system of rice inoculated with/without AM fungi under different Hg addition levels
对于MDA,接种AM真菌能降低水稻叶片MDA含量,当Hg投加量分别为0、0.1、1.0和2.0 mg/kg时,与未接种组相比,接种AM真菌时水稻叶片MDA含量的降幅依次为10.97%、10.39%、1.55%和2.17%,其中Hg投加量为1.0和2.0 mg/kg时,其降幅最小,未添加Hg的试验组和Hg投加量为0.1 mg/kg时的降幅最大(见图5). 抗氧化酶系活性能表征水稻叶片细胞受重金属毒害作用的强弱,一般来说,重金属胁迫下,植物叶片氧化还原稳态被破坏,为了抵御这一毒害作用,水稻抗氧化酶系活性会增加,以缓解已被破坏的氧化还原稳态. 该研究证实,AM真菌能促进抗氧化酶系活性增加,继而缓解细胞毒害,调节叶片细胞体内氧化还原稳态.
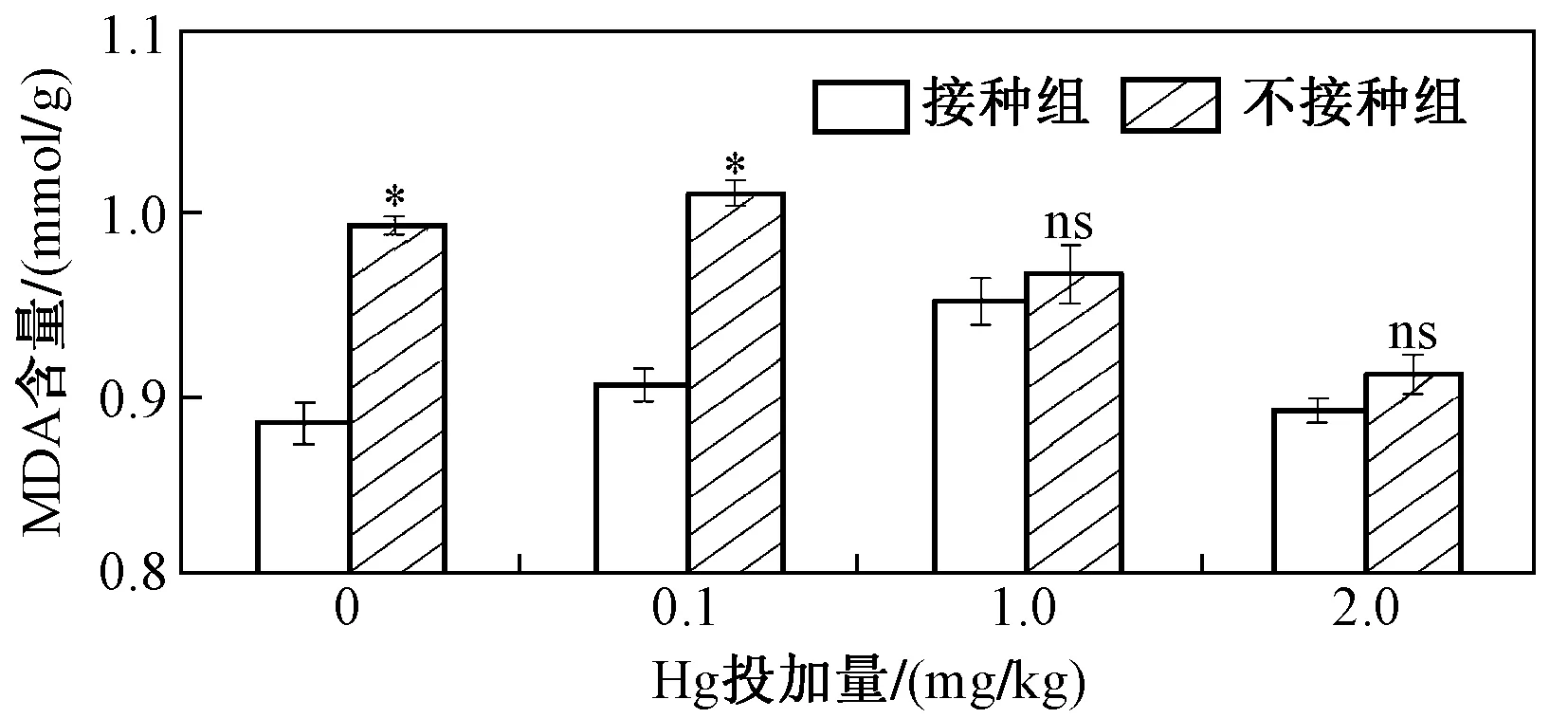
图5 不同Hg投加量下接种和未接种AM真菌对水稻MDA含量的影响Fig.5 The content of MDA of rice inoculated with/without AM fungi under different Hg addition levels
2.4 AM真菌对不同Hg投加量下水稻叶片可溶性糖和可溶性蛋白的影响
如图6所示,Hg投加量下接种AM真菌对水稻叶片可溶性糖含量有一定影响,当Hg投加量为0 mg/kg 时,AM真菌降低了水稻叶片可溶性糖含量,在外源添加Hg后,AM真菌均能促进水稻分泌可溶性糖. 接种AM真菌条件下,Hg投加量分别为0.1、1.0和2.0 mg/kg时,水稻可溶性糖含量增幅依次为43.14%、60.69%和21.21%. 同时,不同Hg投加量下,AM真菌对水稻可溶性蛋白含量的影响各有不同. 当Hg投加量为0、1.0 mg/kg时,AM真菌能促进水稻分泌可溶性蛋白,而当Hg投加量为0.1和2.0 mg/kg时,AM真菌能抑制水稻叶片分泌可溶性蛋白. 不同Hg投加量下,AM真菌对水稻可溶性糖和可溶性蛋白含量的影响不同,影响程度也各异,这可能与Hg投加量相关[19],水稻本身对外界胁迫具有一定的适应能力,这一适应能力与水稻自身的抗性及外界胁迫强弱相关,因此,水稻可溶性糖和可溶性蛋白可能对Hg的浓度更为敏感,在Hg胁迫下,水稻叶片可溶性糖和可溶性蛋白含量的影响需要更加关注Hg浓度的影响.
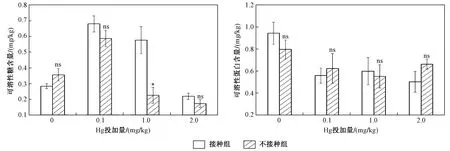
图6 不同Hg投加量下接种和未接种AM真菌对水稻可溶性蛋白和可溶性糖的影响Fig.6 The content of soluble proteins and soluble sugars of rice inoculated with/without AM fungi under different Hg addition levels
3 讨论
3.1 AM真菌对不同Hg投加量下水稻生物量和株高的影响
植物生物量和株高是植物生长状况评价最直观的指标,能够直接反映植物对逆境的抗性. 该研究发现,在各Hg投加量下,接种AM真菌均增加了水稻生物量和株高,这与Alam等[20]的研究结果一致,他们发现在砷污染土壤中接种AM真菌能增加小扁豆生物量. 研究证实,AM真菌可显著促进Hg胁迫下水稻的生长,其机制可能是AM真菌与水稻共生体形成后,数量繁多的根外菌丝极大地扩大了植物根系表面,有利于水稻根系从土壤根系吸收水分、养分等营养物质[21].
3.2 AM真菌对不同Hg投加量下水稻光合生理特性的影响
植物光合作用与植物体内有机物的积累情况息息相关,一般来说,植物体内的有机物积累量越多,说明植物光合作用越强,植物将CO2同化为有机物的能力就越强[22]. 一般认为,影响叶片光合作用的因素分为气孔因素和非气孔因素[23]. 气孔因素是指由于气孔导度降低、CO2进入叶肉细胞受阻,从而导致叶肉细胞光合速率降低的现象[24]. 当光合速率降低、胞间CO2浓度降低且气孔导度降低时,气孔因素是影响叶片光合作用的主要因素[25];反之,当光合速率降低、胞间CO2浓度升高或不变、气孔导度升高时,非气孔因素是影响叶片光合作用的主要因素. 该研究发现,在未接种AM真菌的条件下,当Hg投加量大于0.1 mg/kg时,水稻叶片光合速率、气孔导度均随Hg投加量的增加而逐渐降低,气孔导度随之升高,说明此时影响水稻叶片光合速率的最主要因素是非气孔因素. 接种AM真菌后,同样是Hg投加量大于0.1 mg/kg 时,水稻叶片光合速率、胞间CO2浓度和气孔导度均随Hg投加量的增加而逐渐降低,说明由于气孔导度降低,CO2进入叶片受阻,继而影响叶片光合作用,此时影响叶片光合作用的最主要因素是气孔因素. 同时,该研究发现,接种AM真菌后,水稻叶片光合速率、水分利用效率均呈先增后减的趋势,并在Hg投加量为0.1 mg/kg时净光合速率最高,这与孙永娣等[26]的研究结果一致,他们发现,随着Hg投加量的升高,茅苍木的光合速率也呈先增再减的趋势,并在Hg投加量为1.0 mg/kg时达到峰值. 这说明低浓度的Hg能促进植物光合速率的增加[27].
与未接种组相比,接种组水稻叶片光合速率、气孔导度和水分利用效率均增加,说明AM真菌能促进水稻同化CO2生成有机物,增强水稻抗逆性. 有研究[28-29]表明,Hg胁迫条件下,植物叶片叶绿素含量会明显降低. 随着Hg投加量的增加,水稻叶绿素含量逐渐降低,接种AM真菌后,水稻叶绿素含量明显增高,结合显著性差异分析结果可知,当Hg投加量为0.1和1.0 mg/kg时,AM真菌能显著影响水稻叶绿素相对含量,说明AM真菌能通过促进光合色素分泌来提高水稻叶片光合速率. 在复合污染场地上,AM真菌同样具有较高的提高植物抗逆性的能力,王宇涛等[30]发现,在Cd、Cu复合污染下,接种AM真菌能提高玉米的株高、生物量以及叶绿素含量,说明AM真菌提高植物的抗逆性的方式之一可能是增加叶绿素含量,缓解重金属对光合作用的抑制[31].
3.3 AM真菌对不同Hg投加量下水稻抗氧化酶系的影响
MDA是膜质过氧化最重要的产物,通过MDA可以了解膜质过氧化的程度,以间接测定膜系统受损程度和植物抗逆性. 该研究发现,Hg胁迫条件下,接种AM真菌均降低了水稻叶片MDA含量,说明AM真菌能有效缓解Hg对细胞膜系统的毒害作用,增加植物抗逆性. 这与彭昌琴等[32]的研究结果一致,他们发现,AM真菌接种组及未接种组中凤仙花中MDA的含量基本都随着Cd浓度的增加而增加,但在同一Cd浓度下,AM真菌接种能降低MDA含量,说明AM真菌在每种Cd浓度下均能降低植物细胞膜质过氧化作用,继而缓解重金属毒害.
Hg、Cd等重金属会促进植物体内活性氧的产生,破坏植物细胞氧化还原稳态,最终导致细胞损伤[33-34]. 抗氧化酶系能清除细胞内多余的活性氧,恢复细胞稳态,通过测定抗氧化酶活性,能了解植物细胞所受到的重金属毒害作用强弱. 沈亚琴等[35]以玉米为研究对象,同样研究了Sb胁迫下玉米的生长及抗氧化酶系活性,结果表明,SOD、POD、CAT的活性较未接种组均显著增加,单因素方差分析结果显示,AM真菌对玉米SOD、POD、CAT的活性均有显著影响. 同样,该研究结果证实,AM真菌能有效增加水稻叶片SOD、POD、CAT、APX的活性,说明AM真菌能通过提高植物抗氧化酶系活性来缓解重金属毒害作用,进而提高植物抗逆性. 显著性差异结果分析表明,不同Hg投加量下,AM真菌对水稻抗氧化酶活性的影响更为显著,说明AM真菌更有可能通过提高抗氧化酶活性提高植物抗逆性. Neera等[36]研究表明,在Cd污染条件下接种AM真菌,毛竹抗氧化酶系活性有所增加,且随着Cd浓度的增加,AM真菌对毛竹抗氧化酶系活性影响更为显著. 陈志鹏等[37]以紫花苜蓿为研究对象,通过接种AM真菌,研究Sb胁迫下紫花苜蓿的生长状况,结果表明,不同Sb浓度下AM真菌对抗氧化酶系的活性影响各有不同,说明AM真菌对重金属Sb的作用受Sb浓度的影响,这与笔者所得结果类似,尽管AM真菌促进了水稻抗氧化酶系活性的增加,但是在不同Hg投加量下,AM真菌对水稻抗氧化酶系活性影响的显著性各有不同,因此,AM真菌对水稻的抗氧化酶系活性影响是否存在某一最适汞浓度仍需进一步分析.
3.4 AM真菌对可溶性糖和可溶性蛋白的影响
植物体内的可溶性蛋白大多数是参与代谢的酶类,是用来了解植物体总代谢的重要指标[38],可溶性蛋白能帮助植物维持细胞较低的渗透势,增加细胞的持水能力,这一特性在低温及干旱条件下更为明显[39-41]. 可溶性糖是主要的渗透调节物质,能够提高细胞膜和原生质体的稳定性,并在植物细胞体内无机离子浓度过高时起到保护酶类的作用[42-43]. 赵匠等[44]研究了盐胁迫条件下AM真菌对黄檗的影响,结果显示,AM真菌能通过促进黄檗可溶性蛋白分泌来提高黄檗抗逆性. 孙晨瑜等[45]的研究也发现,AM真菌的施加能有效增加植物机制根系分泌物中可溶性糖和可溶性蛋白含量,而水培条件下这一促进作用并不明显,这可能因为AM真菌是好氧微生物,水培条件下AM真菌生长及侵染情况有待进一步研究,结合笔者研究中AM真菌对水稻可溶性糖和可溶性蛋白的影响并不显著这一结论进行分析,表明水稻的淹水环境对AM真菌生长确实产生了一定影响,但影响程度还需要做进一步研究.
4 结论
a) 在不同Hg投加量下,接种AM真菌均能有效增加水稻株高及生物量,当Hg投加量为0.1 mg/kg时,水稻株高和生物量较未接种组的增幅最大.
b) 在不同Hg投加量下,接种AM真菌能有效提高水稻光合速率. 接种AM真菌后,当Hg投加量大于0.1 mg/kg时,影响水稻叶片光合作用的因素从非气孔因素转变为气孔因素. 在Hg投加量为0.1 mg/kg时,接种及不接种AM真菌条件下,水稻叶片光合速率均最强,表明水稻对低浓度Hg具有一定耐受性.
c) 随着Hg投加量的增加,接种AM真菌条件下水稻抗氧化酶系活性均有所增加. 接种AM真菌能通过提高抗氧化酶系活性来降低细胞内活性氧含量,继而维持细胞稳态,增强水稻对Hg的抗逆性.
d) 接种AM真菌能有效增加水稻可溶性蛋白和可溶性糖含量、降低MDA含量. 在Hg投加量为1.0 mg/kg时,接种AM真菌对水稻可溶性糖含量的促进作用最明显,而可溶性蛋白含量的改变趋势并不明显. 当Hg投加量为0.1 mg/kg时,MDA含量的降幅最明显,表明接种AM真菌能减少细胞质膜损伤,降低重金属对水稻植物的毒害作用.

