磷酸盐和钙的添加对Bacillus C075矿化重金属Pb的影响
汤 鼎, 王 晖, 姜 毅, 赵兴青
常州大学环境与安全工程学院, 江苏 常州 213164
铅(Pb)因具有熔点低、延展性好、耐蚀性强等独特性能,已被广泛用于铅汽油、汽车、铅酸电池等领域中[1]. 同时由于人类活动的增加,如采矿、电池制造、汽油消耗以及有色金属的开采等,在过去5年中,全球有超过80×104t的Pb被释放到环境中[2-3]. 重金属Pb具有难降解性和长期持久性,可通过食物链对人类的生理健康造成严重威胁[4]. 人体中的痕量Pb会损害器官、智力、骨骼发育、肾脏以及神经系统等功能[5-7],因此Pb污染的治理迫在眉睫. 目前土壤中修复Pb的途径主要有物理法、化学法和生物法. 但是传统的物理化学方法(如化学沉淀、离子交换和吸附等)都有其局限性,包括去除率低、成本高、操作复杂、对土壤结构和理化性质造成影响以及产生其他有毒物质等[8-9]. 微生物因其生物选择性好、无毒和无二次污染等特点引起了人们的广泛关注,被认为是一种成本低、前景好的新技术[10-12].
在生物修复技术中,微生物诱导的P矿化是一种新型土壤修复方法. 在P矿化过程中,通过添加P,微生物产生的代谢产物(如磷酸酶)可以增加P的利用率,然后介导有毒离子矿化[13-15]. 通过P(如磷粉或磷灰石)对土壤进行处理后可以增强焦晶石〔Pyro[Pb5(PO4)3X (X为Cl、F、OH)]〕的形成,并且该矿化物的溶解度(Ksp,10-85~10-60)极低,因此以焦晶石形式存在的Pb对环境的危害极低,在土壤修复矿化方面极为有利[16-17].
近年来,国内外在微生物矿化重金属方面开展了一系列研究. Macaskie等[18]发现革兰氏阴性菌Citrobactersp.可通过磷酸化产生大量磷酸氢根离子,并在细胞表面形成矿物质以从溶液中去除重金属镉(Cd),其去除率可达到65%. Jin等[19]发现进行P增溶处理的Enterobactersp.可通过将Pb固定为不溶性的磷酸铅矿物质来抵抗Pb. Ryan等[20]用羟基磷灰石对土壤进行改良,孵育240 d后通过扩展的X射线吸收精细结构(EXAFS)的光谱发现,土壤中Pb的平均局部分子键和环境发生变化,并显示出化学提取物与焦晶石的高度相似性,表明P的加入可将土壤中的Pb转化为焦晶石. 然而,目前关于利用微生物矿化处理重金属Pb污染的研究大多集中在通过微生物本身处理Pb污染方面,并且处理效率低且修复过程缓慢,而忽视了加入其他物质(如P和Ca)提高修复效率的可能性.
因此,进一步探讨提高微生物修复土壤中Pb的效率具有重要的现实意义. 在利用微生物修复重金属Pb的过程中,加入P可以有效提高其对Pb的矿化效率. 在Pb污染的土壤中同时加入P和Ca可以进一步促进Pb有效性的降低,原因可能是降低了重金属对微生物的毒害作用,以及形成了某种新的矿化物并且增加了更多吸附位点,进而降低了土壤中Pb的有效性[21].
该研究利用从安徽铜陵狮子山矿区周边重金属污染土壤中筛选出的一株对Pb耐受的菌株BacillusC075,在进行微生物矿化重金属的试验中加入P和Ca,研究P和Ca对微生物和重金属Pb矿化率的影响. 通过添加P和Ca分析微生物矿化重金属Pb的最佳c(Ca2+),通过动力学曲线、FT-IR和XRD分析酶和官能团对菌株矿化Pb的影响以及矿化物的主要成分,根据SEM-EDS和BET分析菌株和矿化物的形貌结构以及矿化过程中菌株表面产生的变化,进而深入了解P和Ca在微生物矿化Pb的过程中作用及其重要性,以期为更加有效去除土壤中的重金属Pb提供依据.
1 材料与方法
1.1 菌株筛选及培养
选用菌株是从安徽铜陵狮子山矿区周围重金属污染土壤中分离出来的一株耐Pb芽孢杆菌,其编号为BacillusC075 (GenBank登录号为MK907784). 将该菌株接种到LB培养基(鱼粉蛋白胨浓度为10 g/L,NaCl浓度为5 g/L,酵母浸膏浓度为5 g/L)中,并置于37 ℃、170 r/min的恒温摇床中培养.
1.2 P和Ca的添加对细菌生长的影响
一般情况下,BacillusC075能将Pb矿化成矿化物沉淀Pb5(PO4)3OH,由该矿化物的化学分子式可知,Pb和P的分子比为5∶3,在该矿化试验中所用母液为c〔Pb(NO3)2〕=10 mmol/L和c〔Ca(NO3)2〕=100 mmol/L的溶液,分析P对微生物的影响试验中所用母液是c(KH2PO4)为6 mmol/L和c〔Ca(NO3)2〕分别为10、50、100、200、500 mmol/L的溶液. 将试验分为2组,每组均设置3个平行试验. 在2组含有pH为7.0的75 mL LB培养基中分别加入KH2PO4溶液10 mL〔c(P)为0.6 mmol/L〕和无菌水10 mL,最后均加入OD600=1.0 nm的菌株溶液5 mL. 将样品置于37 ℃、170 r/min的恒温摇床中振荡培养24 h,并每隔3 h取1 mL菌液用分光光度计测其OD600值,以此确定P对菌株生长的影响.
为了探讨不同c(Ca2+)下细菌的生长情况,在含有pH为7.0的75 mL LB培养基中分别加入KH2PO4和Ca(NO3)2溶液10 mL,设置体系c(P)为0.6 mmol/L,c〔Ca(NO3)2〕分别为0、1、5、10、20、50 mmol/L,且在每组锥形瓶中接种OD600=1.0 nm的菌株溶液5 mL,无菌水定容至100 mL(每组均设置3个平行试验). 将样品于37 ℃、170 r/min的恒温摇床中培养24 h,并每隔3 h取一次样,用紫外分光光度计测其OD600值,通过c(Ca2+)对细菌生长的影响情况确定最佳的c(Ca2+).
1.3 Ca的添加对细菌耐受性的影响
基于1.2节的试验数据,设置体系c(Ca2+)为10 mmol/L. 将试验分为3组(每组试验3个重复),加菌组中每锥形瓶含有65 mL LB培养基均加入OD600=1.0的菌株溶液5 mL,菌+Pb组加入Pb(NO3)2溶液10 mL〔c(Pb2+)为1 mmol/L〕,菌+Pb+Ca组加入Pb(NO3)2溶液10 mL〔c(Pb2+)为1 mmol/L〕和Ca(NO3)2溶液10 mL〔c(Ca2+)为10 mmol/L〕,所有反应组用无菌水定容至100 mL. 将3组样品置于37 ℃、170 r/min的恒温摇床中培养24 h,每隔2 h取一次样,用紫外分光光度计测其OD600值,通过菌株的生长量确定Ca添加对细菌Pb耐受性的影响.
1.4 P和Ca的添加对Pb2+矿化的影响
将矿化试验分为4组(每组试验3个重复),加菌组中每锥形瓶含有65 mL LB培养基均加入OD600=1.0的菌株溶液5 mL和Pb(NO3)2溶液10 mL〔c(Pb2+)为1 mmol/L〕,菌+Pb+P组加入KH2PO4溶液10 mL〔c(P)为0.6 mmol/L〕,菌+Pb+P+Ca组加入KH2PO4溶液10 mL〔c(P)为0.6 mmol/L〕和Ca(NO3)2溶液10 mL〔c(Ca2+)为10 mmol/L〕,空白对照组为不接菌的Pb(NO3)2溶液+LB体系,所有反应组均用无菌水定容至100mL. 将这4组样品置于摇床中,在37 ℃、170 r/min下振荡培养24 h,观察其沉淀情况,离心后取其上清液,用火焰原子吸收光谱法测其Pb2+的浓度.
1.5 菌株矿化Pb的动力学曲线
配制c(Pb2+)分别为10、20、50、100、200 mg/L的重金属溶液,调节pH为7.0,分别向其中加入5 mL的菌液,在37 ℃下水浴加热. 反应2 h后测定上清液中残留的c(Pb2+),计算反应初速率V0,绘制1/V0-1/c(Pb2+)曲线,并计算最大酶促反应速率(Vmax)和米氏常数(Km)[22].
1.6 FT-IR及XRD分析
将干燥的样品研磨后,以样品与溴化钾(光谱纯)以体积比1∶100混合进行压片,在10 t/cm2下静压2 min. 采用Perkin-Elmer-Spectrum One型傅里叶变换红外光谱仪(Nicolt A vatar 370,美国尼高力仪器公司)收集波长范围为 4 000~500 cm-1处的红外光谱数据,且其扫描准确度为4 cm-1[23].
利用D-MAX2500型X-射线衍射仪(XRD,日本理学株式会社)对沉淀物的矿物成分进行测定. 制样方法同上,样品充分干燥后研磨至300目(48 μm),即可上机测定. 试验条件:电压40 kV,管电流100 mA,CuKα=1.540 56 Å,扫描角度(2θ)为5°~80°,误差小于0.02°,在0.02°/(0.2 s)条件下收集数据[24]. 所得结果用MDI Jade 5和Origin 8.0分析软件进行编辑处理.
1.7 SEM-EDS和BET分析
采用将离心(8 000 r/min,5 min)收集到的沉淀物先用2.5%戊二醛固定液固定1.5 h,离心后的沉淀再用乙醇按30%、50%、70%、90%、100%的梯度分别脱水15~20 min,将干燥后的样品研磨后喷金后即可上机. 试验用样品在稳定电压15 kV的条件下,利用JSM-6360 LA型扫描电子显微镜&能谱仪(SEM & EDS,日本电子株式会社)对矿物沉淀的结构形态进行观察,并且利用EDS对矿物沉淀成分进行详细的元素分析. 最后再利用介孔材料比表面积及孔径分析仪(BET ASAP2020,美国康塔仪器公司)对矿化物的比表面积、孔径和吸附能力进行分析.
2 结果与讨论
2.1 P和Ca的添加对细菌生长的影响
P和Ca的添加对BacillusC075的影响如图1所示. 图1(a)表明,有、无P添加对BacillusC075的生长过程以及进入对数期的时间基本一致,其生长量变化也极小,进一步证明当添加c(P)为0.6 mmol/L时对BacillusC075的生长有一定促进作用. 李文飞等[25]以枯草芽孢杆菌(Bacillussubtilis)为培养对象,并通过在培养基中不添加P和添加P来分析P对菌株生长的影响,结果是添加P的菌株具有更大的生长直径和更高的OD值. 这说明P对菌株生长没有抑制作用,与试验结果一致.

图1 P和Ca添加对Bacillus C075菌株生长的影响Fig.1 The effect of P and Ca addition on strain Bacillus C075
由图1(b)可见,添加c〔Ca(NO3)2〕为0、1、5、10、20、50 mmol/L的一系列试验中培养的细菌生长过程趋势一致,但是加Ca组的细菌进入对数期的时间比不加Ca组的要短,并快速进行分裂繁殖,当达到稳定期时,加Ca组比不加Ca组的OD600值要高. 从图1(b)也可以看出,在一定浓度范围内,随着c(Ca2+)增加,细菌浓度也随之增加,且在c(Ca2+)为10 mmol/L时细菌浓度最高,但是当c(Ca2+)继续增至50 mmol/L时,Ca2+对细菌生长存在明显的抑制效果. Zhao等[26]发现,添加Ca2+可以有效降低重金属对Bacillussp. T124的毒害作用,从而使得菌株活性增加,这是因为Ca2+能够结合部分重金属从而降低重金属在环境中的浓度. Bhattacharya等[27]发现,加入Ca2+后,粘液链球菌(Streptococcusmarcescens)和阴沟肠杆菌EMB19(EnterobactercloacaeEMB19)的活性明显提高,并且对重金属的去除率更高. 王新花等[28]利用施氏假单胞菌(Pseudomonasstutzeri)诱导碳酸钙共沉淀对Pb进行修复试验,发现细菌生长量会随着c(Ca2+)的提高表现为先增后减,表明存在一个最佳Ca2+投加量. 在各种浓度Cd2+胁迫下,添加一定量的Ca2+能促进幼苗生长,当c(Ca2+)为10 mmol/L时,菌株生长量最高,表明Ca2+和K+对Cd2+的胁迫作用存在最佳浓度效应[29]. 因此后续试验中加Ca组菌株能维持较高OD600,这样有利于保持高浓度的菌株并维持反应持续进行.
2.2 Ca的添加对细菌耐受性的影响
由2.1节试验结果可知,P的添加对BacillusC075的生长有促进作用但并不显著,因此该部分着重讨论Ca2+对细菌耐受性的影响. 由图2可见,加入Pb后菌株生长量与不加Pb对比有明显降低,表明Pb对菌株生长有明显的抑制作用;加Ca组中菌株生长量有所提高,对Pb2+的耐受性有所增强. 由Ca2+对细菌生长量的影响结果可知,一定浓度的Ca2+能最大程度地提高细菌生长量,增强菌株对Pb的耐受性. 究其原因:一方面是由于Ca的添加能促进细菌分裂,提高细菌生长速率;另一方面,Ca2+与Pb2+会发生螯合作用生成共沉淀物,从而降低了c(Pb2+),使Pb对菌株生长的抑制作用有所减弱,从而增强了细菌对Pb的耐受性[30-31]. 田晶晶等[32]发现在37 ℃下,添加6%的碳酸钙能有效改善环境的pH,极大促进芽孢杆菌CGMCC 9951(BacilluscoagulansCGMCC 9951)生长,从而提高对重金属的耐受性. 添加Ca2+极有可能使得Ca2+与Pb2+进行鳌合生成共沉淀物,从而降低Pb的毒性,提高细菌的耐受性.

图2 Ca添加对Bacillus C075菌株耐受Pb的影响Fig.2 The effect of Ca addition on strain Bacillus C075 tolerance to Pb
2.3 P和Ca的添加对Pb2+矿化率的影响
相关研究表明,含磷物质的添加可以降低土壤中Pb的有效性,磷化合物是通过形成稳定Pb-P矿物质来降低Pb的迁移性[15]. 微生物对重金属的矿化作用可降低重金属的迁移能力和生物有效性,是其可应用于重金属污染修复的重要原因之一[33]. P的添加对BacillusC075矿化重金属Pb的影响结果如图3所示. 从不接菌的对照试验中可以看出,随着时间的延长,Pb的去除率变化不大. 对于加菌组,比较P添加对矿化的影响时发现,P添加后菌株对重金属Pb的矿化率有一定程度的提高,其去除量由72 mg/L增至89 mg/L,增加了23.6%. 这表明菌株通过自身的酶、官能团或是其他方式降低了环境中Pb的含量及其生物可利用性,菌株能通过酶化作用降解培养基中的底物,使得溶液中c(PO43-)增加,然后Pb2+会在酶的作用下与PO43-生成Pb5(PO4)3OH沉淀. 在此矿化过程中,细胞外聚合物和细胞壁提供吸附位点[34-35]. 由图1(a)可见,P的添加对细菌生长的影响几乎可以忽略,但P的添加直接增加了反应体系中的PO43-,确保菌株在Pb2+矿化过程中有足够的PO43-,从而进一步提高了Pb2+的矿化率. Zhang等[36]也得到了类似结果,他们在BacillusZKJ对Pb2+的矿化试验过程中发现,细菌在代谢过程中会将有机磷转化为磷酸根,随着溶液中PO43-浓度的不断增加,细胞外聚合物会与Pb2+立即螯合. Teng等[37]的研究同样发现,LeclerciaadecarboxylataL1-5在200 mg/L的P溶液中将Pb2+矿化为Pb5(PO4)3OH. 在Pb生物矿化过程中,细菌细胞充当成核位点,以支持Pb5(PO4)3OH晶体生成,这可进一步提高Pb2+去除率,并且使矿化产物更稳定、更致密[36].
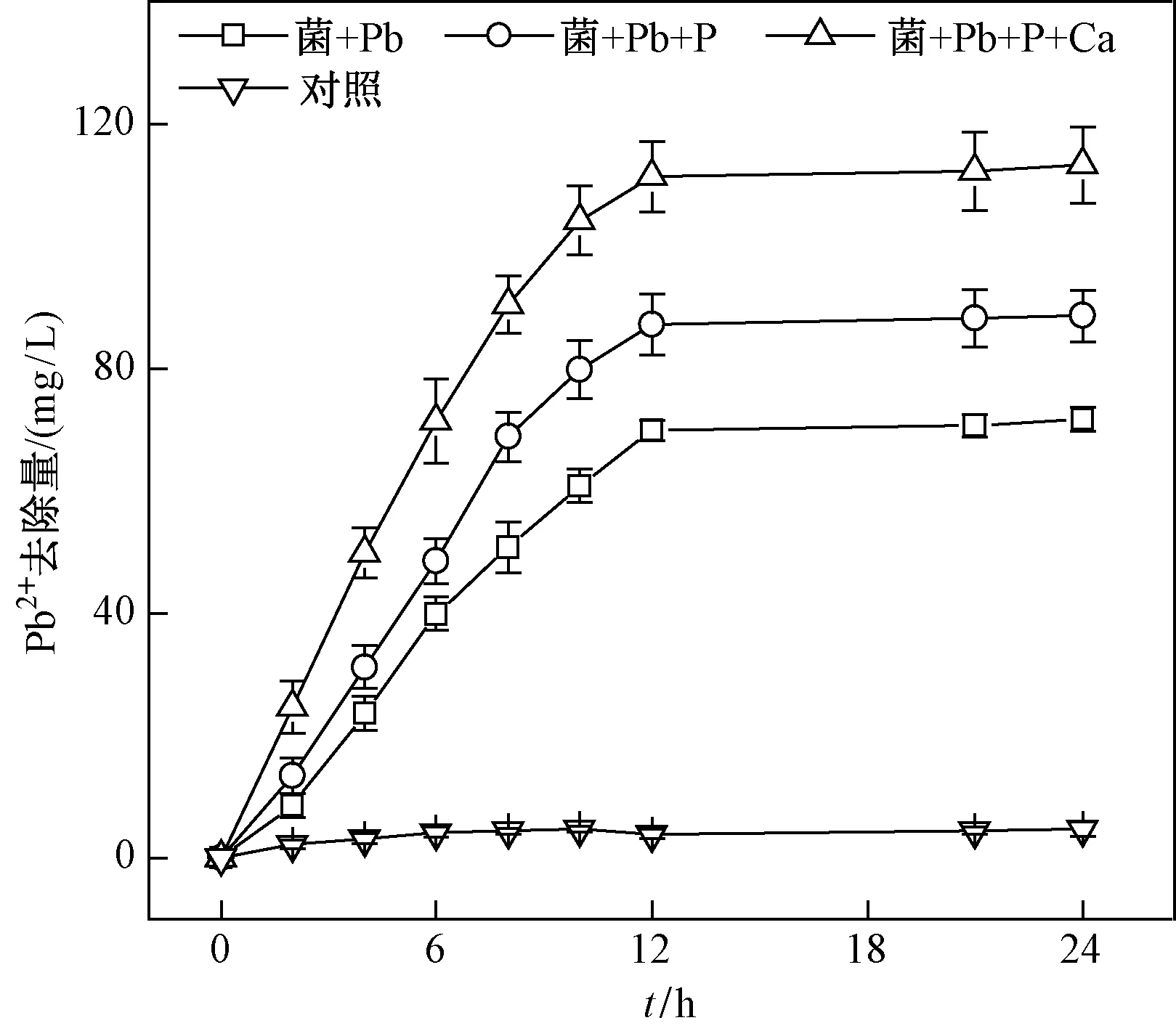
图3 P和Ca添加对Bacillus C075菌株矿化Pb2+的影响Fig.3 The influence of P and Ca addition on the mineralization of Pb2+ by strain Bacillus C075
矿化过程中,Ca的添加对BacillusC075的生长繁殖和耐受性均有一定影响,进而影响了菌株对Pb2+的矿化率. 加Ca前后BacillusC075对Pb2+去除率的影响如图3所示,其去除率均随着时间的增加而提高,反应12 h后趋于稳定,去除量从89 mg/L提高到113 mg/L,同比增加了26.9%,去除率增加了56.9%. 并且与未加Ca的两组对照相比,加Ca后BacillusC075对Pb2+的去除率在0~12 h内快速上升. 由图1(b)可见,Ca的添加提高了菌株的生物活性,加Ca后的菌株具有较快的分裂能力,在一定程度上缩短了细菌进入对数期的时间,细菌得以快速繁殖,进而使得加Ca后的BacillusC075对Pb2+的去除量最大且最先达到平衡状态. Tu等[38]在利用Bacillussp. dwc-2去除铀(U)时发现,随着接种系统中孵育时间的增加,铀的去除率也在增加,表明微生物活性在生物矿化中起着重要作用. 一些阴离子的存在也会影响生物矿化效率,如Wei等[39]发现,NH4+能促进P相关矿化物的形成,而CO32-的存在则会降低矿化效率. Ca的添加能有效降低环境中的CO32-,而生成的碳酸钙反而会促进菌株生长,加速了矿化过程. Qian等[40]使用真菌PenicilliumchrysogenumCS1进一步探讨了加Ca后的菌株对重金属Cr和Pb的去除影响,观察到土壤中有更多可交换态重金属离子与碳酸盐结合. 土壤中可交换Cr的比例由41.60%降至1.95%,可交换Pb的比例由41.27%降至2.19%,这表明Ca的添加能进一步促进菌株对重金属的矿化率[40]. 由此可见,加入一定浓度的Ca2+会提高BacillusC075对Pb2+的矿化率,进一步证明了Ca2+在其矿化过程中的作用.
2.4 菌株矿化Pb2+的动力学分析
为探究BacillusC075矿化过程中的磷酸酶活性和矿化反应程度,测定不同Pb2+初始浓度下菌株的反应速率V0,绘制菌株矿化Pb2+的动力学曲线(见图4).
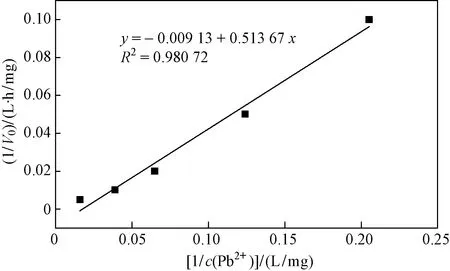
图4 Bacillus C075菌株矿化Pb2+的动力学曲线Fig.4 Kinetic curve of strain Bacillus C075 mineralized Pb2+
根据中间复合物学说,酶促反应分两步进行:第一步底物S与酶E形成中间复合物ES;第二步ES复合物分解形成产物,释放出游离酶,Michaelis等[41]据此推导出米氏方程. 米氏方程表示底物浓度与酶反应速率之间的定量关系:
V=Vmax[S]/(Km+[S])
(1)
式中:V为瞬时速率,mg/(h·g);[S]为底物浓度,mg/L;Vmax为最大酶促反应速率,mg/(h·g);Km为米氏常数.
当底物浓度很低时,反应速度随底物浓度的增加而上升,而当底物浓度很高时,所有的酶被饱和,酶促反应速率达到最大,即Vmax.Km为酶的特性常数,仅与酶的性质有关,与酶浓度无关,Km越小,表示菌株与磷酸酶的亲和力越强,越有利于反应[41]. 从曲线拟合得到解析式y=-0.009 13+0.513 67x,计算得出Vmax=1/0.009 13=109.53 mg/(h·g),Pb的相对原子质量为207.2,故Km=0.513 67×1 000/(0.009 13×207.2)=271.53 μmol/L.BacillussphaericusAND 303的Km为158.12 μmol/L,与所用菌株数值差异不显著,这表明细菌与磷酸酶的亲和力较强,更有利于矿化反应的进行[42]. 随着c(Pb2+)的增加,酶促反应速率不断增大,这是由于底物浓度的增加为菌株提供了更多的酶反应对象,从而促进了反应进行,为反应提供了更大的反应初速率V0. 这表明随着重金属浓度的增加,菌株的初始反应速率并未受到影响,这一方面排除了底物浓度对菌株矿化重金属Pb的影响;另一方面表明,可能是由于其他方面的影响(如生长量、官能团和吸附位点等)导致随着重金属浓度持续增加,菌株的矿化能力有所降低. Teng等[37]在研究P增溶性细菌固定Pb时发现,磷酸酶活性和矿化反应呈正相关,磷酸酶活性可作为矿化反应的良好指标. Wei等[39]利用Bacillusthuringiensis016对UO22+进行固定化研究,发现和缺乏酶的细胞碎片相比,完整细胞对UO22+具有更好的生物矿化能力. 这说明酶活性会影响菌株对重金属的矿化作用.
2.5 矿化物的FT-IR及XRD分析


图5 P和Ca添加前后矿化物的FT-IR和XRD图谱Fig.5 FT-IR and XRD patterns of the mineralization before and after P and Ca addition
为了进一步确定矿化物的组成,采用XRD对其进行定性分析,结果如图5(b)所示. 在未加P和Ca的样品图谱中出现了一个较强且窄的衍射峰,通过与PDF标准卡(PDF#08-0259)比较,发现二者相似度很高,所以可以确定生成的矿化物是Pb5(PO4)3OH. 由图5(b)可见,P的添加未改变矿化产物种类,但添加P后样品图谱中的衍射峰峰值更高、更尖锐,表明加P后矿化物的结晶度较未加P的样品更好. 由此可知,P的添加虽然不会对矿化物种类产生影响,但提高了矿化物的结晶度和纯度,使矿化物更稳定. Zhao等[46]对Phanerochaetechrysoporium矿化Pb2+的矿化产物进行XRD分析,结果表明矿化产物同样为Pb5(PO4)3OH. Zhang等[36]利用溶磷菌对Pb2+进行矿化,XRD结果显示,溶磷菌矿化Pb2+的产物为Pb3(PO4)2或Pb5(PO4)3OH 沉淀. 他们的结果与笔者试验所得结论相一致. 当同时添加P和Ca时,Ca的加入使得矿化物类型发生了改变,Pb2+替换了羟基磷酸钙中Ca2+的晶格[47],从而形成了Ca2Pb8(PO4)6(OH)2. 这与Chen等[13]的研究结果类似,他们利用Bacilluscereus12-2探讨其对Pb2+的矿化机制,发现在该细菌诱导的Pb2+生物矿化过程中,Ca不仅作为细菌细胞的必要成分,同时也可进一步用于形成结晶矿物——Ca2.5Pb7.5(PO4)6(OH)2. Govarthanan等[48]在研究Baciliussp.KK1对尾矿中Pb的生物矿化的意义时指出,重金属离子以替代Ca2+的晶格的形式形成新的沉淀,从而提高矿化效率.
2.6 矿化物的SEM和EDS以及BET分析
细菌活动中的矿化过程能控制矿化物的成核和生长[11,49],外界环境变化也会对矿化物种类产生影响. 对加P和Ca后的样品进行SEM分析,以便观察矿化物的分布情况. 由图6可见,未加P和Ca的空白试验组的矿化物沉淀以颗粒状团聚,粒径大小不一,颗粒间结合比较紧密,团聚状态十分良好. P和Ca的添加使得芽孢杆菌表面附着的沉淀物明显增多,并且矿化物的产品更稳定、更致密. 这也进一步证明了P和Ca的添加能提高BacillusC075对Pb2+的矿化率. Zhang等[36]在利用BacillusZKJ矿化去除Pb时发现,将细菌接种到含P培养基中能进一步提高去除率,并使得矿化产物更加稳定和致密.

图6 P和Ca添加前后矿化物的SEM和EDS图谱Fig.6 SEM and EDS spectra of mineralization before and after P and Ca addition
为进一步得到沉淀物的元素组成,分别对P和Ca添加前后的样品进行EDS能谱分析. 由图6可见,在未加Ca的条件下,加P前后沉淀物的EDS能谱发生了变化,P峰和Pb峰的强度明显增强,表明P的添加会促进菌株对Pb2+的吸附. 此外,加Ca后矿化物的EDS谱图中Ca峰和P峰有很大程度的增强. 这可归因于Ca的添加促进了细胞生长以及菌株对PO43-的利用率,从而进一步提高了对Pb2+的去除效果. 由EDS和XRD谱图可知,加Ca前后的矿化物由Pb5(PO4)3OH转变为Ca2Pb8(PO4)6(OH)2,表明Ca的添加改变了BacillusC075矿化Pb2+的产物类型. 而周吉峙等[50]发现,Ca2Pb8(PO4)6(OH)2拥有更好的化学稳定性和热稳定性,在400 ℃下仍然不会被分解.
为探究BacillusC075矿化过程中菌株表面的剩余吸附面积和吸附位点的变化,分别对P和Ca添加前后的样品进行BET分析. 由图7(a)可见,等温线呈下降趋势,在较低相对压力下其N2吸附量几乎为0(图中呈现为负值),在饱和蒸气压下骤然升至18.02 cm3/g,其比表面积为 0.760 4 m2/g,孔容为0 cm3/g. 这表明菌株表面已经没有吸附位点,吸附能力达到饱和状态,吸附受到限制[51]. 由图7(b)可见,加入P后的矿化物的等温线与未加P和Ca的矿化物的等温线类似,但是在较低相对气压下N2吸附量呈上升趋势且为正值,在饱和气压下升至26.78 cm3/g,比表面积为13.088 0 m2/g,孔容为 0.001 460 cm3/g. 这表明在加入P之后,菌株有更大的吸附面积和更多的吸附位点,吸附能力显著提高. 由图7(c)可见,加入P和Ca后的矿化物的等温线出现明显变化,在较低相对压力下吸附量呈升高趋势,且一直增加至饱和蒸气压下的最大值27.80 cm3/g,其比表面积为 8.501 6 m2/g,孔容为 0.002 957 cm3/g. 这表明在加入Ca以后,虽然吸附面积减少了,但是吸附点位增加了,使得整体的吸附能力提高. 而在加入P和Ca后矿化物的等温线中间段出现了吸附回滞带,表明菌株表面存在毛细凝聚体系. 中孔毛细凝聚填满后,菌株表面还有大孔径的孔或者吸附质分子相互作用较强,可能吸附形成多分子层,吸附等温线继续上升直至出现吸附终止平台,停止吸附[51]. 总而言之,加入P组的吸附效果优于不加P组,而加入P和Ca的吸附效果最佳.

图7 P和Ca添加前后矿化物的BET图Fig.7 BET spectra of mineralization before and after P and Ca addition
3 结论
a) P的添加对BacillusC075的生长有一定促进作用,但并不显著,但Ca2+能显著促进细菌的生长,并且增强了细菌对Pb2+的耐受性. 添加的最佳c(Ca2+)为10 mmol/L.
b) 在加入P和Ca后,BacillusC075对Pb2+的去除率有显著提升,加入P后的去除量与不加P相比提高了23.6%,而同时加入P和Ca后的去除量与不加P相比则提高了56.9%.
c) 在加入P后,BacillusC075能将Pb2+诱导矿化生成Pb5(PO4)3OH,P的添加增加了菌株表面吸附面积和吸附位点,提高了矿化率,并未影响矿化物的种类. 同时添加P和Ca后不仅显著提高了菌株对Pb2+的矿化率,还最大程度地利用了外加的Ca,进而改变了矿化物的种类,生成了Pb5(PO4)3OH和Ca2Pb8(PO4)6(OH)2,Ca2Pb8(PO4)6(OH)2拥有更好的稳定性. 因此,P和Ca的添加在微生物修复重金属污染方面具有较为广阔的应用前景.

