微生物降解典型高分子量多环芳烃的研究进展
吴洁婷, 许 琪, 张 营, 赵 磊, 陈忠林, 于英潭, 于 畅, 许海萍, 马 放*
1.辽宁大学环境学院, 辽宁 沈阳 110036 2.哈尔滨工业大学, 城市水资源与水环境国家重点实验室, 黑龙江 哈尔滨 150090 3.营口市大石桥生态环境分局, 辽宁 营口 115100
高分子量多环芳烃 (high molecular weight polycyclic aromatic hydrocarbons,HMW-PAHs)是指具有4个或更多苯环的多环芳烃,其为具有致突变性、致癌性和致畸性的持久性污染物,自然条件下不易降解,可以广泛分布在不同的环境介质中,如水、土壤和大气[1-2]. 多环芳烃通过大气粉尘沉降、污水排放、地表径流、土壤径流等形式进入河流,并对水质产生不利影响. Yu等[2]研究表明,多环芳烃在我国地表水中普遍存在,并且各流域苯并[a]芘的浓度均超过GB 3838—2002《地表水环境标准》中的规定值(2.8 ng/L),这表明我国河流流域多环芳烃的健康风险普遍较高. 一般来说,土壤是PAHs停留的最终介质[3],西班牙2005年9号皇家法令(RD 9/2005)根据毒性参数制定的基于污染物的土壤筛选等级(Risk-Based Soil Screening Levels,RBSSL)中,对既不是城市也不是工业的“其他用途(other uses)”类土壤中苯并[a]芘的规定浓度为0.02 mg/kg;而Boente等[4]研究表明,过渡煤区土壤中的PAHs以HMW-PAHs为主,其中苯并[a]芘的含量为0.24 mg/kg,超过规定限值的10倍,对当地环境安全造成了严重威胁. 大气颗粒物中的PAHs绝大部分来源于人为排放[5]. Iakovides等[6]研究了城市大气PM2.5中多环芳烃的含量,结果表明,所有多环芳烃的终生癌症风险预测值约为美国环境保护局(US EPA)预测数值的7倍,城市大气环境中的PAHs对人类健康造成巨大威胁.
环境中的HMW-PAHs可以通过挥发、光氧化、化学氧化、生物降解等多种途径被降解[7-9]. 在众多降解方式中,微生物降解可以将有害HMW-PAHs分解或转化成危害较小或无毒的化合物,具有更好的安全性和对环境的最小干扰性[10-11]. 目前,微生物修复技术已成功地应用于对HMW-PAHs降解的相关研究,该文以芘和苯并[a]芘2种典型HMW-PAHs为例,综述了微生物对其进行降解过程中的影响因素,介绍了促进降解的强化方式,对芘和苯并[a]芘在降解过程中的邻苯二甲酸和低环降解等途径进行了总结,进一步阐述主要降解酶对微生物降解芘和苯并[a]芘过程的调控机制,最后对目前HMW-PAHs研究中存在的瓶颈问题进行总结及对未来研究方向进行展望,以期为微生物降解HMW-PAHs的相关研究提供参考.
1 HMW-PAHs的组成、结构及理化性质
早在20世纪80年代初,US EPA就将16种未带分支的PAHs确定为环境中优先检测的污染物,包含10种HMW-PAHs[6],其具体结构和理化性质见表1[12-14]. 土壤中具有2~3个苯环的低分子量多环芳烃(low molecular weight polycyclic aromatic hydrocarbons,LMW-PAHs)的半衰期为5.7年,HMW-PAHs则长达9.1年,因此HMW-PAHs通常情况下比LMW-PAHs更难被去除[15-16];并且与LMW-PAHs相比,HMW-PAHs对人体具有更高的基因毒性[17]. 在HMW-PAHs中,芘是一种结构对称的无色或黄色的晶体状固体4环芳烃,通常存在于空气、水和土壤中,性质稳定,不易被降解,长期以来被定义为HMW-PAHs研究的模型化合物. 近年来,针对芘微生物降解而进行的相关研究愈发紧密. Vasconcelos等[18]研究了Tolypocladiumsp. CBMAI 1346对芘的降解及其机制,证实了海洋源真菌修复PAHs环境污染的潜力;Agrawal等[19]发现新型真菌菌株Coriolopsisbyrsinasp. APC5对芘的降解率达到51.85%,意味着该菌株可以作为环境污染修复的潜力菌株. Zeng等[20]则通过在分离步骤中用菲代替芘的方式建立了一种改良的分离芘降解菌株的方法.

表1 美国环境保护局列为优先污染物的HMW-PAHs的结构和理化性质[12-14]
除此之外,苯并[a]芘也因其对哺乳动物和水生生物的诱导突变、致畸和致癌作用而被作为一种典型的HMW-PAHs备受关注[18]. Guo等[21]研究证明,生物表面活性剂能够促进水体和土壤中苯并[a]芘的生物降解,可有效用于多环芳烃污染的水和土壤的现场修复,进而解决苯并[a]芘由于水溶性较差导致的其在土壤和水中的生物降解效率低下的问题. Bhatt等[22]对枯草芽孢杆菌BMT4i(MTCC 9447)降解苯并[a]芘的途径进行了探索并提出了在降解过程中存在多种途径的设想. Lu等[23]的研究揭示了苏云金芽孢杆菌(Bacillusthuringiensis)在细胞色素P450羟化酶的催化下对苯并[a]芘的降解的代谢网络,为HMW-PAHs的生物转化调控提供了参考.
2 微生物降解过程中的影响因素
2.1 温度
温度可影响微生物对HMW-PAHs的降解[24-25]. 一方面,当温度升高时,多环芳烃的溶解度增加,从而提高了其生物利用度; 另一方面,HMW-PAHs的微生物降解一般由双加氧酶催化进行,而过高的温度会抑制微生物中酶的降解活性[12,26](见图1). Wang等[27]研究表明,OchrobactrumMB-2在25 ℃时对芘的降解率达到最大值(41%),而当温度为10和35 ℃时,降解率分别降至17.2%和35.65%. 但也存在一些嗜热菌对高温具备良好的适应能力,Tao等[28]的研究表明,嗜热菌AeribacilluspallidusSL-1在60 ℃时能够降解80%的菲和50%的芘,这可能是由于该菌产生的生物乳化剂在各种环境条件下均具有稳定的乳化活性,因而保证了菌株在高温条件下的降解能力.
2.2 pH
极端的酸性或碱性条件会对微生物的利用能力产生破坏性影响,研究[27]表明,部分酸性介质中的氢离子容易与酶的氨基或羧基结合,改变了酶原有的结构特征,从而削弱了酶对多环芳烃的结合能力. 此外,酸性或碱性条件也会影响营养物质的溶解度和转运过程. 大多数化学异养微生物如真菌和细菌都倾向于在中性pH条件下对多环芳烃进行生物降解[25,29]. Wang等[27]的研究表明,当pH为4和5时,OchrobactrumMB-2对芘的降解率分别为7.0%和15.9%,而当pH为7时降解率则达到了最大值(41%). Govarthanan等[30]研究表明,Halomonassp. 对芘和苯并[a]芘的最高降解率体现在pH为7时,分别为67.5%和59.5%,随着pH的升高,降解率出现明显下降,其中pH为10时菌株对芘和苯并[a]芘的降解率均在40%以下.
2.3 共代谢作用
微生物通常通过共代谢作用降解HMW-PAHs. 一般来说,不同分子量的多环芳烃在降解过程中存在相互作用. 以萘和芘的相互作用为例,Jiang等[31]研究表明,在含有50和100 mg/L萘的降解体系中,Acinetobacterjohnsonii完全降解芘的时间(155和151.5 h)比只含有单一底物芘的对照组(157 h)更快. 这可能是由于在萘和芘双底物协同生物降解体系中,低浓度萘作为生长底物可以为微生物细胞的生长提供稳定的碳源和能量,从而增强生物降解活性;其次在大量萘存在下,菌体内催化PAHs裂解的降解酶水杨酸羟化酶和儿茶酚2,3-二加氧酶被大量诱导分泌,增强了其降解能力. 除此之外,Wang等[27]根据构建的萘与芘的共降解动力学方程推测,由于与萘的结构相似,芘会抢占大部分降解酶的活性位点,最终导致芘的降解得到了促进,而萘的降解则被抑制(见图2).
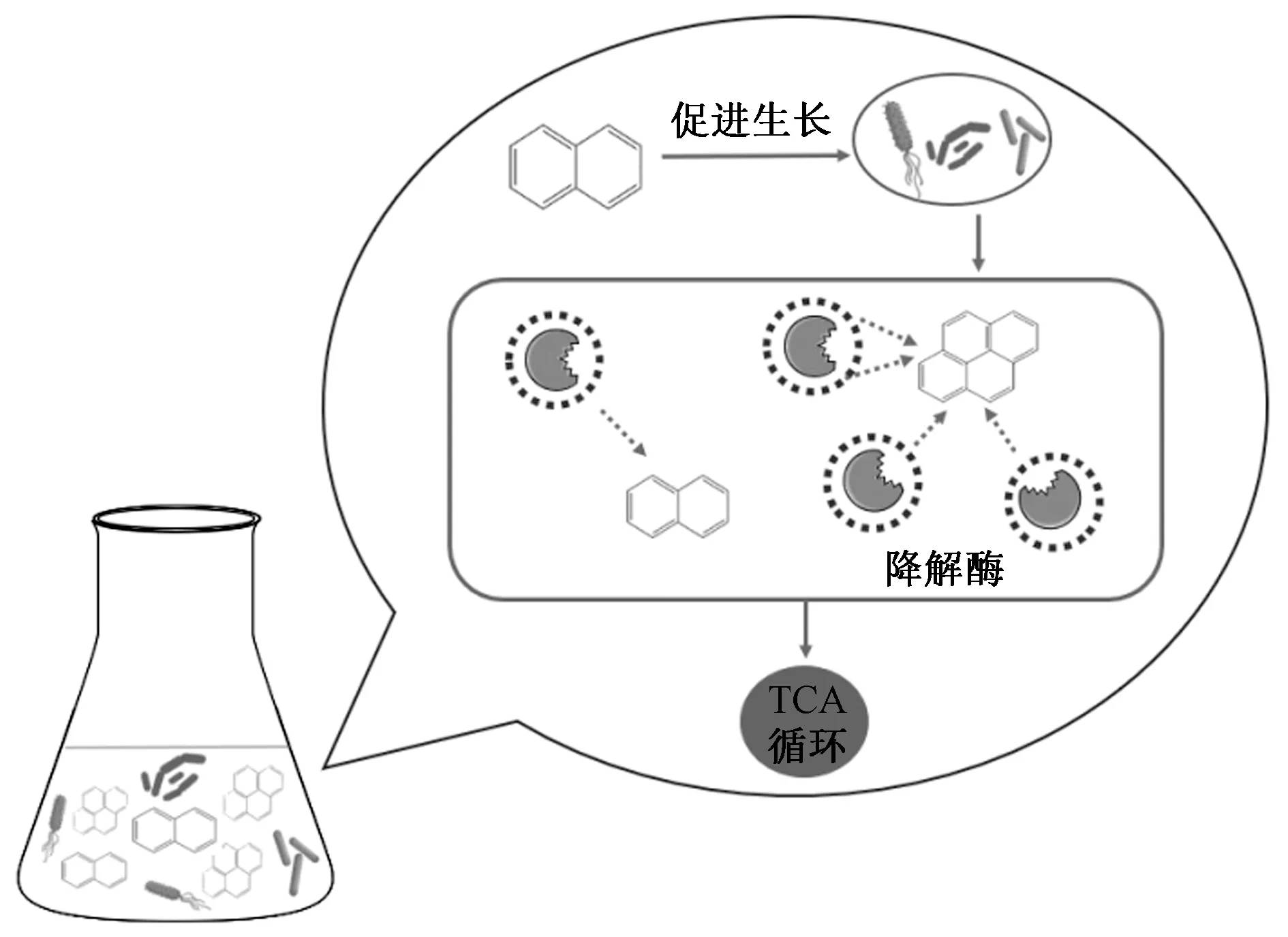
图2 萘和芘在微生物降解过程中存在相互作用[27]Fig.2 Naphthalene and pyrene interact during microbial degradation[27]
3 促进降解的强化方式
3.1 添加表面活性剂
研究[32-33]表明,非离子型表面活性剂被分解成小分子后增加了细菌对多环芳烃的生物利用度,进而提高了降解率,另外,表面活性剂的添加还有助于提高混合水平和细胞表面的生理性质. 吐温80是一种良效的化学表面活性剂. Al-Farraj等[32]研究表明,在添加不同表面活性剂(SDS、吐温20、Triton X100、吐温80、TDTMA)的降解体系中,吐温80培养物中菌株Hortaeasp.B15对芘的降解率最高(>80%),相比之下在含有吐温20和TDTMA的降解体系中,芘的降解率不足70%. Guo等[21]从养猪废水中提取的一种生物表面活性剂能够有效地促进苯并[a]芘在污染水中的生物降解,在1、2、3、4和5 CMC(critical micelle concentration,临界胶束浓度)下,该生物表面活性剂使苯并[a]芘的水溶性分别提高了1.4、2.6、4.0、5.2和6.6倍;当该生物表面活性剂用量分别为1和3 CMC时,苯并[a]芘浓度分别降至1.015 mg/L(降解率为47.9%)和0.675 mg/L(降解率为65.4%).
3.2 固定化处理微生物
进行固定化操作可以保护目标微生物免受极端pH和有毒化合物的污染,同时减少与本地微生物的竞争,进而提高HMW-PAHs的降解率[34]. 研究表明,生物炭是微生物降解HMW-PAHs的优质固定化材料. Ma等[35]研究表明,将分枝杆菌固定在改性花生壳粉上可以提高土壤脱氢酶活性和微生物多样性,促进土壤中HMW-PAHs的降解,添加生物制剂后,与对照相比,降解45 d后4环和5环PAHs的降解率分别增加了53%和55%. Mandal等[36]研究表明,将酵母菌团固定在经过化学改性的木屑粉中后能够使苯并[a]芘的降解率从游离菌株状态的64.2%提高至82.5%,对芘的降解率则从58.3%提高至75.1%,推测降解率的提高可能是由木屑表面化学改性使其孔隙率提高所致,孔隙率的增加增强了氧的扩散,促进了酵母菌团的吸附和生长,从而增加了微生物活性和生物降解能力.
3.3 构建基因工程菌
构建高效、降解能力强的工程菌可以大幅提高PAHs的降解效率[37-38]. 对HMW-PAHs而言,微生物在对其进行降解的过程中具有共同的降解基因及其编码的酶[39-40]. 因而在本土微生物物种没有表现出HMW-PAHs降解能力或降解率很低的情况下,构建转基因微生物可作为降解HMW-PAHs的有效方式[39,41].
降解HMW-PAHs工程菌株的构建往往通过在受体中表达降解基因来完成. Mardani等[42]研究表明,通过植入编码邻苯二酚2,3-双加氧酶(catechol 2,3-dioxygenase,C23O)的nahH基因构建的工程菌株假单胞菌(Pseudomonasputida)在培养90 d后对芘和菲共降解体系的降解率(>90%)优于天然菌株的降解率(<20%). Cao等[43]研究表明,将控制铜绿假单胞菌(PseudomonasaeruginosaBSFD5)中鼠李糖脂合成基因的rhlABRI盒克隆并转化到恶臭假单胞菌(PseudomonasputidaKT2440)的染色体中,构建出的重组菌株恶臭假单胞菌(PseudomonasputidaKT2440-rhlABRI)在培养30 d后对芘的降解率达到了79%,高于未加菌对照组的43%.
4 典型HMW-PAHs的降解途径
4.1 芘的降解途径
芘(pyrene,PYR)由4个苯环组成,由于结构与其他致癌的HMW-PAHs物质相似,因此常被作为模型化合物用于研究HMW-PAHs的降解过程[15]. PAHs中相当于菲环9、10位的区域为K区,研究[44-45]表明,通过K区氧化降解进入三羧酸(tricarboxylic acid,TCA)循环是芘降解的主要途径之一,而二氢二醇、邻苯二甲酸盐、原儿茶酸则是该途径重要的中间产物. 在该途径下芘的降解还可分为3种途径(见图3): ①芘在K区被降解为二羟基菲(dihydroxy phenanthrene),二羟基菲随后被转化为邻苯二甲酸(phthalic acid),邻苯二甲酸继续被降解并最终进入TCA循环完成反应,该途径在Hortaeasp. B15中得到证实(见图3中A途径)[32];②芘首先在K区进行双加氧反应生成二氢二醇,二氢二醇继续反应生成邻苯二甲酸盐(phthalate),邻苯二甲酸盐被进一步降解为原儿茶酸(protocatechuate),其继续转化为TCA循环的中间体进入中心代谢完成降解,该途径在分枝杆菌属MycobacteriumvanbaaleniiPYR-1中得到证实(见图3中B途径)[46];③芘首先在K区被氧化为4,5二羟基芘(4,5 dihydroxy pyrene),随后进行氧化和环裂解反应生成菲和邻苯二甲酸二异丙酯(pthalic acid diisopropyl ester),邻苯二甲酸二异丙酯继续被氧化为苯甲酸2-羟基戊酯(benzoic acid 2-hydroxy pentyl ester),其继续被降解为苯甲酸(benzoic acid),最终被转化为丙酮酸进入代谢生成CO2,该途径在软盖革孔菌CoriolopsisbyrsinaAPC5被证实(见图3中C途径)[19].
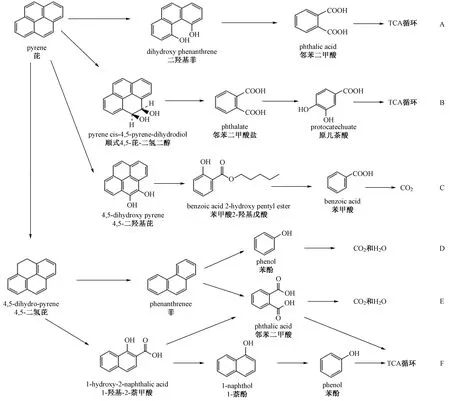
图3 芘的降解途径[19,32,46-49]Fig.3 Degradation pathways of pyrene[19,32,46-49]
HMW-PAHs在开环降解过程通常会进入低环途径,芘已被证实可以通过菲和萘酚的途径被降解. 即芘首先被还原为4,5-二氢芘(4,5-dihydro-pyrene),再进一步氧化还原生成1-羟基-2-萘甲酸或在C-C键裂解生成菲,进一步降解为CO2和H2O(见图3中D、E途径),而1-羟基-2-萘甲酸通常可以通过邻苯二甲酸或萘酚2种途径进行降解(见图3中F途径),该途径在假单胞菌属Pseudomonassp. LX2和克雷伯氏菌属Klebsiellasp.LZ6中被证实[47-49]. Wang等[50]的研究同样证实芘可以通过菲的途径被降解.
4.2 苯并[a]芘的降解途径
苯并[a]芘(Benzo[a]pyrene,BaP)是一种HMW-PAHs,国际癌症研究机构(International Agency for Research on Cancer,IARC)已经将苯并[a]芘列为已知的致癌物之一[51]. 苯并[a]芘不易被降解,常被视为研究HMW-PAHs的模型化合物[52].

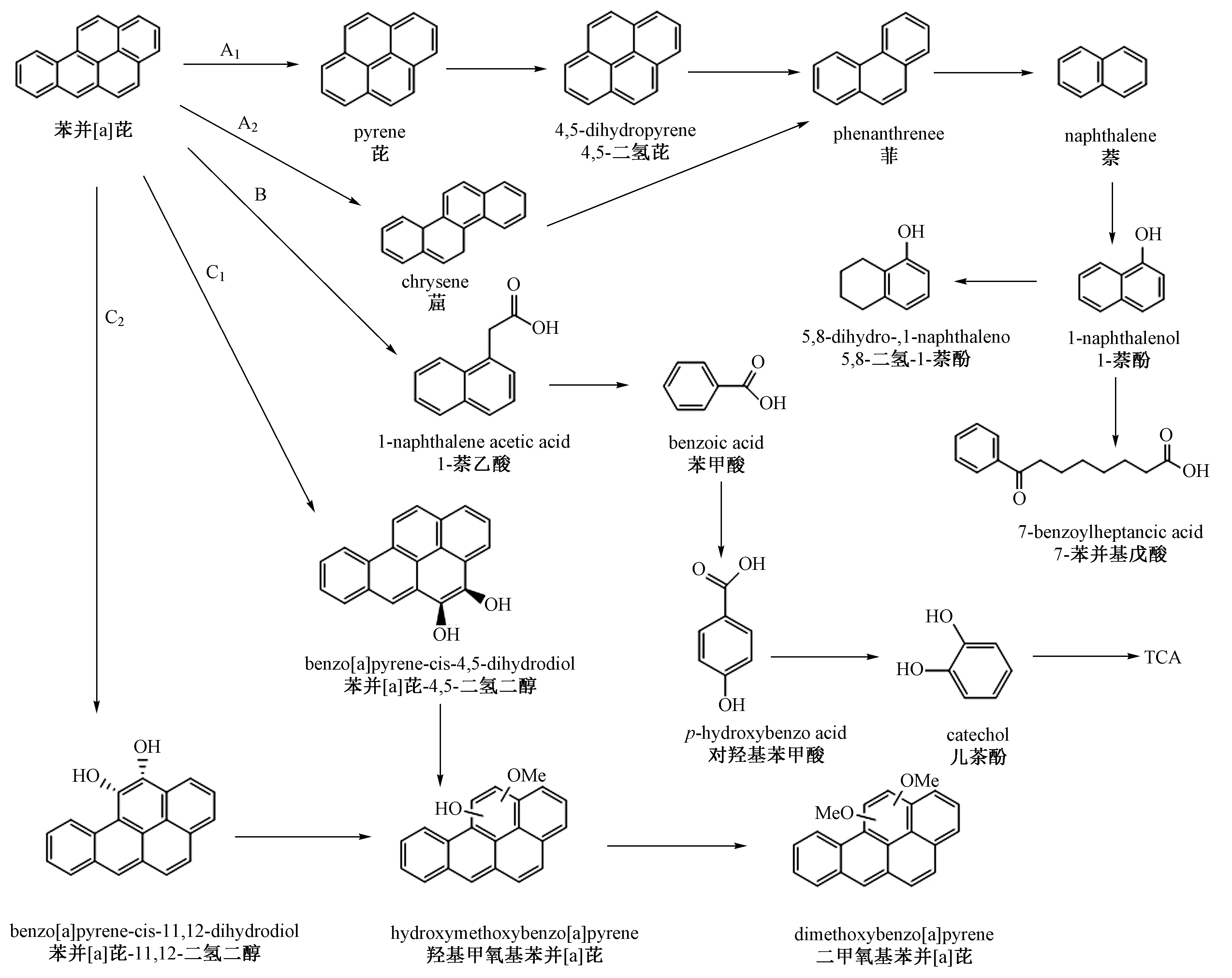
图4 苯并[a]芘的降解途径[53-55]Fig.4 Degradation pathways of Benzo[a]pyrene[53-55]
5 微生物对典型HMW-PAHs的降解机制
在微生物群落中,细菌是PAHs污染修复中被广泛研究的类群,其对HMW-PAHs的降解通常由基因编码的氧合酶引发,经一系列生化反应后将HMW-PAHs转化进入TCA循环完成降解(见图5)[12,56]. 目前已经发现的可降解芘的细菌有假单胞菌属(Pseudomonassp.)[47,57]、分枝杆菌属(Mycobacteriumsp.)[46,58]、红球菌属(Rhodococcussp.)[20]等. 可降解苯并[a]芘的细菌有芽孢杆菌属(Bacillussp.)[22-23]和假单胞菌属(Pseudomonassp.)[59]等.
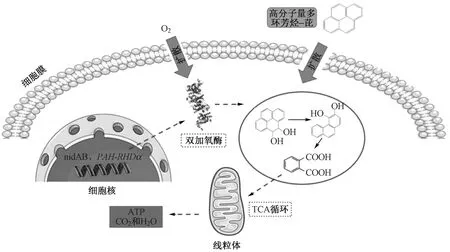
图5 微生物对HMW-PAHs的代谢机制[12,56]Fig.5 Metabolic mechanism of microorganism to HMW-PAHs[12,56]
5.1 双加氧酶催化HMW-PAHs羟基化
羟基化是HMW-PAHs降解过程中的重要步骤,而这一过程通常由双加氧酶催化进行. 细菌和藻类对多环芳烃的降解主要涉及双加氧酶和部分单加氧酶介导的反应[12]. 分枝杆菌属的细菌通常在双加氧酶作用下将芘代谢为4,5-二氢二醇,假单胞菌菌株中也存在类似的降解途径[46,57]. Jin等[57,60]研究表明,假单胞菌Pseudomonassp. JPN2能够在由nahAa、nahAb、和nahAcAd组成的萘双加氧酶的作用下降解芘,其中编码双加氧酶α亚基的nahAc基因在多环芳烃的二羟基化反应中起关键作用. Kim等[46]研究表明,在MycobacteriumvanbaaleniiPYR-1中,由基因nidA3B3编码的双加氧酶能够将芘羟基化分解代谢为芘顺-4,5-二氢二醇(pyrene cis-4,5-dihydrodiol)或芘顺-1,2-二氢二醇(pyrene cis-1,2-dihydrodiol). PAH环羟化双加氧酶(PAH-RHDα)是催化HMW-PAHs降解过程中重要的双加氧酶,通常由PAH-RHDα基因家族编码[61]. Thomas等[62]研究表明,多环芳烃(包含HMW-PAHs)污染土壤中13株PAHs降解菌株的PAH-RHD酶由基因PAH-RHDa编码,并催化HMW-PAHs环羟基化降解[63]. Miao等[64]研究同样证明,RhodococcusaetherivoransIcdP1对茚并[1,2,3-cd]芘的环羟基化是由主要分布在PAH降解区域A中(1 977 937~2 019 582 bp)的基因所编码的环羟化双加氧酶RHOs1892-1894、RHOs1917-1920和RHOs4740-4741引导进行的. 除此之外,Wang等[50]还发现,在降解芘的过程中Cycloclasticussp. P1体内编码双加氧酶(RHD-1和RHD-4)-亚基的两对同源基因Q91_0875/Q91_0876和Q91_0870/Q91_0871显著上调,其中RHD-1能够催化芘的羟基化降解.
5.2 细胞色素P450单加氧酶氧化HMW-PAHs
细胞色素P450(cytochrome P450,CYP)酶是广泛存在于微生物、动植物及人体中与膜结合的血红蛋白类酶,具有羟基化、环氧化、脱烷基等多种生物催化活性[65]. 许多真菌用包括木质素过氧化物酶、锰过氧化物酶、漆酶、细胞色素P450和环氧水解酶在内的酶来代谢多环芳香烃,其中非木质素真菌初始氧化多环芳烃酸的主要途径涉及细胞色素P450单加氧酶的活性[66]. 研究[65,67-68]表明,细胞色素P450单加氧酶可以将多芳香烃氧化为芳烃氧化物. 在曲霉菌属、青霉菌属和小克银汉霉菌属中,多环芳烃的初始转化通常由细胞色素P450单加氧酶和O2氧化产生芳烃氧化物和水[69]. Kashyap等[70]研究表明,CandidatropicalisMTCC184中的细胞色素P450单加氧酶能够将芘氧化为二氢二醇从而引导降解过程. Vasconcelos等[18]发现,Olypocladiumsp. CBMAI 1346对芘的降解主要由细胞色素P450系统中的单加氧酶引发,这些酶与环氧水解酶结合将芘羟基化为4,5-反式二羟基芘. Lu等[23]的研究则表明,在芘降解的过程中,Bacillusthuringiensis的P450酶可以催化氧化苯并[a]芘进行环裂解.
6 结论与展望
a) 过高或过低的温度及pH通过改变酶的活性来影响着微生物的降解性能,并且不同分子量的多环芳烃在降解过程中存在相互作用. 由于HMW-PAHs降解过程中的中间产物多而复杂,因此探究降解中间产物对微生物降解性能的影响是未来的研究方向之一. 另外,对共代谢机制进行深入探索以最大程度地发挥微生物的降解能力也是HMW-PAHs未来研究的重点.
b) 有多种方法可以对HMW-PAHs的微生物降解进行强化,其中表面活性剂吐温80对降解的促进作用较为明显;将微生物固定在生物炭上也能够有效促进HMW-PAHs的降解;通过在受体菌株中表达降解基因来构建基因工程菌是促进HMW-PAHs的有效方法,但是基因工程菌降解性能的长期稳定性等问题对该技术的广泛应用造成阻碍,未来通过监测和调控环境因子,综合降解机理分析并进行基因重组构建新型高效且稳定的降解菌株应是HMW-PAHs微生物降解的研究方向之一.
c) K区氧化降解和通过低环途径降解是芘和苯并[a]芘微生物降解的主要途径,双加氧酶和细胞色素P450酶是能够催化HMW-PAHs氧化降解的重要降解酶. 随着分子生物技术的发展,利用全基因组测序技术鉴定未表达的降解基因,综合多组学数据从基因、转录、蛋白和代谢水平对HMW-PAHs的降解机制进行全面深入的阐释是未来研究的重点.

