肠道菌群的环境毒理学研究:现状与展望
刘月月, 王 琛, 赵晓丽, 吴丰昌, 白英臣, 滕苗苗, 汪 霞, 时 迪
中国环境科学研究院, 环境基准与风险评估国家重点实验室, 北京 100012
肠道菌群是寄居在宿主肠道中微生物群落的总称,其与宿主互利共生,可以通过菌体的自身成分、代谢物、衍生物等调节肠道局部免疫平衡,参与机体免疫微环境的塑造,帮助宿主完成多种生理生化功能[1]. 越来越多的流行病学与毒理学研究表明,肠道菌群紊乱和失衡与多种人类非传染性疾病(non-communicable diseases, NCDs)密切相关. 肠道菌群异常(如多样性降低、特定成员和功能改变等)可能参与糖尿病[2]、非酒精性脂肪肝[3]、炎症性肠病[4]、自身免疫性关节炎[5]、肥胖症[6]、哮喘等[7]等多种疾病的发生. 此外,短链脂肪酸、脂多糖、次级胆汁酸等肠道菌群的代谢产物和衍生物,也能与宿主的一些生理途径相互作用,并通过“脑—肠—肠道菌群轴”诱发自闭症[8]、代谢综合征[9]、老年痴呆症[10]等疾病.
随着现代社会的快速发展,化学物质的制造量和使用量日益增长,这些物质会释放到环境中,通过多种环境介质及食物链对人类和动物健康产生影响,其中经口暴露是绝大部分污染物产生毒害效应的暴露途径[11]. 肠道菌群与宿主的胃肠消化系统是人类及众多环境生物抵御外源污染物侵袭的第一层屏障. 研究[12-13]证实,肠道菌群易受饮食和抗生素等外源因素的影响,且对环境污染物表现出极高的敏感性. 环境污染物的暴露可以改变肠道菌群的丰度和多样性,进而诱导与菌群失调相关的毒理学症状,最终影响宿主健康. 污染物可以通过动物的“脑—肠—肠道菌群轴”系统双向调节机制,以菌群代谢产物和衍生物为“信使”,影响内分泌、神经系统的组成和宿主行为. 由于肠道菌群的敏感性及对宿主多种全身性生理功能发育的重要影响,研究污染物对肠道菌群及宿主健康的交互作用已经成为环境毒理学领域的新兴热点.
鉴于微生物菌群的重要作用,目前以美国、日本、加拿大和欧盟为代表的发达国家和地区,在共同完成“人类基因组计划”(2000年)之后,又战略部署了一系列支持微生物组相关的研究计划[14](见图1). 2006年中国与法国启动了“中法人体肠道元基因组”合作,随着欧洲其他国家的加入,该合作已上升为中欧人类微生物组合作[15]. 这些研究计划能深度解读微生物群和疾病之间的关联,为探索环境污染物对肠道菌群产生的毒性效应提供基础.
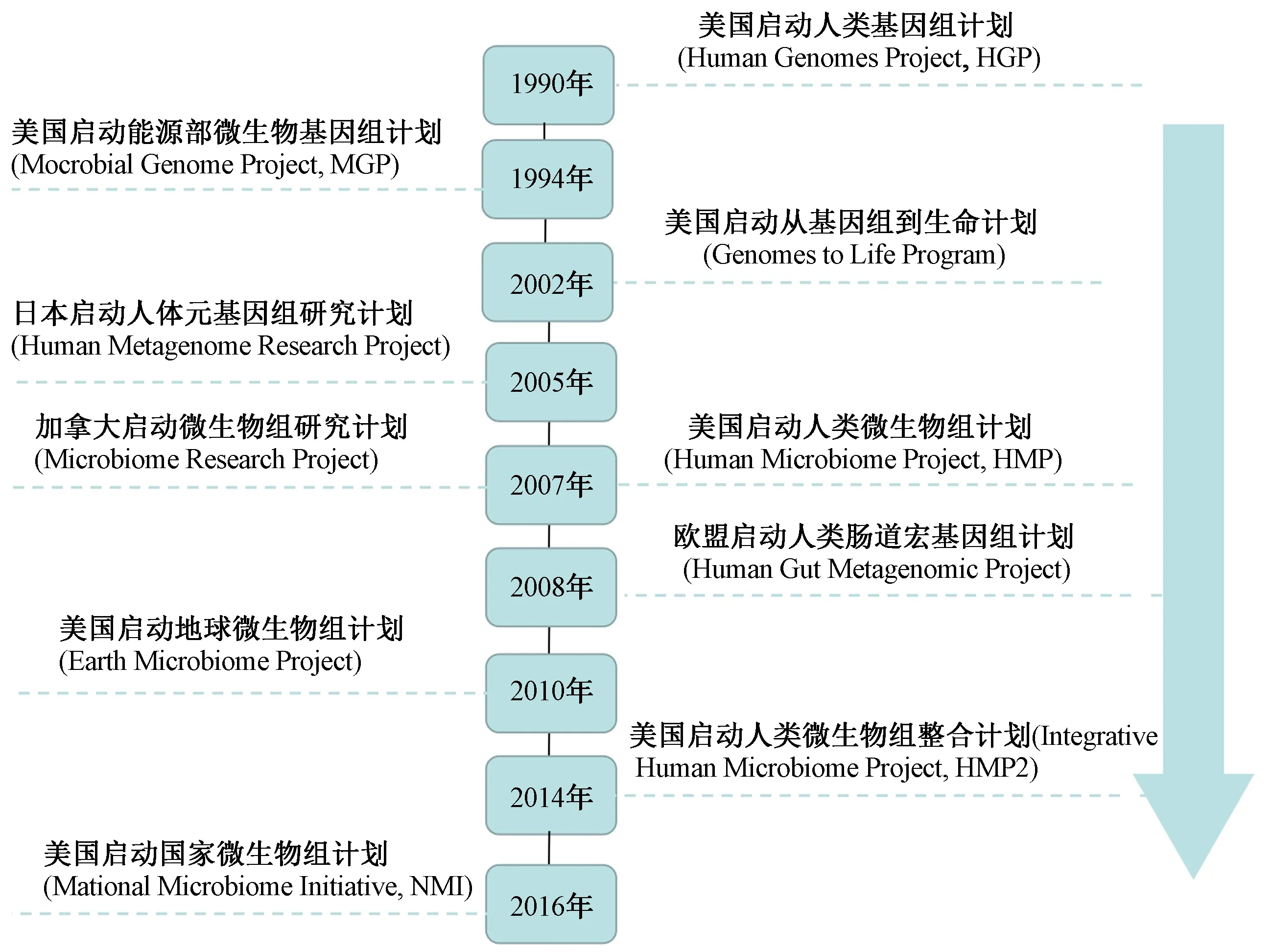
图1 国际上与微生物组相关的研究计划Fig.1 International research projects related to the microbiome
该文在简述目前肠道菌群研究方法和环境毒理学进展的基础上,从组织学、病理学、生理学等角度系统归纳了近年来关于环境污染物对肠道菌群的干扰作用,总结了近年来环境污染物对肠道菌群多样性和丰富度的影响以及肠道菌群与宿主健康互作机制. 并对肠道菌群毒理学研究中存在的问题和研究方向进行了探讨与展望,以期对环境污染物的新型致毒机理研究和环境风险评价提供一定参考.
1 肠道菌群的研究方法
历史上对微生物组的探索主要限于对致病性菌群的选择性培养,而多数菌群因为非致病性、种群含量低和培养条件难度大等原因,所受关注较少. 近年来,分析微生物组的方法和标准获得快速发展,新兴技术的发展和应用使得人们可以更加全面地确定肠道菌群的组成,解析菌群的结构和功能. 这使得探索环境污染物与肠道菌群潜在的因果关系、研究相关微生物介导的疾病发生机制成为可能[16-17]. 常用的微生物组分析技术如表1所示,目前高通量测序方法已成为研究环境污染物对肠道菌群影响中最普遍的技术手段.

表1 肠道菌群的研究方法归纳
2 环境污染物对肠道菌群的干扰作用及机制
2.1 环境污染物对肠道菌群的干扰作用
医用药物的过度使用以及农药残留、重金属污染、持久性有机污染物、新污染物污染等产生的生态和健康危害已经引起世界范围内的广泛研究. 尽管这些环境污染物的毒理学研究已不断扩展和深入,但是针对肠道微生物开展的环境毒理学研究尚处于起步阶段. 一般认为,肠道及肠道微生物系统是经口暴露的污染物进入机体后的第一层暴露接触点,也是防御污染物毒害作用的第一层屏障[11]. 与机体的其他靶器官相比,肠道微生物更易受到环境污染物的暴露,其变化也能够直接反映污染物的潜在毒性作用[12-13]. 针对目前广泛研究的几种典型环境污染物,该文从污染物种类、应用、环境来源以及对肠道菌群的影响等方面做了归纳整理,以期为进一步开展污染物生态毒理学研究和风险评估提供参考. 由于污染物的生物利用度取决于各种因素,如污染物本身的物理化学特性,与宿主的接触时间、接触剂量、宿主自身吸收能力等,该研究进一步整理分析了几种典型环境污染物在不同暴露浓度、暴露时间下对肠道菌群的影响和对宿主的毒性效应(见表2). 越来越多的研究[23]证明,肠道菌群会受到不同污染物暴露的影响,进而直接或间接对宿主的健康产生影响.

表2 几种典型环境污染物对不同生物肠道菌群毒理研究归纳
2.2 环境污染物影响肠道菌群和宿主健康的作用机制
环境污染物被人类和动物体内肠道吸收后,通过影响肠道菌群的生理活动,破坏机体肠道屏障,导致肠道组织损伤,进一步引发宿主代谢失调、免疫系统、神经系统、内分泌系统紊乱等多种复杂结果,从而影响宿主健康. 此外,环境污染物通过菌群的介导作用也会增加宿主的易感性,导致炎症、病原体侵染等,加剧污染物的毒性(见图2).

图2 环境污染物暴露影响肠道菌群和宿主健康的潜在作用机制Fig.2 The potential mechanism of environmental pollutants on gut microbiota and host health
2.2.1破坏肠道屏障功能和完整性
肠道菌群在维持宿主肠道完整性和功能上发挥着重要作用:一方面,肠道上皮细胞及部分定植于此的共生微生物菌群构成了保护宿主抵御病原菌侵染的物理性屏障[52-53];另一方面,肠道菌群可以将食物成分转化为含吲哚的代谢物,促进潘氏细胞和杯状细胞分泌防御素、抗菌肽和粘蛋白,以助于维持肠道屏障的完整性[54]. 肠道上皮屏障完整性一旦受到破坏,也会为致病性菌群的移位提供条件,诱发肠道炎症[55]. 研究[56-57]表明,肠道菌群中的双歧杆菌、类杆菌等有益菌群产生的短链脂肪酸(SCFAs)可以通过多种机制作用于肠道以维持肠道屏障完整性,抑制肠道炎症. SCFAs通过GPR (如GPR43、GPR109A)信号通路促进肠树突状细胞(DC)和Th1细胞分泌白细胞介素(IL-10、IL-18)和AMP,促进调节性T细胞(Treg)的发育,抑制促炎Th17细胞的增殖,促进肠屏障功能的增强. 肠道菌群的代谢物——次级胆汁酸可以通过法尼类X受体(FXR)和纤维母细胞生长因子19(FGF19)调控肠隐窝再生及伤口修复、维持肠道屏障完整性和抑制病原体移位定植[58]. 环境污染物暴露能够抑制或杀灭有益菌群,改变有益菌群代谢产物(短链脂肪酸、次级胆汁酸等)的含量,进而影响代谢产物发挥缓解宿主肠道炎症、调节肠道屏障的功能. 例如,咪唑作为杀菌剂会造成哺乳动物和水生生物肠道损伤. 暴露于浓度为 1 000 μg/L的咪唑21 d可显著诱导成年斑马鱼肠道微生物区系失调,有益菌群——拟杆菌属、另枝菌属、艾克曼菌属的丰度均明显降低,以及肠道粘蛋白分泌紊乱[24]. 口服25、50和100 mg/kg咪唑28 d会诱发小鼠肠道菌群失调和结肠炎症[59]. 此外,有机磷农药杀虫剂毒死蜱可以破坏小鼠肠道屏障完整性,引发炎症,导致肠道菌群中变形菌门丰度的增加,拟杆菌门丰度的减少[60]. 除了上述污染物外,其他有机污染物如甾体雌激素雌二醇、除草剂阿特拉津同样也能介导肠道损伤[51].

续表2
肠道菌群是肠道免疫反应的有效刺激因子,在免疫功能中扮演着重要角色[61]. 肠道菌群及其代谢产物通过与免疫系统相互作用,传递促进免疫细胞成熟和免疫功能正常发育的神经信号[62],肠道菌群(拟杆菌、乳杆菌等)可以诱导抗菌肽(AMPs)、免疫球蛋白A (IgA)的表达,从而防御病原体[63]. 肠道菌群通过激活自身表位进而驱动Th1、Th17和调节性T细胞(CD4+、CD25+、Foxp3+)分化、B细胞反应,促进机体对无害抗原的耐受,参与宿主的免疫应答和组织修复[64]. 肠道菌群的代谢产物通过抑制组蛋白去乙酰化酶(HDAC),并激活GPR41、GPR43、TLR4-TRIF信号通路以促进缺氧诱导因子1α (HIF1α)及芳香烃受体(AhR)、干扰素刺激基因(interferon-stimulated gene,ISG)的表达,促进细胞因子白介素(IL-6、IL-22、IL-18等)的产生[54,65],从而调节肠道巨噬细胞的活性,促进病原体清除,维持免疫内环境的稳定和阻止自身免疫疾病的发展. 环境污染物暴露可以通过影响这些有益菌群的增殖进而干扰宿主的免疫系统. 相关研究[66]发现,连续3周对小鼠经口暴露三氯生,能够通过肠道菌群改变小鼠结肠中免疫细胞和白介素基因(IL-6)的表达,诱导结肠炎. 将小鼠连续暴露于浓度为10、250 μg/L的重金属砷中,其肠道菌群丰度和多样性均发生改变,引发微生物中抗砷和亚硝酸盐还原酶基因表达变化,造成宿主细胞内氧化应激损伤并产生过量的一氧化氮,而氧化应激环境中过量的一氧化氮会影响细胞生长或传递异常的信号,进而产生免疫毒性[67]. 另有研究[68]指出,大鼠连续13周暴露于纳米银中会降低厚壁菌门的丰度,并扰乱大鼠回肠中免疫调节基因(TLR2、TLR4、GPR43和FOXp3)的表达,影响大鼠免疫功能和整体稳态.
2.2.2引发代谢失调
短链脂肪酸、脂多糖、次级胆汁酸、咪唑丙酸、支链氨基酸、吲哚及其衍生物等一系列的菌群代谢产物和衍生物可作为菌群的“信使”,通过激活迷走神经、刺激肠内分泌细胞、传输免疫介导信号等途径作用于大脑,从而对脑细胞(如神经元、少突胶质细胞、星形胶质细胞、小胶质细胞和内皮细胞)产生细胞特异性的影响[69-70],影响宿主能量稳态、食欲、胰岛素敏感性、内分泌调节等,从而调控宿主代谢[71-72]. 环境污染物可以通过影响肠道微生物而使宿主的代谢产物发生改变. 研究[27]证实,小鼠暴露于低剂量抗生素后,通过改变小鼠体内肠道菌群代谢短链脂肪酸的过程,从而影响正常宿主肝脏脂质和胆固醇代谢调节. 小鼠连续4周暴露于重金属砷(10 mg/L)中会改变肠道内相关菌群的丰度,进而影响宿主正常的脂质、氨基酸、胆汁酸代谢[32];将小鼠连续暴露于10 mg/L的镉10周后,肠道内变形菌门、厚壁菌门丰度均显著降低,血清中脂多糖水平升高并引发肝脏炎症和能量代谢失调[73]. 相似的研究结论也在水生生物鱼类中得到证实:孔雀鱼幼鱼连续暴露于聚苯乙烯微塑料(粒径32~40 μm)28 d,鱼体肠道中的变形菌丰度显著增加,参与脂质代谢的放线菌门和浮霉菌门丰度均显著减少,最终降低了鱼体消化、代谢和防御功能[74]. 此外,纳米氧化锌[41]、有机磷农药二嗪磷[75]及2,3,7,8-四氯二苯并呋喃(TCDF)等多种污染物均可干扰肠道菌群,从而造成宿主代谢紊乱[76].
毒理学研究[30]表明,环境污染物作用于肠道菌群后也能够改变宿主的生长发育. 菌群产生的SCFAs增加,可刺激肠道内分泌细胞释放胰高血糖素样肽-1(GLP1)、空腹肽,同时减少胃饥饿素的分泌,刺激厌食激素的产生,导致宿主食物摄入量显著减少,对宿主代谢和体重控制发挥重要作用[77]. 将蚯蚓连续28 d暴露于砷(浓度为70~280 mg/kg)后发现,肠道中拟杆菌门丰度增加、链霉菌科丰度降低,并伴随体重下降和死亡率上升的现象[78]. 将黑水虻连续10 d分别暴露于铜(浓度为100~800 mg/kg)和镉(浓度为10~80 mg/kg)后,观察到肠道菌群紊乱且体重发育受到抑制[30]. 有研究[27,79]发现,环境污染物暴露能够通过肠道菌群进一步改变生物体对胰岛素的敏感程度,从而导致宿主体重增加. 例如,青霉素等抗生素被小鼠摄入后能够造成肠道菌群失衡,影响胰岛素代谢调节因子和代谢酶基因的异常表达,导致小鼠体内脂肪含量及体重上升. 小鼠在杀虫剂毒死蜱[60]、重金属铅[33]的暴露研究中,也在其体内观察到了类似的组织生理变化.
2.2.3影响神经行为
近年来,生物和医学领域的学者深入系统地开展了肠道微生物对生物体神经系统和生物行为的研究,发现肠道菌群及其代谢物能够作为控制信号分子从肠腔传输到迷走神经和肠神经系统,调节GABA和5-HT等神经递质的浓度,直接或间接地影响神经系统,调控宿主行为[80]. 然而,目前关于污染物通过肠道微生物介导神经行为的毒理学研究还非常有限. 有研究[81]推测,人类的很多精神性疾病可能与污染物暴露影响到肠道菌群有关. 关于该领域的环境毒理学研究还有待进一步深入开展.
3 结论与展望
肠道菌群在维持宿主健康上起着至关重要的作用,也为挖掘环境污染物新的毒性终点和作用机制提供了研究方向. 然而,关于肠道菌群的环境毒理学研究在一些关键性科学问题上依然面临挑战: ①环境污染物暴露导致的宿主健康损伤与肠道菌群失调常相伴而生,很多研究结果只是证明了二者之间的相关性,在因果关系上依然缺乏系统研究. 这种研究结果上的因果关系缺失,可能为推断污染物的作用机制带来困难. ②肠道菌群在不同生物体中存在种间特异性和种内差异性,同一个体在不同的生长发育阶段也存在差异. 选择不同本底值的试验对象是否会给现有的研究结论造成影响,这也是一个值得关注的问题.
对于这些关键问题的阐释,需要方法学的创新和技术手段的进步. 期待在未来研究中可以在以下两个方面重点加强方法学的开发和投入: ①开发模式生物,尤其是本底值清晰的生物品系和无菌品系. 对比试验能够更加清晰地阐释肠道微生物的作用,也是破解研究肠道菌群和宿主健康互作因果关系的关键. ②开发体外肠道菌群培养技术和肠道模拟系统,通过变量控制,依据“科赫法则”开展肠道菌群稳态形成机制、肠道菌群恢复试验、环境因子对肠道菌群影响等研究.

