养猪废水中磺胺嘧啶对湿地底泥中氮转化微生物及过程影响
卿 叶, 李红芳, 张苗苗, 卢少勇, 吴金水, 刘 锋*
1.中国科学院亚热带农业生态研究所, 亚热带农业生态过程重点实验室, 长沙农业环境观测研究站, 湖南 长沙 410125 2.中国科学院大学, 北京 100049 3.中国环境科学研究院, 湖泊水污染治理与生态修复技术国家工程实验室, 环境基准与风险评估国家重点实验室, 北京 100012
随着畜禽养殖业的迅猛发展,兽用抗生素的广泛应用和残留已成为自然环境中抗生素污染的重要来源之一. 其中,磺胺类抗生素因抗菌广谱、价格低廉等特点,是使用量最大的兽用抗生素之一[1],在畜禽粪污、养殖废水以及养殖场周围的地表水和地下水中被频繁检测到,且检出浓度在ng/L~μg/L级别[2-4],最高可达3 630 μg/L[5]. 人工湿地作为一种有效的污水生态处理技术[6],对养殖废水中NH4+-N、TN的去除率分别为98.8%~99.8%和87.8%~93.8%[7-8],但湿地系统水体氮素的去除是一个微生物参与的过程,任何影响到微生物活性的因素都可能影响湿地的脱氮性能. 而养殖废水中的抗生素本身就是一种在低浓度下就能抑制或杀死细菌的药物,因此养殖废水中的磺胺类抗生素在湿地系统中可能会对湿地的脱氮过程及氮转化功能微生物产生作用,进而影响湿地对养殖废水中氮素的转化和去除.
微生物的硝化、反硝化作用已被证实是人工湿地氮去除的主要机制,可占总去除氮量的60%~90%[9]. 已有研究表明,磺胺类药物会刺激土壤的氨化与硝化作用,且土壤铵态氮激活率最高可达271%[10],但在100~500 mg/kg浓度范围内,SD(sulfadiazine,磺胺嘧啶)能显著抑制池塘底泥氨氮氧化[11]. 另外,SD还会抑制池塘底泥NO3--N(硝态氮)还原,且nirK、nrfA、nosZ基因的相对丰度均低于对照组,但抑制作用随时间推移而减弱,在30 d后,50和 1 000 μg/L的SD抑制率分别为26%和21%[12]. Chen等[13]也认为,磺胺甲恶唑会对河流沉积物NO3--N还原速率产生显著影响,且在58 mg/L的高浓度时抑制率为39%,但此时磺胺甲恶唑会促进NO2--N(亚硝态氮)还原,其NO2--N产生率为对照组的7.5倍. 由此可见,不同磺胺类抗生素种类和浓度对氮转化均存在不同程度的抑制现象,且对氮转化过程的不同阶段或者不同的氮转化微生物影响有所不同,但目前国内外研究多集中于抗生素对氮素浓度的动态影响,鲜见用氮转化功能基因和微生物群落的动态变化来研究抗生素对湿地脱氮过程及机制的影响[14-15].
基于人工湿地在畜禽养殖废水处理的广泛应用,为探讨抗生素的存在对养殖废水中湿地系统氮转化的过程及微生物的影响,该研究以典型抗生素SD为研究对象开展室内模拟试验,通过对氮转化过程中ρ(NH4+-N)、ρ(NO2--N)、ρ(NO3--N)和ρ(TN)以及底泥中氮转化功能基因丰度的变化特征,探讨养猪废水中SD对湿地底泥中氮转化微生物及过程影响,以期为合理设计畜禽养殖废水高效处理人工湿地提供科学依据.
1 材料与方法
1.1 室内培养试验设计
试验设置于中国科学院长沙农业环境观测研究站黑暗恒温〔(25±2)℃〕培养室,由5 L塑料桶盛装2 kg 底泥与3 L养殖废水混合构建供试湿地系统,其中,底泥采集于定位试验养殖废水绿狐尾藻人工湿地处理系统,经驯化后备用;养殖废水采集于附近养猪场,暴晒1 d后加入SD. 废水中ρ(TN)、ρ(NH4+-N)、ρ(NO2--N)、ρ(NO3--N)分别为(155.31±3.41)(106.87±8.54)(13.38±0.13)(15.31±3.16) mg/L,ρ(SD)设置为低浓度(10 μg/L)、中浓度(100 μg/L)、高浓度(1 000 μg/L)三组,依次记为SD10、SD100、SD1000,同时设置不加SD空白对照组,记为CK,每个处理组设3个重复. 根据已有研究[16],培养周期设计为28 d,分别在第0、7、14、21、28天采集水样并当天测定不同形态氮素浓度,同时采集底泥保存于-80 ℃ 冰箱用于DNA提取.
1.2 分析方法
1.2.1水样分析
定期采集水样后,用0.22 μm的水系滤头过滤,然后采用流动注射仪(AA3,SEAL,德国)直接测定ρ(NH4+-N)、ρ(NO2--N)和ρ(NO3--N). 经碱性过硫酸钾消解后,根据GB 11894—1989《水质 总氮的测定 碱性过硫酸钾消解紫外分光光度法》,采用流动注射仪测定ρ(TN).
1.2.2底泥微生物氨氧化和反硝化功能基因丰度分析
称取0.25 g冷冻干燥的底泥样品,按照Power Soil DNA Isolationkit试剂盒(MoBio,美国)操作说明,提取底泥总DNA. 用Nano-Drop核酸蛋白仪(NanoDropOne,Thermo,美国)和1%的琼脂电泳测定DNA质量. 将通过质量检测的DNA样品于-20 ℃冰箱保存备用.
实时荧光定量PCR(qPCR)反应体系按照SYBR® Premix Ex TaqTM(TakaRa,日本)说明书进行配置. qPCR反应循环条件:95 ℃预变性30 s;随后95 ℃变性15 s,57 ℃退火20 s(AOA-amoA、AOB-amoA和narG的退火温度均为55 ℃),72 ℃延伸20 s,反应进行40个循环. 使用已知浓度的质粒载体进行梯度稀释,并制备标准曲线. 每个样品3个重复,阴性对照用无菌水. 为消除不同批次扩增的误差,将每个基因的标准曲线、阴性对照和样品同时在384孔板上进行扩增,所用仪器为荧光定量qPCR仪(ABI7900,Applied Biosystems,美国),扩增效率从90%到110%且R2大于0.99时默认数据合格. 氮转化功能基因引物序列信息见表1.

表1 氮转化功能基因引物序列信息
1.2.3数据分析处理
采用Excel 2013和SPSS 21.0软件统计分析,Origin 2021软件作图. 数据在重复试验中取平均值和标准误. 选取单因素方差(One-way ANOVA)分析不同处理组间和组内差异,通过Pearson相关系数分析不同氮素浓度与氮转化功能基因丰度的相关性.
2 结果与讨论
2.1 水体中各氮素浓度及其占比变化
水体中ρ(TN)、ρ(NH4+-N)、ρ(NO2--N)和ρ(NO3--N)的变化见图1. 在28 d培养期内,ρ(TN)随时间逐渐下降,去除率为75.4%~80.5%,且添加SD处理组对水体TN去除无显著影响. 相比ρ(TN),ρ(NH4+-N)随时间下降更快,但SD1000处理组减缓了ρ(NH4+-N)降速,特别在第7天,4个处理组水体ρ(NH4+-N)的差异最大,SD10、SD100和SD1000处理组NH4+-N转化率分别为72.8%、59.1%和32.3%,与CK组比,SD100和SD1000处理组NH4+-N转化抑制率分别达14.0%和53.0%. 这与张敏等[11]在研究SD(100~500 mg/kg)对水产养殖池塘底泥脱氮过程时的结果一致,即SD会显著抑制NH4+-N的转化,浓度越高抑制作用越显著,且SD添加初期抑制作用最显著.

图1 ρ(TN)、ρ(NH4+-N)、ρ(NO2--N)和ρ(NO3--N)随培养时间的变化Fig.1 Changes in the concentration of TN, NH4+-N, NO2--N and NO3--N over incubation time
添加SD与否,对水体ρ(NO2--N)变化无显著影响,各处理组ρ(NO2--N)均在第14天时迅速下降,到21 d接近0 mg/L,但CK组在28 d略有回升. 添加SD对水体ρ(NO3--N)变化影响差异较大,在培养前期(0~7 d),CK和SD10处理组ρ(NO3--N)很快增至52.5 mg/L,而SD100和SD1000处理组则分别在第14 天和第21天增至52.5 mg/L左右. 这说明SD抑制了ρ(NO3--N)升高,且浓度越高抑制越明显,其中SD100和SD1000处理组抑制率在第7天达最大值,分别为75.5%和99.5%. Wang等[12]在研究SD对池塘底泥脱氮效果影响时也发现,SD会抑制NO3--N的还原而导致ρ(NO3--N)升高,其中50和 1 000 μg/L的SD对NO3--N抑制率分别为26%和21%.
水体中不同氮素浓度占TN的比例如图2所示. 在试验第21天后,各试验处理组间各氮素组分及占比无显著性差异,这表明随时间推移,SD对试验后期氮转化的影响逐渐消失. 王燕等[23]通过室内好气培养法研究SD对水稻土氮矿化影响时也发现,当SD浓度低于2 mg/kg时,随SD浓度升高,其抑制作用增大,氮净矿化在前21 d快速降低,在第21~25天降速减慢. 这可能是随培养时间增加,一方面底泥中SD逐渐降解而浓度降低,或SD作为微生物活动氮源一部分被分解而浓度降低,导致对微生物氮转化的抑制作用降低[24];另一方面可能是由于在培养期底泥氮转化相关微生物对SD产生抗性,适应性增强,使得在培养后期SD对氮转化微生物抑制作用减弱[25].
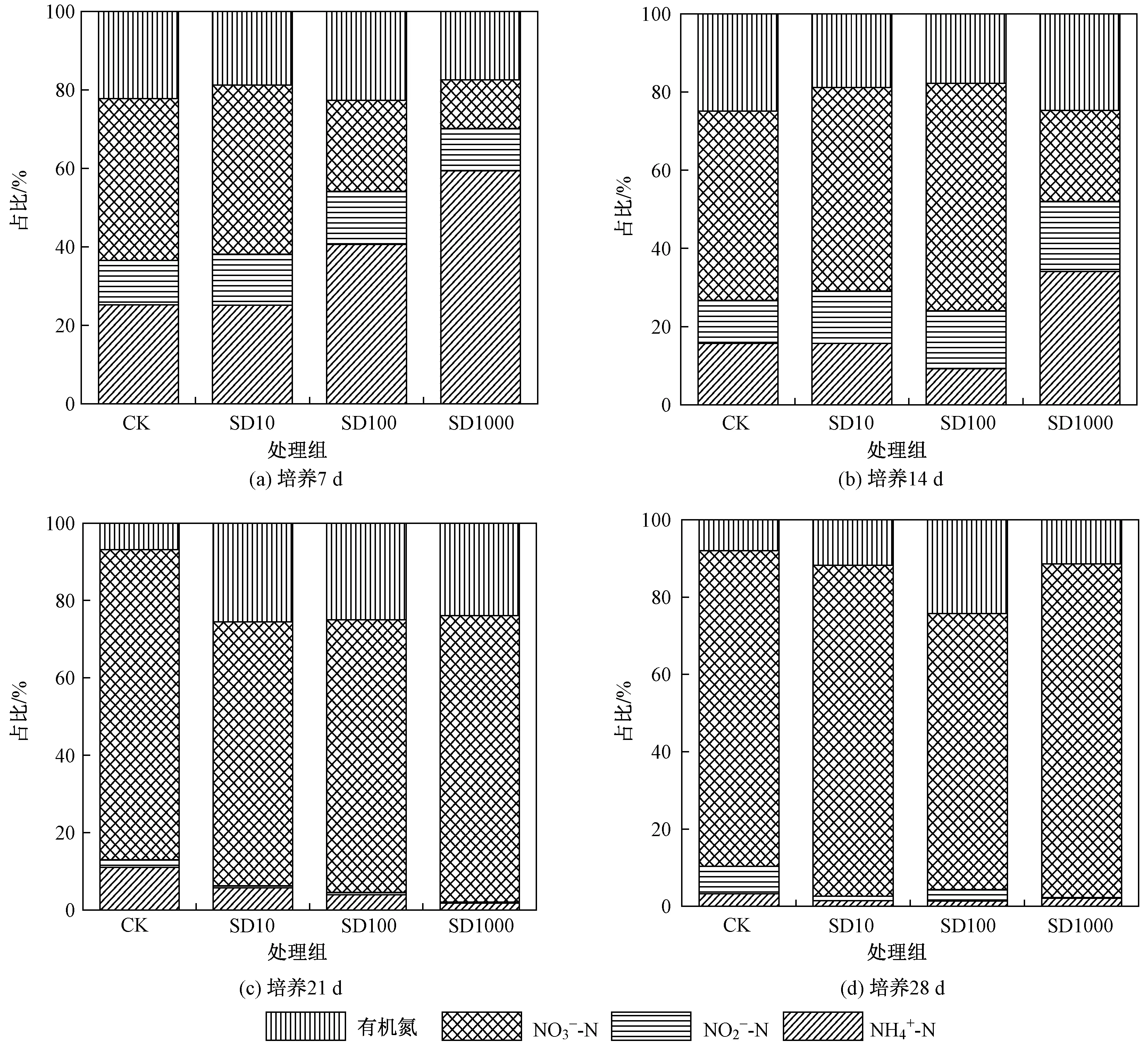
图2 4个处理组中不同形态氮占TN比例的变化Fig.2 Changes in the proportion of different nitrogen forms to TN in four treatments
2.2 SD对底泥微生物中amoA基因丰度的影响
氨氧化是氮素转化的关键过程,由含氨单加氧酶基因(amoA)的AOA和AOB共同驱动,是硝化作用的限速步骤. 通过qPCR来测定其特异性amoA基因丰度的变化,能有效反映其反应体系中氨氧化微生物AOA和AOB丰度的变化[26].
如图3所示,底泥中AOA和AOB的丰度分别为5.51×107~3.34×108和1.31×106~1.26×107copies/g. AOA的丰度比AOB高出1~2个数量级,这与Limpiyakorn等[27]研究结果一致,由于古细菌细胞壁和膜的差异,AOA在环境中耐受性较强,分布范围广泛,说明AOA可能在氨氧化过程中起主导作用[28].
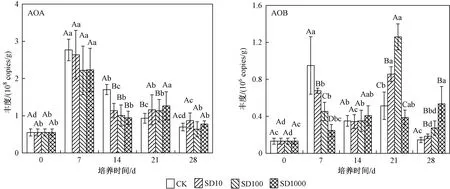
注:不同大写字母代表同一时间不同处理间差异显著(P<0.05),不同小写字母代表同一处理不同时间差异显著(P<0.05). 下同.图3 4个处理组的AOA和AOB丰度随培养时间的变化Fig.3 Changes in the abundance of AOA and AOB in four treatments over incubation time
在第7天,各处理组的AOA丰度达到最高,然后逐渐降低. 相比于CK组,SD添加在14 d时AOA丰度先降低,后略有升高,培养末期(第28天),恢复至与CK组无显著性差异,SD仅在试验前期降低了AOA丰度. 这与已有的研究结果相一致,如张敏等[11]对淡水池塘沉积物中AOA和AOB的丰度和群落结构研究时发现,100 mg/L SD能显著抑制AOA丰度,但在第21天后,各组间AOA丰度无显著性差异;Liu等[29]也发现,在培养试验前期,5 mg/L SD能显著抑制AOA丰度,但在第28天时AOA丰度较CK组无显著性差异,说明SD对AOA的抑制作用可能会随着培养时间的增加而减弱.
与AOA相比,添加SD的处理组AOB丰度在第7天抑制效果达到显著水平,降幅为28.7%~74.0%,AOB丰度随抗生素浓度升高而显著降低,Schauss等[30]在研究SD对土壤中AOA的动力学和功能关联时发现,10和 100 mg/kg SD对AOA的抑制常数均为30 mg/kg,对AOB的抑制常数分别为0.01和10 mg/kg,而抑制常数越大,抑制作用越小,这说明AOB对土壤中SD的抑制更为敏感. 第14天,4个处理组之间的差异不显著;但到第21天,SD10和SD100两个处理组的AOB丰度显著高于CK和SD1000处理组;第28天,SD1000处理组的AOB丰度最高,且随SD浓度增加AOB丰度也呈现相应的增加趋势. 这与Wang等[31]研究结果一致,即在50和100 μg/L SD处理下硝化污泥中氨氧化活性受强烈抑制,但在48 h后恢复,AOB能够克服SD带来的不利影响致使其丰度上升,且SD浓度越高,AOB丰度增加越多. Yu等[32]也发现,随时间增加不利因素对AOB的抑制转变为刺激,从而在培养后期使得AOB数量增加,其原因可能是AOB在SD降解和长期适应中具有了抗药性[31],可见SD对AOB的抑制作用可能会随着培养时间的增加而变成刺激作用.
2.3 SD对底泥微生物中narG、nirS、nirK和nosZ基因丰度的影响
微生物反硝化作用是将硝酸根还原成NO2-、NO、N2O或N2的过程,由多种厌氧或兼性厌氧微生物参与的系列酶催化反应组成,包括硝酸还原酶(Nar)、亚硝酸还原酶(Nir)、一氧化氮还原酶(Nor)和氧化亚氮还原酶(Nos)等,相应编码基因分别为narG、nirK或nirS、norB、nosZ[26].
试验期间,底泥中4个反硝化功能基因(narG、nirS、nirK和nosZ基因)的丰度分别为1.09×109~2.51×109、8.10×108~5.51×109、2.30×108~2.52×109、5.10×107~2.91×108copies/g(见图4).narG、nirS、nirK和nosZ基因丰度随时间变化规律与AOA和AOB类似,都在第7天达到最高值,与CK组相比,添加SD都降低了反硝化基因丰度,但只有SD1000处理组达到显著性差异. 第14天,4个处理组间的narG和nirK基因丰度差异不显著;但与CK和SD10处理组比较,SD100和SD1000处理组显著降低了nirS和nosZ基因丰度. 第21天,添加SD处理总体上增加了反硝化基因丰度,但均未达到显著水平. 在第28天时,反硝化功能基因丰度均无显著性差异.
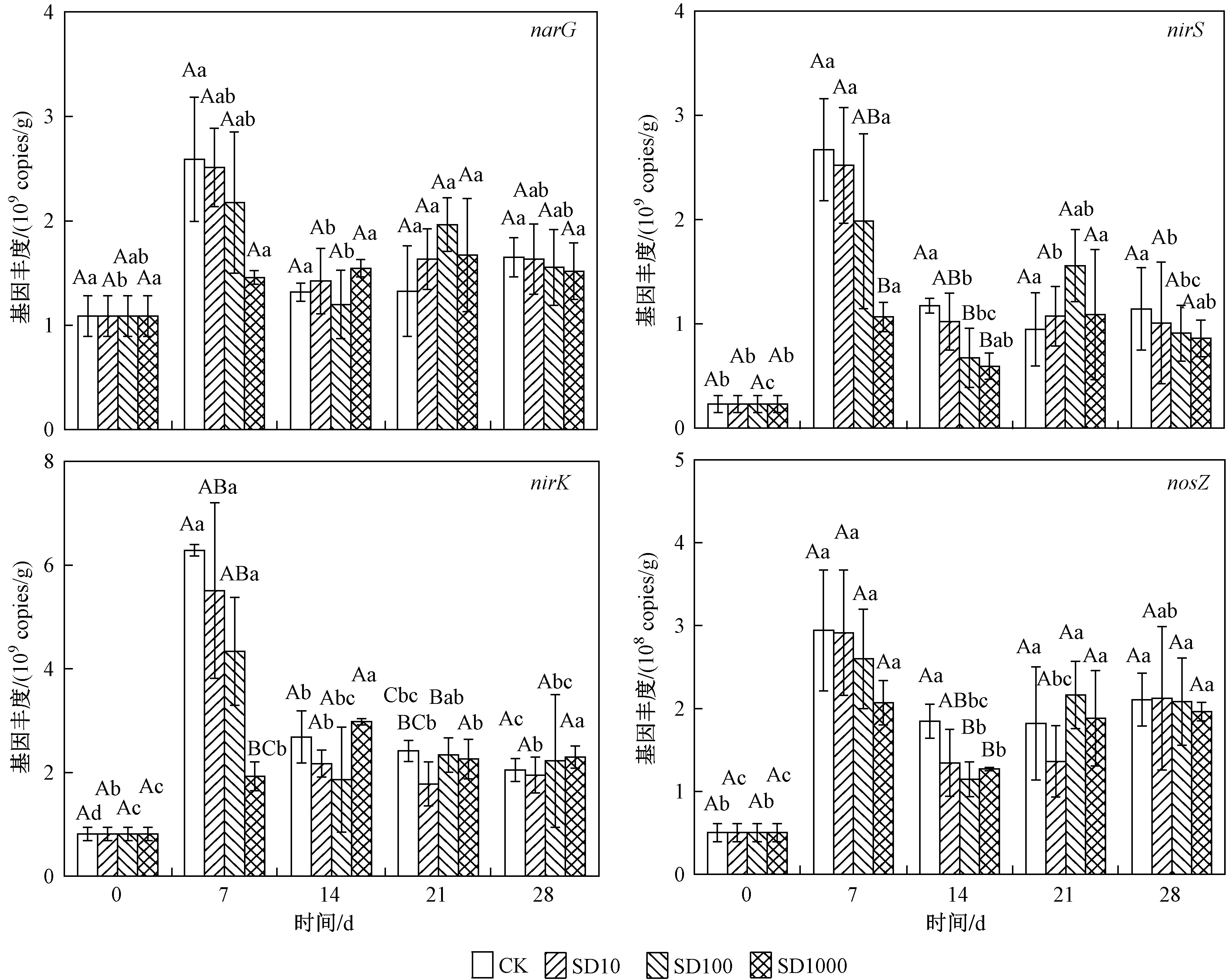
图4 4个处理组的narG、nirS、nirK和nosZ基因丰度随培养时间的变化Fig.4 Changes in the abundance of narG, nirS, nirK and nosZ genes in four treatments over incubation time
在培养前期SD添加浓度高于100 μg/L时,narG、nirS和nirK的基因丰度降低,且在SD添加浓度为 1 000 μg/L时,narG、nirS和nirK基因丰度显著低于其他SD添加组和CK组. Zou等[33]研究地下水中以假单胞菌为主的反硝化菌对各类抗生素敏感性时发现,反硝化细菌对磺胺甲恶唑敏感性的临界值约为100 μg/L,当磺胺甲恶唑高于100 μg/L时反硝化细菌均被显著抑制,这表明反硝化基因narG、nirS和nirK对磺胺类抗生素的敏感性临界值可能具有一致性,值得进一步研究. 在第14天,SD1000处理组的nosZ基因丰度显著低于CK组,表明高浓度SD抑制了nosZ基因丰度. Wang等[12]研究发现,在池塘底泥中50 μg/L和 1 000 μg/L SD处理组有效降低了nosZ基因丰度;Yin等[34]研究也发现,长江沉积物中磺胺类抗生素对nosZ基因影响最大,具有显著抑制作用,其原因可能是SD通过抑制叶酸合成抑制大多数革兰氏阳性和许多革兰氏阴性细菌的生长[35],从而抑制反硝化菌中nosZ基因丰度增加.
试验后期反硝化功能基因narG、nirK、nirS和nosZ的丰度均无显著性差异,这说明SD对微生物抑制作用在后期减弱甚至消失. Liu等[36]发现磺胺甲恶唑在土壤中第7天的降解率达90%,且在试验前期土壤微生物群落功能多样性降低,在试验后期微生物影群落多样性相应恢复,其原因可能是:①SD降解导致其浓度降低,自身消除了药效,从而使得抑制强度降低;②随硝化与反硝化微生物与SD接触时间增加,微生物体内抗生素抗性基因丰度增加,导致对SD产生了抗药性. Shan等[37]的研究证实,磺胺类抗生素抗性基因(sul1和sul3)丰度与SD浓度(大于600 μg/L)呈正相关,且磺胺类抗生素抗性基因可能对磺胺胁迫下的脱氮生化途径形成保护机制.
2.4 水体不同形态氮组分与底泥微生物氨氧化和反硝化功能基因的关联性
Pearson相关性分析结果(见表2)显示,AOA丰度与ρ(TN)、ρ(NH4+-N)和ρ(NO2--N)均呈显著正相关(P<0.05),而AOB丰度与ρ(NO3--N)呈极显著正相关(P<0.01). 这说明相比于AOB,AOA可能与水体氮转化过程及氮素形态变化关系更为密切,这与已有的研究结果[30]类似,可能是因为AOA对环境的耐受性更强,分布范围更广. 该研究中AOA丰度比AOB高出1~2个数量级,说明AOA可能在氨氧化过程中起主导作用[27]. 反硝化功能基因nirK与ρ(TN)和ρ(NO2--N)均呈极显著正相关(P<0.01),且nirK、nirS、AOA和AOB四者间均呈极显著正相关. Liu等[16]研究结果显示,nirK基因比nirS基因对环境因子的响应更敏感,说明nirK基因在反硝化过程中起着更为重要的作用[38]. 此外,AOA及AOB主导的氨氧化过程,是氮转化过程的限速步骤,说明可能由于抗生素对AOA和AOB产生影响,进而间接影响反硝化过程. 由此可见,抗生素可能通过直接或间接影响硝化反硝化基因丰度,进而影响养殖废水中氮的转化和去除[39],但具体的作用机制还需要进一步研究.
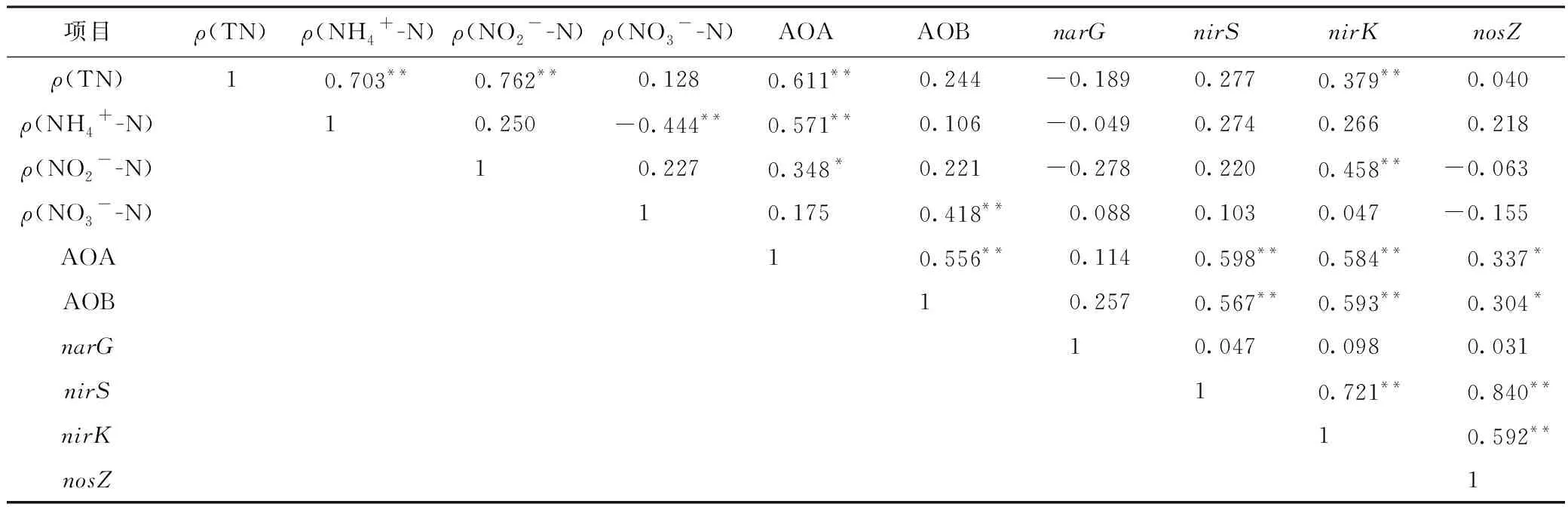
表2 不同氮素浓度与氮转化功能基因丰度的Pearson相关性
3 结论
a) 室内模拟试验结果表明,与CK组比较,添加SD处理组对湿地养殖废水中TN的最终效果无显著影响,TN去除率为75.4%~80.5%,且到第28天,各处理组中各形态氮素占比无显著差异;SD对各形态氮的转化过程产生抑制作用,在第7天抑制效果最强,对水体NH4+-N转化的抑制率最高达53.0%,对水体NO3--N转化的抑制率最高达99.5%,且随着SD浓度的增加抑制作用越强.
b) SD在试验早期(前14 d)抑制了湿地底泥氨氧化菌和反硝化菌中相关功能基因丰度增加. AOA在氨氧化过程中占主导地位,AOA丰度较AOB高出1~2个数量级,AOB对SD更为敏感,产生抑制作用早于AOA;SD对narG、nirS和nirK、nosZ均产生抑制现象,在第7天和第14天抑制效果最强,与SD浓度呈正相关. 但随培养时间增加,抗生素抑制作用会减弱,除AOB丰度增加外,各处理组间底泥微生物其他氮转化功能基因丰度均无显著性差异.
c) 通过相关性分析表明,AOA与ρ(NH4+-N)呈极显著正相关(P<0.01),AOB与ρ(NO3--N)呈极显著正相关(P<0.01),nirK与ρ(NO2--N)呈极显著正相关(P<0.01),narG、nirS和nosZ与水体中的氮素浓度不显著相关.

