人参皂苷Re对异丙肾上腺素诱导离体灌流大鼠心脏心律失常的调节作用
曹瑀莹,杜丙秀,李劭恒,袁 硕, ,陶雅军,刘丽萍*,陈颖卿*
1.大连大学 慢性病研究中心大连市重点实验室,辽宁 大连 116622
2.延边大学,吉林 延吉 133022
心律失常指心律起源部位、心搏频率与节律以及冲动传导等任一项异常,是心血管疾病中的常见病和多发病。目前我国心血管病患病人数达2.9亿,而心律失常患者约有2000万人。因此,防治心律失常十分重要。临床上心律失常按照心率的快慢可分为快速型和缓慢型心律失常,其中快速型心律失常的发病率、严重性、治疗难度远大于缓慢型心律失常。人参是百草之王,用于治疗心血管疾病已有2000多年的历史。人参皂苷是人参中主要的活性成分,其中人参皂苷Re是最关键的生物活性成分[1]。人参皂苷Re对心血管系统具有较好的保护作用,如改善心肌重构和纤维化[2-4]、缓解心肌缺血再灌注损伤[5-6]、减轻心肌损伤[7]、抗心律失常[8-12]、促进血管再生[13]。
G蛋白偶联的信号传递通路是细胞信号传导中的重要途径,G蛋白偶联受体(G protein-coupled receptor,GPCR)是人体内最大的膜蛋白受体家族,目前72.9%心血管疾病药物以GPCR为靶点[14-15]。β-肾上腺素能受体(β-adrenergic receptor,β-AR)属于细胞膜上GPCR超家族,在心脏生理活动中起着重要的作用。当异丙肾上腺素(isoprenaline,ISO)刺激β-AR时,可以上调GPCR,进而激活细胞内腺苷酸环化酶(adenylyl cyclase,AC),使细胞内环磷酸腺苷(cyclic adenosine monophosphate,cAMP)升高,进一步激活蛋白激酶A(protein kinase A,PKA),引起钙通道蛋白的磷酸化,使细胞内Ca2+超载,从而引起心律失常[11]。
炎性因子作为炎性反应中活化细胞产生的具有高活性、多功能的可溶性肽,可通过多种机制调控心血管功能。趋化因子是一组具有特定吸引功能的细胞因子,迄今发现的52个趋化因子中,19个趋化因子与动脉粥样硬化、高血压、心肌肥大、心衰、冠状动脉疾病等心脏疾病相关[16]。趋化因子也参与损伤反应的早晚期,并与心律失常和心脏移植的慢性排斥反应密切相关[17]。在心肌细胞中,炎性因子释放引起的炎性反应会造成心肌细胞损伤,当产生心肌损伤后,往往会导致心律失常的发生。此外,炎性反应也可以导致心肌传导的不均一性,易引起心室重构和室性心律失常的发生[18]。
本研究通过构建ISO诱导的大鼠快速型心律失常模型,观察人参皂苷Re的抗心律失常作用,并探讨人参皂苷Re缓解快速型心律失常的潜在作用机制,为临床开发低毒高效的抗心律失常药物提供依据。
1 材料
1.1 动物
SPF级雄性Wistar大鼠(10~12周龄,体质量280~320 g)以及Wistar新生乳鼠(≤3 d)均购自大连医科大学动物中心。Wistar大鼠适应性饲养1周,自由进食饮水,温度(23±1)℃,相对湿度50%~70%,光/暗周期12 h,环境噪声低于50分贝。动物实验经大连大学附属中山医院实验动物福利与伦理委员会批准(批准号202004038)
1.2 药品与试剂
人参皂苷Re(质量分数为98%,批号wkq16081605)购自四川省维克齐生物科技有限公司;盐酸ISO(批号BCBL3022V)、NaCl(批号BCBV3784V)、KCl(批号BCBQ0895V)、MgSO4·7H2O(批号BCBJ7824V)、NaH2PO4(批号BCBM7996V)、NaHCO3(批号SLBZ5815)、HEPES(批号SLBL5403V)、CaCl2(批号I1020)、MgCl2(批号H0950)、葡萄糖(批号071M0145V)、胰酶(批号 SLBM4075V)和谷氨酰胺(批号RNBD5611V)购自美国Sigma公司;盐酸普萘洛尔(批号26496)购自美国MedChemExpress公司;胶原酶A(批号33278522)购自瑞士Roche公司;水合氯醛(批号20190801)购自天津市大茂化学试剂厂;DMEM培养基(批号811723)、双抗(批号2029632)购自美国Gibco公司;胎牛血清(批号1719426)购自以色列BI公司;肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)ELISA试剂盒(批号06/2019)、白细胞介素-6(interleukin-6,IL-6)ELISA试剂盒(批号08/2019)购自上海语纯生物技术有限公司;趋化因子1(C-X-C motif chemokine 1,CXCL1)ELISA试剂盒(批号J21032177)、CXCL2 ELISA试剂盒(批号I11031020)、CXCL3 ELISA试剂盒(批号K1802176)购自武汉华美生物工程有限公司。
1.3 仪器
EMS64-USB-1002型多电极阵列映射系统(英国MappingLab公司);NIUSB-6001型荧光共振能量转移系统(英国CAIRN公司);SpectraMax Plus 384型多功能酶标仪(美国MD公司)。
2 方法
2.1 原代乳鼠心肌细胞的分离与培养
新生Wistar乳鼠处死后立即取出心脏,放置于预冷的台式液(135 mmol/L NaCl、4.5 mmol/L KCl、20 mmol/L HEPES、11 mmol/L葡萄糖、1 mmol/L MgCl2、2 mmol/L CaCl2)中洗去血液,将心室肌剪成1 mm3小块,移至含5 mL胶原酶A(0.45 mg/mL)的台式液中,于37 ℃轻轻搅拌消化15 min,弃上清,重复2次。加入含5 mL胰酶(1.25 mg/mL)的台式液,于37 ℃轻轻搅拌消化5 min,收集上清于1 mL胎牛血清中,800 r/min离心5 min,弃上清;胰酶重复消化4~5次,直至所有组织消化,收集全部细胞液,800 r/min离心5 min,用原代心肌细胞培养液(84.5% DMEM培养基、15%胎牛血清、1%谷氨酰胺、0.1%双抗)重悬细胞,于培养箱中贴壁培养2 h后收集上清,离心后进行细胞培养。
2.2 CCK-8检测人参皂苷Re对原代乳鼠心肌细胞存活率的影响
取分离好的原代乳鼠心肌细胞,以1×106/mL接种于96孔板中,100 μL/孔,于培养箱中培养24 h。设置对照组和人参皂苷Re(1.0、2.5、5.0、10.0、25.0、50.0 μmol/L)组,各给药组加入相应药物,对照组加入不含药物的培养基,培养24 h。每孔加入10 µL CCK-8,于37 ℃孵育3 h,采用多功能酶标仪测定450 nm处的吸光度(A)值,计算细胞存活率。
细胞存活率=A给药/A对照
2.3 离体心脏Langendorff灌流
根据课题组前期研究结果[3],将人参皂苷Re浓度定为5 µmol/L。Wistar大鼠ip 10%水合氯醛(3 mL/kg)麻醉,进行开胸手术,取出心脏立即放入含肝素(10 mg/L)和饱和气体(95% O2、5% CO2)的冰冷Krebs-Henseleit缓冲液(120.3 mmol/L NaCl、4 mmol/L KCl、1.3 mmol/L MgSO4·7H2O、1.2 mmol/L NaH2PO4、1.2 mmol/L CaCl2、25.2 mmol/L NaHCO3、11 mmol/L葡萄糖)中,快速摘除结缔组织和肺组织,留下3~4 mm主动脉,将主动脉插管并连接到Langendorff灌流系统上,以7 mL/min速度主动脉逆行灌流正常缓冲液或工具药。灌流液全程37 ℃恒温、持续供氧。实验方案见图1。

图1 离体心脏灌流实验方案Fig.1 Experimental protocol of isolated heart perfusion
对照组灌流4个循环缓冲液;ISO组经过3个对照循环,灌流1个循环ISO(0.5 µmol/L);人参皂苷Re+ISO组经过2个对照循环,预灌流1个循环人参皂苷Re(5 µmol/L),然后在人参皂苷Re存在下,灌流1个循环ISO(0.5 µmol/L);非选择性β-AR抑制剂普萘洛尔组经过2个对照循环,预灌流普萘洛尔(1 µmol/L)1个循环,然后在普萘洛尔存在下,灌流1个循环ISO(0.5 µmol/L);人参皂苷Re组经过1个对照循环,分别灌流人参皂苷Re(1、5、10 µmol/L)各1个循环。
2.4 多电极阵列映射系统检测人参皂苷Re对ISO所致心律失常大鼠左右心室肌心外膜电生理指标的影响
离体心脏固定到Langendorff灌流装置上,2个多通道电极分别贴附右心室和左心室游离壁,并连至多电极阵列映射系统上,对心脏电位进行多点同步标测。每5分钟设为1个实验循环,待各组大鼠心脏搏动稳定20 min后,开始记录心率、动作电位传导速度和传导方向等指标。每个多电极阵列(MEA PA03206060203)由32个直径为0.1 mm的电极组成,在6×6网格(尺寸为6 mm×6 mm)中,电极间距为1.2 mm。64个记录电极连接到64通道放大器和数据采集系统。每个通道的采样频率设置为10 kHz,场电位记录与放置在心脏灌注金属套管上的参比电极的场电位记录相对应,MEA使用EMapScope软件提供了细胞外场电位的无创同步64通道记录。EMapScope软件允许实时监测所有64个通道的场电位,以此为基础计算心率;根据记录阵列中第1个检测到的波形的相对延迟计算每个通道的激活时间。为了生成心外膜传播图,在显示原始记录阵列布局的6×6网格中,用色标表示每个通道的激活时间,生成心外膜传播图,以便更清晰地查看传导模式和传导方向。
2.5 苏木素-伊红(HE)染色检测心肌组织损伤
ISO组、ISO+人参皂苷Re组以及普萘洛尔+ISO组离体心脏的灌流持续时间延长至2个循环,以便明显观测其心肌组织损伤程度。取Langendorff灌流大鼠心脏放入4%多聚甲醛固定液中,进行常规石蜡包埋,切片后进行脱蜡水化,通过苏木素染色、分化液分化、伊红染色后,脱水、透明、封片,根据脂肪变性程度评价人参皂苷Re对ISO诱导的离体大鼠心肌组织病理变化的保护程度。
2.6 人参皂苷Re对ISO诱导原代乳鼠心肌细胞cAMP和PKA含量的影响
将原代乳鼠心肌细胞以3×105/孔接种于6孔板内的载玻片上,转染cAMP或PKA荧光探针(Epac-SH187或AKAR4),12 h后,将载玻片移入荧光共振能量转移成像系统(fluorescence resonance energy transfer,FRET)。采用FRET动态观察cAMP和PKA含量变化。通过激发青色荧光蛋白(cyan fluorescent protein,CFP)480 nm后,计算CFP与黄色荧光蛋白(yellow fluorescent protein,YFP)荧光发射强度比值(480 nm/535 nm)的变化实时观察cAMP含量;通过计算YFP与CFP荧光发射强度比值(535 nm/480 nm)的变化实时观察PKA含量。实验方案见图2。

图2 原代乳鼠心肌细胞实验方案Fig.2 Experimental protocol of primary neonatal rat cardiomyocytes
2.6.1 ISO不同浓度组 基线平稳后,记录2 min细胞正常状态后,每4分钟分别给予ISO(0.1、1.0、5.0 nmol/L)、25 µmol/L腺苷酸环化酶激活剂(Forskolin)和100 µmol/L磷酸二酯酶抑制剂(IBMX)。Forskolin激活腺苷酸环化酶,进而激活cAMP,IBMX抑制cAMP降解,二者共同作用使心肌细胞cAMP含量达到饱和。
2.6.2 人参皂苷Re+ISO组 细胞预先孵育人参皂苷Re 20 min后,再给予不同浓度ISO和Forskolin(25 µmol/L)+IBMX(100 µmol/L)。
2.6.3 人参皂苷Re组 基线平稳后,记录2 min细胞正常状态后,每4分钟分别给予人参皂苷Re(5、10 µmol/L)、Forskolin(25 µmol/L)和IBMX(100 µmol/L)。
实时检测细胞内cAMP/PKA含量变化,明确ISO所致心律失常传导通路及人参皂苷Re的干预作用。
2.7 高通量基因测序与生物信息分析
Langendorff灌流结束后立即取下心脏,剪取心尖部位放置RNA保护液中,寄至上海华大基因科技有限公司,将对照组和ISO组大鼠心室肌进行高通量基因测序和生物信息分析,以检测心律失常模型组的可能致病基因。
2.8 ELISA法检测心肌组织炎性因子水平
取Langendorff灌流后的离体心脏,于冰上剪碎、匀浆,取上清液,按照ELISA试剂盒说明书检测各组离体心脏组织上清液CXCL1、CXCL2、CXCL3、TNF-α和IL-6水平。
2.9 统计学分析
应用Prism(6.0版)统计软件进行统计学分析,数据以±s表示,组间比较采用单因素方差分析并进行两两比较。
3 结果
3.1 人参皂苷Re对原代乳鼠心肌细胞存活率的影响
如图3所示,人参皂苷Re(1~50 μmol/L)对原代乳鼠心肌细胞的存活率无影响。
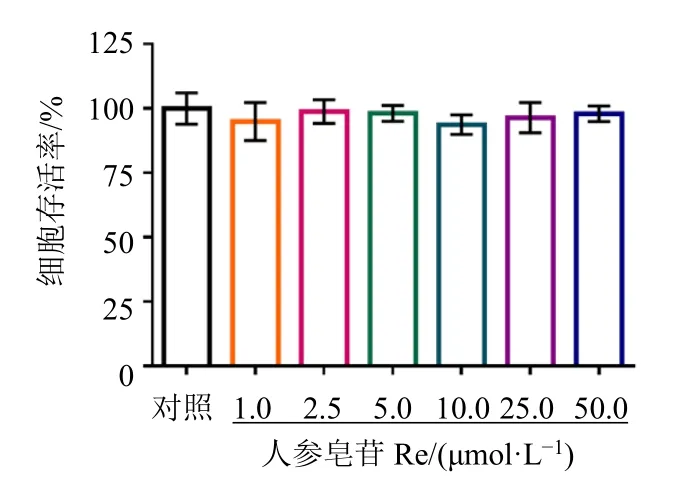
图3 人参皂苷Re对原代乳鼠心肌细胞存活率的影响(±s, n = 5)Fig.3 Effect of ginsenoside Re on survival rate of primary neonatal rat cardiomyocytes (±s, n = 5)
3.2 人参皂苷Re对ISO所致心律失常大鼠心室肌传导方向、传导速度及心率的影响
多电极阵列映射系统笔试电极分别贴附左右心室心外膜表面(图4-A),2个32通道电极在左右心室上对应位置,在1次心跳中,每个通道都会得到1个激活时间。根据各个通道在1次心跳的激活时间顺序进行色彩分级,箭头所指方向可见深红色代表最早激活,深蓝色代表最晚激活,将比例图转换成等时图,更加凸显传导模式和方向以及传导过程中的任何心律失常情况(图4-B)。
如图4-C所示,与对照组比较,ISO组大鼠心率显著增加(P<0.05);与ISO组比较,人参皂苷Re+ISO组大鼠心率明显降低(P<0.05)。如图4-D所示,与对照组比较,ISO组左心室传导速度明显增加,传导方向紊乱。如图4-E所示,与对照组比较,人参皂苷Re(5 µmol/L)预处理5 min,左右心室传导方向没有改变,左心室传导速度略微减慢,但不明显;在人参皂苷Re存在下,灌流ISO 5 min,传导方向和传导速度均未见明显变化。如图4-F所示,与对照组比较,普萘洛尔(1 µmol/L)预处理5 min,左右心室传导方向没有改变,左心室传导速度略微增加;在普萘洛尔存在下,灌流ISO 5 min,传导方向未见明显改变,左心室传导速度略有加快。如图4-G所示,灌流不同浓度的人参皂苷Re(1、5、10 µmol/L)后,左右心室的传导速度和传导方向均未见明显变化。以上结果表明,人参皂苷Re显著下调ISO所致的心率增加,明显抑制ISO所致心律失常大鼠心室肌传导方向、传导速度的改变。人参皂苷Re对ISO所致离体大鼠心室肌快速型心律失常具有明显的抑制作用。

图4 人参皂苷Re改善快速型心律失常的心肌电活动Fig.4 Ginsenoside Re improves myocardial electrical activity in tachyarrhythmia
3.3 人参皂苷Re对ISO所致心律失常离体大鼠心肌损伤的影响
如图5所示,与对照组比较,ISO组大鼠心肌细胞脂肪变性严重程度增加;人参皂苷Re(5 µmol/L)预处理5 min后,再给予ISO+人参皂苷Re处理10 min时,心肌细胞脂肪变性严重程度降低;普萘洛尔(1 µmol/L)预处理5 min再给予ISO+普萘洛尔处理10 min时,心肌损伤也得到了缓解。表明人参皂苷Re能够明显减轻ISO诱导的离体灌流大鼠心肌损伤。
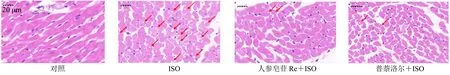
图5 人参皂苷Re对ISO所致心律失常离体大鼠心肌损伤的影响 (HE, ×400)Fig.5 Effect of ginsenoside Re on myocardial injury in isolated cardiomyocytes of rats with arrhythmia induced by ISO (HE, × 400)
3.4 人参皂苷Re对ISO诱导原代乳鼠心肌细胞cAMP/PKA通路及其细胞形态学的影响
3.4.1 人参皂苷Re对ISO所致原代乳鼠心肌细胞cAMP和PKA含量变化的影响 不同浓度ISO(0.1、1.0、5.0、10.0 nmol/L)对FRET cAMP荧光团标记物YFP和CFP荧光强度变化见图6-A,cAMP含量用CFP与YFP比值(480 nm/535 nm)表示,心肌细胞颜色变化代表不同时间段细胞内cAMP含量变化(图6-B)。待心肌细胞稳定后,分别孵育人参皂苷Re(5、10 µmol/L)各4 min,随后加入Forskolin、IBMX孵育2 min,使心肌细胞cAMP含量达到饱和。如图6-C所示,不同浓度人参皂苷Re对乳鼠心肌细胞内cAMP含量无影响。以人参皂苷Re(5 µmol/L)预处理心肌细胞20 min,再以不同浓度的ISO(0.1、1.0、5.0 nmol/L)各处理4 min,如图6-D~G所示,与单独给予不同浓度ISO处理比较,人参皂苷Re显著降低不同浓度ISO所致乳鼠心肌细胞cAMP和PKA含量。表明人参皂苷Re能够通过抑制cAMP/PKA通路缓解ISO所致快速型心律失常的发生。

图6 人参皂苷Re对ISO所致原代乳鼠心肌细胞cAMP和PKA含量变化的影响Fig.6 Effect of ginsenoside Re on content change of cAMP and PKA in primary neonatal rat cardiomyocytes induced by ISO
3.4.2 原代乳鼠心肌细胞内cAMP和PKA含量改变时的荧光及细胞形态变化 心肌细胞颜色变化代表不同时间段细胞内cAMP含量变化,细胞颜色越绿表示cAMP含量越高,颜色越蓝表示PKA含量越高。如图7-A所示,不同浓度的人参皂苷Re对原代乳鼠心肌细胞内cAMP的荧光强度没有明显改变。如图7-B所示,当给予不同浓度ISO时,随着ISO浓度的增加,原代乳鼠心肌细胞颜色越绿,表明其cAMP含量不断增加,在ISO浓度为1 nmol/L时cAMP含量基本达到饱和。如图7-D所示,随着ISO浓度的增加心肌细胞颜色愈发变蓝,表明其PKA含量不断增加。如图7-C、E所示,当给予人参皂苷Re(5 µmol/L)预处理后,心肌细胞的颜色变化明显减小。由于药物处理时间较短,细胞未见明显形态学变化。
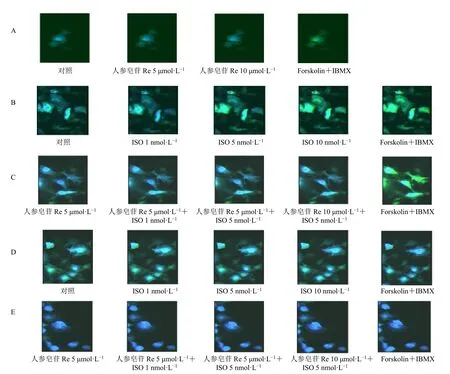
图7 人参皂苷Re抑制ISO所致的原代乳鼠心肌细胞中cAMP (A、B、C) 和PKA (D、E) 含量增加时的细胞变化 (×1000)Fig.7 Cellular changes with increase of cAMP (A, B, C) and PKA (D, E) content in ISO-induced primary neonatal rat cardiomyocytes inhibited by ginsenoside Re (× 1000)
3.5 人参皂苷Re对ISO所致离体灌流大鼠心室肌炎性因子水平的影响
为了找到对照组和模型组的差异基因,从而锁定药物治疗靶标,本研究对对照组和ISO组大鼠心室肌进行高通量基因测序及生物信息分析,发现与炎性反应相关35个基因、趋化因子介导的信号通路12个基因、细胞因子24个基因、趋化因子11个基因在ISO组中高表达(图8-A)。随后对差异基因进行筛选,如图8-B所示,与对照组比较,ISO组大鼠心室肌CXCL1、CXCL2、CXCL3、TNF-α和IL-6水平均显著增加(P<0.05);与ISO组比较,人参皂苷Re+ISO组大鼠心室肌CXCL1、CXCL2、CXCL3、TNF-α和IL-6水平均显著降低(P<0.05)。表明人参皂苷Re能够通过降低ISO所致部分趋化因子和细胞因子的上调抑制心律失常。
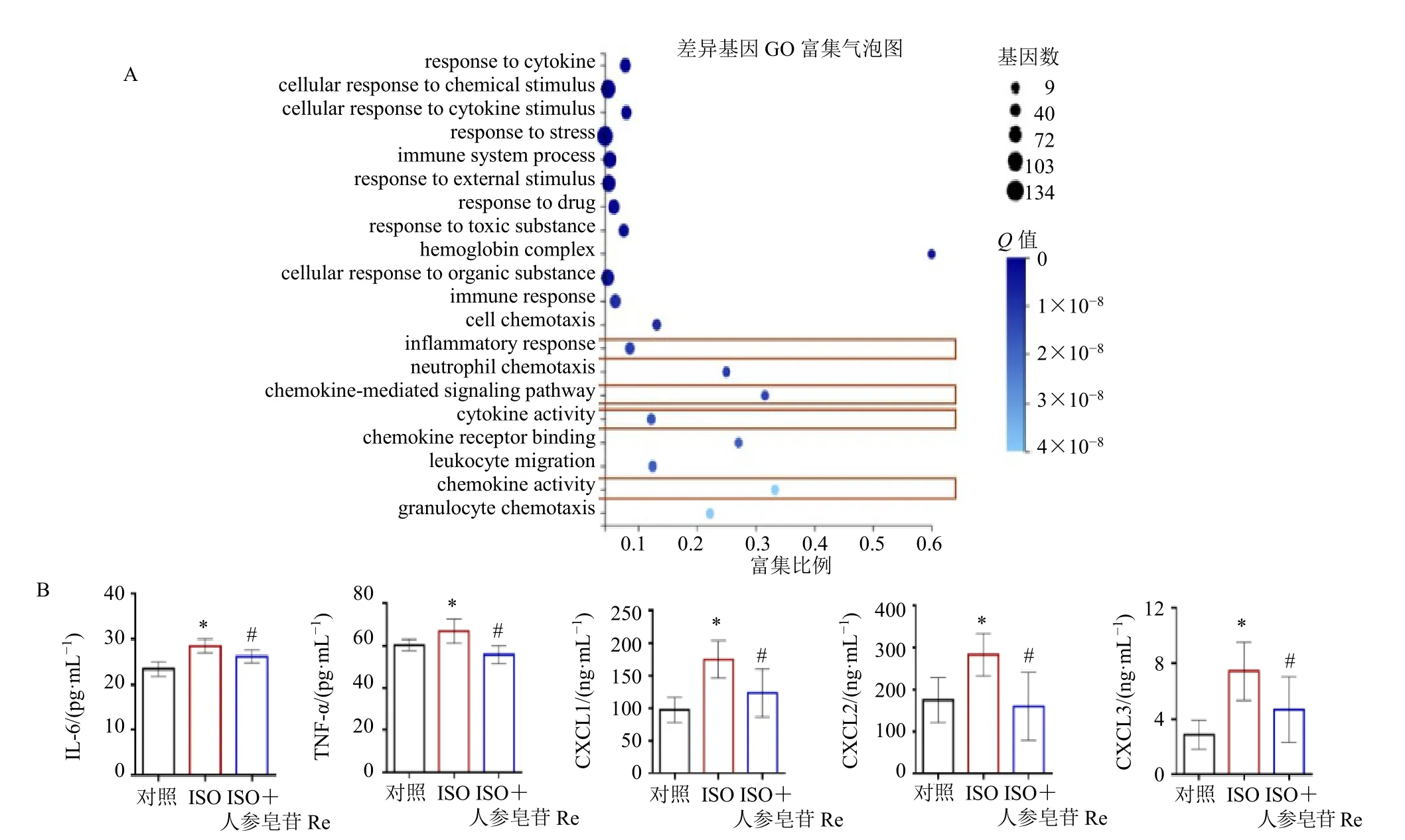
图8 基因差异生物信息学分析 (A) 以及人参皂苷Re抑制ISO所致离体灌流大鼠心室肌炎性因子水平 (B)Fig.8 Genetic difference bioinformatics analysis (A) and ginsenoside Re inhibits levels of inflammatory factors in isolated rat ventricular muscles induced by ISO (B)
4 讨论
心律失常是心血管系统最常见病症之一,可突然发作而致猝死,亦可持续累及心脏而致其衰竭。近年来,抗心律失常化学药在临床应用的安全性不断受到质疑,很多药物本身存在局限性及不良反应,且有致心律失常作用[19],因此,从药用植物中寻找高效低毒的化合物用于心律失常的防治受到各国学者的高度重视[20]。
既往研究表明,人参皂苷Re对心律失常起着重要的调节作用[21]。陈彩霞等[10-11]在ISO诱导的兔心律失常模型中发现,人参皂苷Re治疗后血流动力学各指标与模型组同时段相比,均有显著性下降,人参皂苷Re能够使ISO所致的家兔室性心律失常转为窦性心律,且人参皂苷Re的剂量越大,维持窦性节律的时间越长。该研究认为,人参皂苷Re可能通过多个靶点共同作用,而且各机制之间相互促进、相互关联:①人参皂苷Re是钙离子拮抗剂,Ca2+内流增多会引发心律失常;②人参皂苷Re对KATP通道的开放具有调节作用;③人参皂苷Re具有清除氧自由基、增加一氧化氮的产生以及膜稳定剂等作用。另有研究发现,人参皂苷Re能够抑制心室肌细胞电压依赖性的钠通道、瞬时外向钾通道、内向整流钾通道电流和L型钙通道电流,从而发挥抗心律失常的作用[22-23]。以上对人参皂苷Re抑制心律失常的机制研究主要集中在离子通道方面,对其信号转导通路的研究甚少,cAMP/PKA信号通路和炎性反应在人参皂苷Re调节心律失常的研究中未见具体报道。本研究采用多电极阵列映射系统和FRET技术,实时观察人参皂苷Re对ISO诱导离体灌流大鼠快速型心律失常的影响并探讨其作用机制。以往研究认为人参皂苷Re抑制心律失常可能是通过多个离子通道共同作用,本研究发现人参皂苷Re抑制心律失常具有多靶点作用,人参皂苷Re通过调节cAMP/PKA通路和抑制炎性反应干预快速型心律失常的发生。
ISO是非选择性β1、β2受体激动剂,若β受体过度激活,可通过上调GPCR激活下游AC/cAMP/PKA通路,PKA生成过多,最终导致细胞质内Ca2+浓度瞬间升高。当胞内游离钙瞬间增多,可直接延长复极,最终导致快速型心律失常的发生[24]。本研究通过多电极阵列映射系统观察离体Langendorff灌流心脏发现,人参皂苷Re抑制ISO所致大鼠心室肌传导速度、传导方向及心率的改变,抑制ISO诱导乳鼠心肌细胞内cAMP和PKA含量的增加。表明人参皂苷Re通过阻断ISO与心肌细胞膜上的GPCR的结合,抑制其下游cAMP/PKA信号传导通路缓解心律失常(图9)。
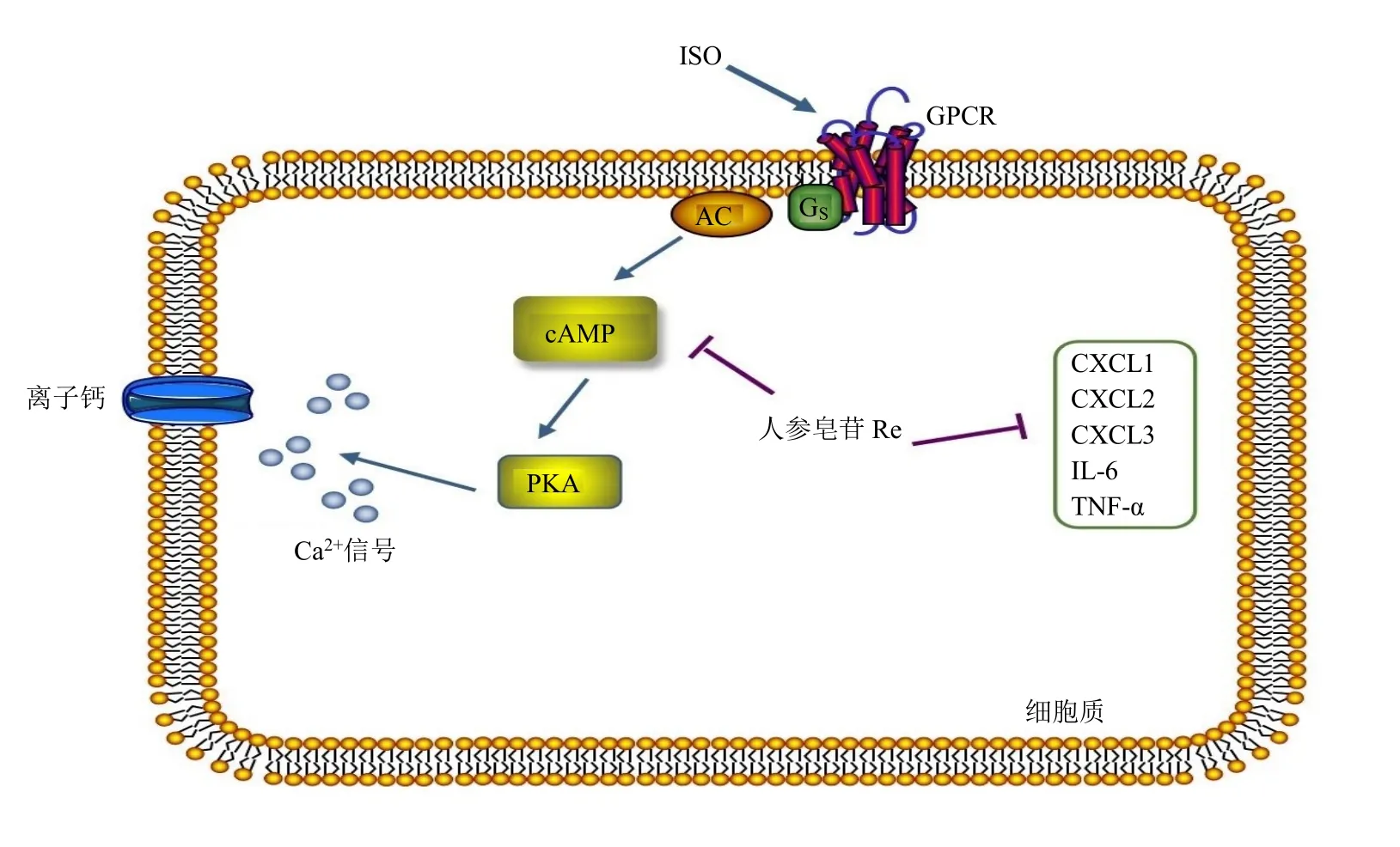
图9 人参皂苷Re通过抑制cAMP/PKA信号通路及炎性因子表达干预快速型心律失常Fig.9 Ginsenoside Re interferes with tachyarrhythmia by inhibiting cAMP/PKA signaling pathway and expressions of inflammatory factors
炎性反应与室性心律失常密切相关[25],炎性反应可以导致心肌传导的不均一性,促进心室重构和室性心律失常的发生[18]。心律失常患者血清中炎性因子TNF-α和IL-6水平显著增高,经人参配伍方剂参麦注射液治疗后炎性因子水平明显降低[26],炎症因子表达较高的患者发生室性心律失常的风险也更高[27-28]。在缺血性心力衰竭的模型中,丝裂原激活的蛋白激酶(mitogen-activated protein kinase,MAPK)的激活可以诱导CXCL1、TNF-α和IL-6的产生,促进细胞凋亡、纤维化,最终导致心室重构和室性心律失常的发生[29-30]。在心肌纤维化的研究中发现,CXCL2和CXCL3表达均明显上调[31]。cAMP/PKA及其下游cAMP反应元件(cAMP responsive element binding protein,CREB)的激活是CXCL1基因转录的主要途径,而IL-1β也可通过CREB途径诱导趋化因子的基因表达[32]。由此可以推断,cAMP/PKA通路可能参与调节炎性因子的表达,进而引起心肌损伤和心肌纤维化,最终导致心律失常。本研究结果显示,人参皂苷Re可以通过抑制心脏组织中的CXCL1、CXCL2、CXCL3、TNF-α和IL-6水平,发挥抗心律失常作用(图9)。
综上,人参皂苷Re通过阻断ISO与心肌细胞膜上的GPCR结合,抑制其下游cAMP/PKA信号传导通路和炎性因子水平缓解心律失常。本研究仅在离体组织和心肌细胞水平对人参皂苷Re的抗心律失常进行分析,体内实验正进一步展开,炎性因子抗心律失常的具体机制有待深入探讨。本研究旨在为开发高效低毒的抗快速型心律失常药物提供科学依据和物质基础。
利益冲突所有作者均声明不存在利益冲突

