毛冬青三萜皂苷对动脉粥样硬化大鼠肠道菌群的影响
白荣钰,易 欢,陈丰连,邱静文,王 莹,陈冰莹,李 瑜,张 蕾*
1.广州中医药大学中药学院,广东 广州 510006
2.广州中医药大学护理学院,广东 广州 510006
动脉粥样硬化(atherosclerosis,AS)是一种慢性炎性疾病,是冠心病、脑卒中等心脑血管疾病发生发展的病理基础,其发病机制复杂,涉及内皮细胞损伤、脂质沉积、炎性细胞的聚集浸润、炎性因子的释放、血小板的聚集活化、血管平滑肌增殖与迁移等多种病理过程[1]。AS与人体衰老过程密切相关,其相关疾病的死亡率位居我国首位。研究表明,肠道微生物结构和功能的异常可通过三甲胺/三甲胺N-氧化物、初级和次级胆汁酸、短链脂肪酸、细菌内毒素易位等多种途径促进AS、高血压、心衰、心肌缺血等心血管疾病的发生和发展[2]。Eelke等[3]将Casp1-/-小鼠的促炎性肠道菌群移植至Ldlr-/-小鼠,发现促炎性肠道菌群会增强小鼠全身性炎性反应并加速AS的形成。在中医“心与小肠相表里”的理论指导下,越来越多的研究表明在中医药治疗心血管疾病的作用机制中,中药与肠道微生态相互作用的过程是关键的环节[4]。
毛冬青是冬青科冬青属植物毛冬青Ilex pubescensHook.et Am.的干燥根,主产于广东、广西、湖南等地,具有消肿止痛、活血通脉、清热解毒等功效[5-6],已被开发成针剂、片剂、胶囊剂等,临床上广泛用于治疗冠状动脉粥样硬化性心脏病、脑血栓、血栓性脉管炎、中心视网膜炎等疾病[5]。毛冬青主要活性成分为三萜皂苷类成分[7-8]。毛冬青三萜皂苷(IPTS)的口服生物利用度低,本课题组前期研究表明,IPTS主要分布于胃肠道和胸主动脉,仅有少量分布于心脏、肝脏和肾脏,脑中几乎检测不到[9]。其较低的生物利用率难以直接解释其对AS等心血管疾病的治疗作用,本研究拟探究IPTS对AS大鼠肠道菌群的调节作用及其机制,为IPTS治疗AS提供科学依据。
1 材料
1.1 动物
SPF级雄性SD大鼠,体质量(180±20)g,6~7周龄,购自广州中医药大学实验动物中心,动物合格证号SCXK(粤)2013-0034。动物于广州中医药大学实验动物中心SPF级动物房适应性喂养1周,温度(24±2)℃、12 h光昼交替,自由进食饮水。动物实验经广州中医药大学实验动物伦理审查委员会批准(批准号ZYD-2020-065)。
1.2 药材
毛冬青购自广州致信药业股份有限公司,经广州中医药大学张丹雁教授鉴定为冬青科冬青属植物毛冬青I.pubescensHook.et Am.的干燥根。
1.3 药品与试剂
毛冬青皂苷B1对照品(质量分数>98%)购自维克奇生物科技有限公司;高脂饲料(由3%胆固醇、0.5%胆酸钠、0.2%丙基硫氧嘧啶、10%猪油、5%白糖、81.3%基础饲料组成)购自北京华阜康生物科技股份有限公司;羧甲基纤维素钠(CMC-Na)、甲醛溶液和水合氯醛购自广州苏铖粤贸易有限公司;辛伐他汀片(20 mg/片,批号T020243)购自上海信谊万象药业股份有限公司;维生素D3注射液(批号20190401)购自哈尔滨市道外区宏达动物药品厂;总胆固醇(total cholesterol,TC)试剂盒(批号20190924)、三酰甘油(triglycerides,TG)试剂盒(批号201909016)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)试剂盒(批号20190905)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)试剂盒(批号20190905)和一氧化氮(nitric oxide,NO)试剂盒(批号20190904)购自南京建成生物工程研究所;内皮素-1(endothelin-1,ET-1)ELISA试剂盒(批号I30013321)和血管紧张素-II(angiotensin-II,Ang-II)ELISA试剂盒(批号J22013320)购自武汉华美生物工程有限公司;琼脂糖购自广州浩玛生物科技有限公司;3422A 100bp DNA ladder购自日本Takara公司;引物由美国Thermo Fisher Scientific公司合成;无水乙醇均为分析纯,购自广州苏城粤有限公司;凝胶回收试剂盒购自美国Omega公司;粪便基因组DNA提取试剂盒购自天根生化科技(北京)有限公司。
1.4 仪器
多功能酶标仪(美国Promega公司);生化培养箱(上海和呈仪器制造有限公司);冷冻切片机(美国Thermo Fisher Scientific公司);恒温水浴箱(上海一恒科技有限公司);制冰机(郑州南北仪器设备有限公司);实验室纯水系统(上海和泰仪器有限公司);5417R型冷冻离心机(德国Eppendorf公司);涡旋混合器电泳仪(北京六一生物科技有限公司);凝胶成像仪(上海天能科技有限公司);PCR仪(美国Bio-Rad公司)。
2 方法
2.1 IPTS的制备
将毛冬青饮片打成粗粉,加入10倍量水浸泡24 h,定时搅拌,浸泡2次,滤过,弃去滤液。粗粉再按料液比1∶10加入85%~90%乙醇,加热回流提取2次,1 h/次,收集滤液,浓缩,干燥后得提取物粉末。粉末分散于5倍量10%~20%乙醇中,滤过,弃去滤液,沉淀经干燥后得IPTS。以毛冬青皂苷B1为对照品,采用比色法[10]测定总三萜皂苷的含量,标准曲线为Y=369.95X-0.052 9(R2=1),计算得三萜皂苷的质量分数为81.63%。
2.2 造模、分组与给药
SD大鼠随机分为对照组、模型组、辛伐他汀(5 mg/kg)组和IPTS低、中、高剂量(30、60、120 mg/kg,分别相当于临床剂量的0.5、1.0、2.0倍)组,每组10只。模型组、辛伐他汀组和IPTS低、中、高剂量组大鼠给予高脂饲料喂养8周,并于第3天ip维生素D3注射液(7×105U/kg);对照组大鼠给予正常饲料喂养,并于第3天ip等体积0.9%氯化钠溶液。IPTS溶于0.5% CMC-Na分别配制成质量浓度为30、60、120 mg/mL的溶液,超声20 min使其分散均匀;辛伐他汀片溶于0.5% CMC-Na配制成质量浓度为5 mg/mL的溶液。各给药组大鼠自造模第1天ig相应药物(10 mL/kg),对照组和模型组大鼠ig等体积0.5% CMC-Na溶液,1次/d,连续8周。
2.3 粪便样本采集
给药结束后,将大鼠置于代谢笼中,连续收集8 h的粪便样本,分装于2 mL冷冻离心管中,于-80 ℃保存。
2.4 IPTS对AS大鼠血清中TC、TG、LDL-C、HDL-C、NO、ET-1和Ang-II含量的影响
收集粪便后,大鼠禁食不禁水12 h,麻醉后腹主动脉取血。血液静置30 min,4 ℃、3800 r/min离心10 min,分离得到血清。按照试剂盒说明书测定血清中TC、TG、LDL-C、HDL-C、NO、ET-1和Ang-II含量。
2.5 IPTS对AS大鼠胸主动脉病理变化的影响
大鼠失血致死,解剖取胸主动脉,除去胸主动脉的脂肪组织,于冰浴上用0.9%氯化钠溶液冲洗组织,切取部分胸主动脉组织置于4%甲醛溶液中,用常规石蜡包埋,均匀切片,进行苏木素-伊红(HE)染色,于显微镜下观察并拍照。
2.6 粪便中细菌DNA的提取与测序
2.6.1 DNA的提取与检测 按照粪便基因组DNA提取试剂盒说明书提取总DNA,采用微量分光光度计测定样品DNA的浓度和纯度,采用1%琼脂糖凝胶电泳检测样品DNA完整性。
2.6.2 PCR扩增及产物检测 选用上游引物515F(5’-GTGYCAGCMGCCGCGGTAA-3’)和下游引物806R(5’-GGACTACNVGGGTWTCTAAT-3’)对大鼠粪便样本的16S rRNA V4区进行扩增。采用1%琼脂糖凝胶电泳检测PCR产物片段长度和浓度,主带长度在290~310 bp的样品可用于进一步的实验;利用GeneTools软件(Version 4.03.05.0)对PCR产物进行浓度对比,再计算每个样品所需的体积,将每个PCR产物进行混合。使用凝胶回收试剂盒回收PCR产物,用TE缓冲液洗脱回收目标DNA片段。
2.6.3 16S rRNA 基因测序 使用 Illumina Hiseq2500平台对样本进行16S扩增子测序,采用paired-end双端测序方式对产物的V4区域进行高通量测序,测序过程在广东美格基因科技有限公司进行。
2.6.4 测序数据分析 利用USEARCH软件对样本的Clean Tags 进行分类学单元操作(operational taxonomic unit,OTU)聚类,借助QIIME平台对OTU数据进行β多样性分析、Lefse分析和PICRUSt功能预测。β多样性分析主要是针对组间差异性进行分析,可以判断相同条件下样本组成的相似程度,样本之间的距离表示样本的组成相似程度,样本点越接近说明样品的相似程度越高。LEfse分析可以对多个组别之间进行比较,从而找到各组在丰度上有显著差异的物种。通过PICRUSt功能预测来推测样本中的菌群基因功能的构成,从而分析不同组别之间在功能上的差异。
2.7 统计学方法
采用SPSS 19.0进行数据统计分析,计量资料满足正态分布以±s表示,计量资料不满足正态分布用M(P25,P75)描述;多组资料进行单因素方差分析检验,如方差齐采用LSD检验,如方差不齐采用DunnettT3检验;不符合正态分布的计量资料比较采用非参数Mann-Whitney U检验。
3 结果
3.1 IPTS对AS大鼠血清中TC、TG、LDL-C、HDL-C、NO、ET-1和Ang-II含量的影响
如表1所示,与对照组比较,模型组大鼠血清中TC、TG和LDL-C水平明显升高(P<0.01),HDL-C水平明显降低(P<0.05);与模型组比较,辛伐他汀组和IPTS高剂量组大鼠血清中TC水平显著降低(P<0.05、0.01),HDL-C水平明显升高(P<0.05);辛伐他汀组大鼠血清中LDL-C水平显著降低(P<0.05)。

表1 IPTS对AS大鼠血清中TC、TG、LDL-C和HDL-C含量的影响 (n = 10)Table 1 Effect of IPTS on contents of TC, TG, LDL-C and HDL-C in serum of AS rats (n = 10)
如表2所示,与对照组比较,模型组大鼠血清中NO水平显著降低(P<0.01),ET-1和Ang-II水平显著增高(P<0.05、0.01),NO/ET-1显著降低(P<0.01);与模型组比较,IPTS各剂量组大鼠血清中NO水平显著升高(P<0.05、0.01),ET-1和Ang-II水平显著降低(P<0.05、0.01);IPTS各剂量组和辛伐他汀组大鼠血清中NO/ET-1显著升高(P<0.05、0.01)。

表2 IPTS对AS大鼠血清中NO、ET-1和Ang-II含量的影响 (n = 10)Table 2 Effect of IPTS on contents of NO, ET-1 and Ang-Ⅱ in serum of AS rats (n = 10)
3.2 IPTS对AS大鼠胸主动脉病理变化的影响
如图1所示,对照组大鼠胸主动脉壁未见增厚,未见粥样硬化斑块形成,血管内皮光滑,未见损伤脱落;模型组大鼠胸主动脉管壁中有明显的蓝色钙化斑块形成,可见胆固醇结晶,血管内皮损伤脱落,有坏死的组织沉积;辛伐他汀组大鼠胸主动脉管壁有些增厚,无明显斑块,血管内皮粗糙,有些损伤脱落;IPTS中、高剂量组大鼠大部分动脉壁未见增厚,血管内皮大致正常,较平滑,未见明显损伤脱落;IPTS低剂量组大鼠胸主动脉壁有些增厚,但无明显斑块,血管内皮较粗糙。
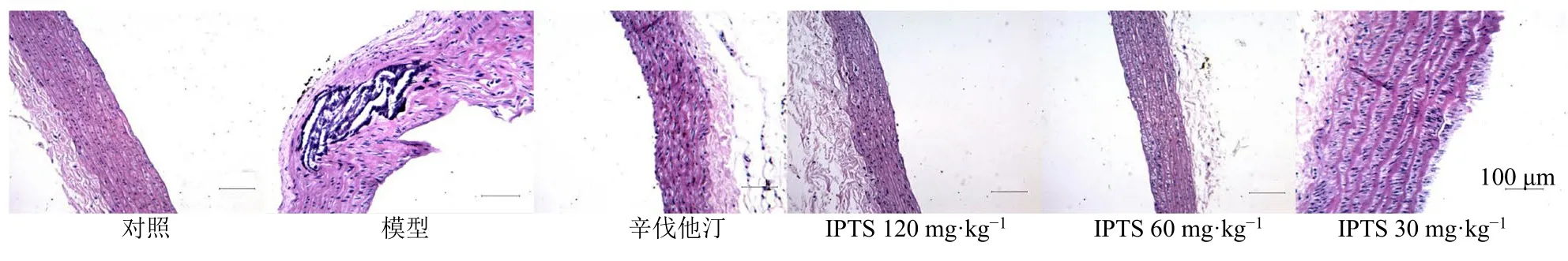
图1 IPTS对AS大鼠胸主动脉病理变化的影响 (HE, ×100)Fig.1 Effect of IPTS on pathological changes of thoracic aorta in AS rats (HE, × 100)
3.3 大鼠肠道菌群多样性分析
β多样性分析中样品的空间距离越接近,样品的物种组成结构越相似。如图2所示,模型组与对照组肠道菌群组成有很大差异;IPTS中、高剂量组肠道菌群组成彼此间接近,与模型组有较大差异,表明IPTS可以调节大鼠肠道菌群的组成。

图2 各组粪便样本β多样性PCoA分析Fig.2 PCoA analysis of β diversity in feces samples of each group
3.4 肠道菌群物种归属与差异分析
将OTU表格中的信息按照门水平提取序列信息,并计算各物种的相对丰度,同时选取相对丰度在1%以上的物种绘制物种相对丰度分布图(图3)。从门水平上看,4组之间的优势菌群主要为厚壁菌门、拟杆菌门、变形菌门和疣微菌门。与对照组相比,模型组大鼠肠道菌群中拟杆菌门相对丰度降低,变形菌门相对丰度增加,厚壁菌门相对丰度差异不大;与模型组相比,IPTS中、高剂量组大鼠肠道菌群中拟杆菌门相对丰度增加,厚壁菌门、变形菌门相对丰度降低,肠道菌群结构得到改善。

图3 IPTS对AS大鼠肠道菌群的影响Fig.3 Effect of IPTS on intestinal flora of AS rats
3.5 LEfSe分析
LEfSe分析可以用于微生物菌群标记物的筛选。对对照组、模型组以及IPTS中、高剂量组进行LEFSe分析,进一步筛选差异菌属,对差异菌属(LDA≥2)进行Mann-Whitney U检验,并采用Graphpad Prism 7软件对各组在门、科、属水平上的菌属相对丰度差异进行可视化。
3.5.1 门水平肠道菌群相对丰度变化 如图4所示,与对照组比较,模型组大鼠肠道菌群中脱铁杆菌门、疣微菌门、螺旋体门和变形杆菌门相对丰度明显增高(P<0.05、0.01),拟杆菌门相对丰度明显减少(P<0.01);与模型组比较,IPTS中剂量组大鼠肠道菌群中疣微菌门、变形杆菌门和拟杆菌门相对丰度明显降低(P<0.05、0.01),厚壁菌门相对丰度明显升高(P<0.05);IPTS高剂量组大鼠肠道菌群中疣微菌门相对丰度明显降低(P<0.01),变形杆菌门相对丰度显著升高(P<0.05)。
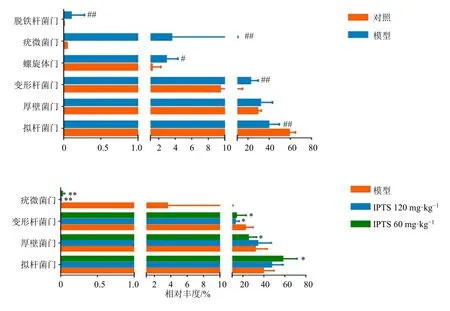
图4 门水平各组肠道菌群相对丰度Fig.4 Relative abundance of intestinal flora in each group at phylum level
3.5.2 科水平肠道菌群相对丰度变化 如图5所示,与对照组比较,模型组大鼠肠道菌群中Christensenellaceae、Odoribacteraceae、肠杆菌科、紫单胞菌科、螺旋体科、疣微菌科、瘤胃菌科、脱疏弧菌科、毛螺菌科相对丰度明显增高(P<0.05、0.01),乳杆菌科、S24-7和普雷沃氏菌科相对丰度明显降低(P<0.01)。与模型组比较,IPTS中剂量组大鼠肠道菌群中Marinilabiaceae、脱疏杆菌科、疣微菌科、毛螺菌科相对丰度显著降低(P<0.05、0.01),鞘氨醇杆菌科相对丰度显著升高(P<0.05);IPTS高剂量组大鼠肠道菌群中Marinilabiaceae、脱疏杆菌科、产碱杆菌科、疣微菌科、毛螺菌科相对丰度显著降低(P<0.05、0.01),鞘氨醇杆菌科和气球菌科相对丰度显著升高(P<0.05、0.01)。
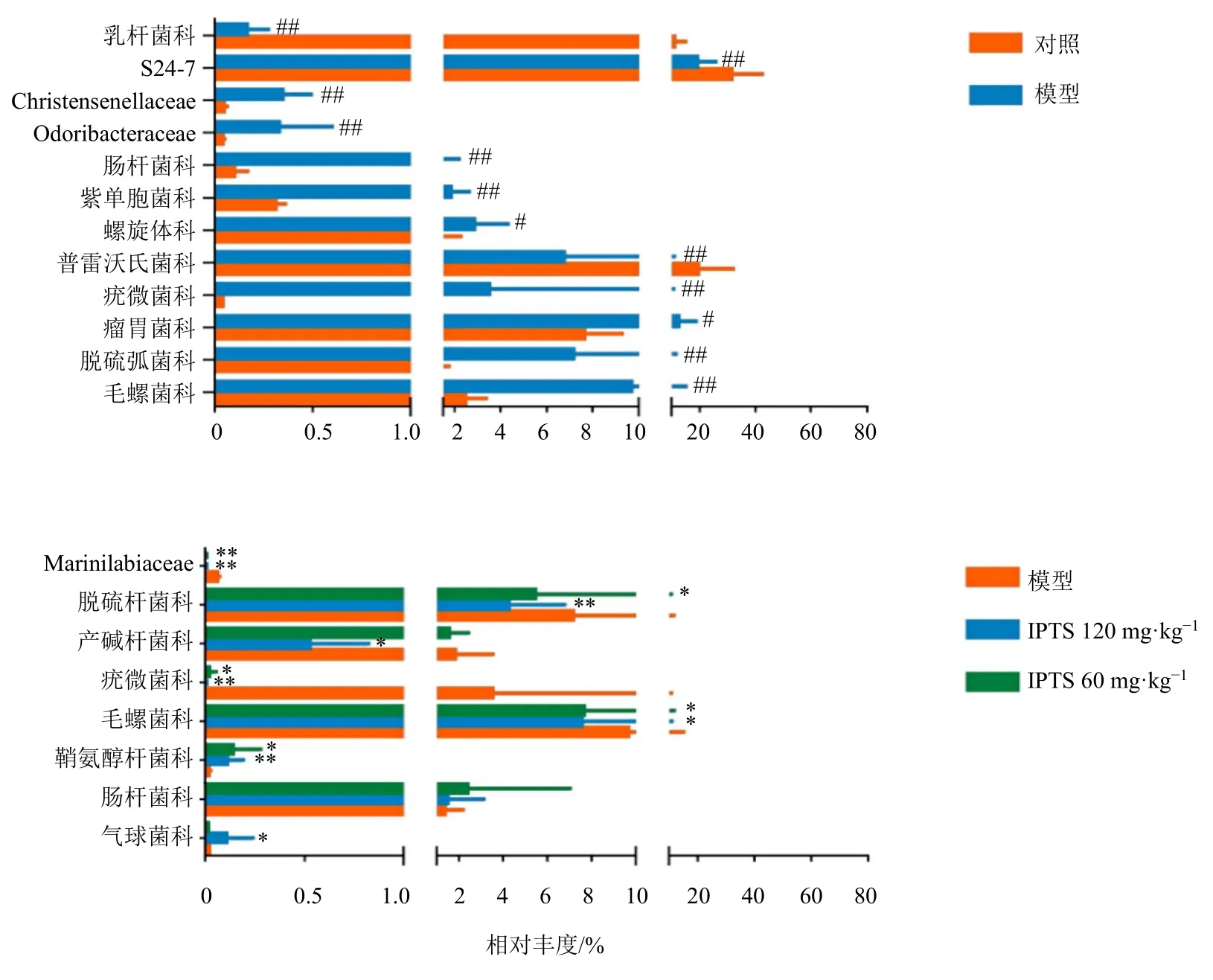
图5 科水平各组肠道菌群相对丰度Fig.5 Relative abundance of intestinal flora in each group at family level
3.5.3 属水平肠道菌群相对丰度变化 如图6所示,与对照组比较,模型组大鼠肠道菌群中乳酸杆菌属Lactobacillus和普雷沃氏菌属Prevotella相对丰度显著降低(P<0.05、0.01),密螺旋体属Treponema、拟杆菌属Bacteroides、Parabacteroides、Akkermansia、颤螺菌属Oscillospira、毛螺菌属Lachnospira、粪球菌属Coprococcus、罗氏菌属Roseburia、大肠杆菌属Escherichia相对丰度显著升高(P<0.05、0.01)。与模型组比较,IPTS中剂量组大鼠肠道菌群中埃希菌属、罗氏菌属、毛螺菌属、脱硫叶菌属Desulfobulbus、脱硫弧菌属Desulfovibrio、Akkermansia相对丰度显著降低(P<0.05、0.01),乳酸杆菌属、布劳特氏菌属Blautia相对丰度显著升高(P<0.05);IPTS高剂量组大鼠肠道菌群中毛螺菌属、脱硫叶菌属、脱硫弧菌属、萨特氏菌属Sutterella、Akkermansia相对丰度显著降低(P<0.05、0.01),布劳特氏菌属相对丰度显著升高(P<0.05)。

图6 属水平各组肠道菌群相对丰度Fig.6 Relative abundance of intestinal flora in each group at genus level
3.6 PICRUSt肠道菌群功能预测分析
通过STAMP软件的PICRUSt分析各组大鼠肠道菌群的基因功能。部分预测代谢途径结果见图7,发生显著变化的功能主要是细菌运动蛋白、细菌趋化性以及酶水平变化中的药物代谢酶,发生显著变化的代谢通路是核苷酸代谢中的嘧啶代谢和嘌呤代谢、脂质代谢中的甘油磷脂代谢、氨基酸代谢中的丙氨酸、天冬氨酸和谷氨酸代谢以及缬氨酸、亮氨酸和异亮氨酸生物合成、赖氨酸降解。
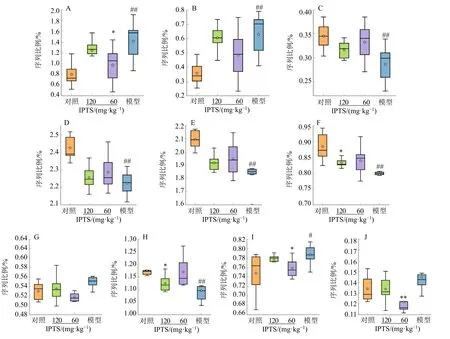
图7 肠道菌群功能预测结果Fig.7 Result of intestinal flora function prediction
PICRUSt功能预测结果表明,模型组大鼠肠道菌群中的细菌运动蛋白、细菌趋化性指标显著升高(P<0.01),表明AS大鼠肠道菌群中的微生物过度繁殖,而IPTS可显著减少细菌运动蛋白(P<0.05),减少病原菌的侵入;模型组肠道菌群中药物代谢相关酶、嘌呤代谢、嘧啶代谢水平显著低于对照组(P<0.01),表明AS大鼠的核酸代谢受到抑制,经IPTS干预后核酸代谢得到改善。
甘油磷脂由甘油、胆碱、丝氨酸等生成,甘油磷脂代谢属于脂质代谢,其代谢水平上升会导致脂质在血管内沉积,易引发AS等心血管疾病。模型组肠道菌群中的肽聚糖生物合成水平显著下调(P<0.01),甘油磷脂代谢水平上升;经IPTS干预后,甘油磷脂代谢和肽聚糖生物合成得到改善。与对照组相比,模型组肠道菌群中的丙氨酸、天冬氨酸和谷氨酸代谢水平显著下降(P<0.01),缬氨酸、亮氨酸和异亮氨酸生物合成水平显著上升(P<0.05),赖氨酸降解水平上升;经IPTS干预后,上述氨基酸代谢紊乱得到改善。
4 讨论
本研究采用高脂饲养联合ip维生素D3方法建立AS大鼠模型,对大鼠血脂、血管内皮因子(NO、ET-1和Ang-II)和胸主动脉病理变化进行考察,结果显示IPTS能够改善AS大鼠的血管内皮损伤,减少AS斑块,且有一定的调脂作用。采用16S rRNA高通量测序方法分析IPTS对肠道微生物的作用,菌群差异分析和功能分析结果表明IPTS可以改变肠道微生态结构组成,下调致病菌的相对丰度,抑制病原菌入侵以及改善部分肠道菌群基因功能,从而发挥治疗AS的作用。
Emoto等[11]发现AS患者肠道菌群中厚壁菌门/拟杆菌门相对丰度增加,拟杆菌门数量减少。另有文献报道厚壁菌门/拟杆菌门相对丰度与血脂变化相关[12]。IPTS组大鼠肠道菌群中拟杆菌门相对丰度降低,厚壁菌门相对丰度升高,表明IPTS可以改善AS大鼠的肠道菌群的结构失衡,调节肠道菌群的组成,从而发挥抗AS的作用。IPTS组大鼠肠道菌群中毛螺菌科相对丰度降低,Koren等[13]发现肠道中毛螺菌科相对丰度与LDL-C、TC水平呈正相关,LDL-C和TC升高会加剧AS,表明IPTS可能通过下调肠道菌群中的毛螺菌科相对丰度调节AS大鼠血脂水平。
肠道菌群中的双歧杆菌、乳酸杆菌可以促进胆固醇排泄,提高机体的抗氧化能力[14-15],口服益生菌可以预防小鼠AS的发展。王玲等[16]研究表明冠心病患者肠道中的大肠杆菌数量明显增加,AS与致病菌数量上调有关。经IPTS干预后,埃希菌属相对丰度降低,推测IPTS可能通过下调致病菌来改善AS。虽然与对照组相比,模型组布劳特氏菌属相对丰度没有显著变化,但经IPTS干预后,布劳特氏菌属相对丰度增加。Ozato等[17]发现布劳特氏菌属与女性的内脏脂肪面积呈负相关,且与性别无关,表明IPTS抗AS作用可能与上调布劳特氏菌属有关。
利益冲突所有作者均声明不存在利益冲突

