秦皮素通过下调p70S6K抑制人黑色素瘤细胞增殖、迁移和侵袭研究
兰 楠,吕志阳,周雨晴,韩延南,王明心,彭忠禄*,樊竑冶*
1.中国药科大学生命科学与技术学院,江苏 南京 210009
2.湘南学院药学院,湖南 郴州 423099
黑色素瘤是一种侵袭性强、致死率高的恶性皮肤癌。转移是造成黑色素瘤致死率高的主要原因之一[1]。黑色素瘤对传统治疗手段易产生耐药性且预后差,其发病率和死亡率逐年升高[2]。虽然近年来靶向治疗和免疫疗法取得了一些进展,但其疗效有限[3-4],因此亟待开发新的药物和方法治疗黑色素瘤。
哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)是细胞生长和代谢的主要调节因子,可感知和整合多种营养和环境因素来平衡营养供应并调控细胞生长。mTORC1蛋白复合物由mTOR和其他组分组成,具有促进合成代谢的作用,而核糖体蛋白S6的磷酸化常被用来指示mTORC1的活性[5]。mTOR信号转导异常见于多种癌症,并与癌症的耐药性、转移、侵袭及预后等密切相关,S6的过度磷酸化与恶性黑色素瘤显著相关[6]。此外,mTORC1通过激活核糖体S6蛋白激酶(ribosome S6 protein kinase,P70S6K)诱导黑色素瘤发生上皮-间充质转化(epithelial-mesenchymal transition,EMT)[7]。尽管雷帕霉素已用于治疗胰腺癌,但雷帕霉素、依维莫司和替西罗莫司(mTORC1抑制剂)等在临床试验中缺乏对黑色素瘤的客观反映[8]。
秦皮素是从中药秦皮中提取出的一种天然香豆素类化合物,具有抗菌、抗氧化、神经保护和肿瘤抑制等多种药理学活性,具有良好的药物研究和临床应用价值[9]。秦皮素对乳腺癌、非小细胞肺癌、结肠腺癌等肿瘤细胞的增殖、迁移具有明显的抑制或促凋亡作用[10-12],但其对黑色素瘤细胞的作用鲜有报道。本研究探讨了秦皮素对人黑色素瘤A375细胞增殖、迁移和侵袭的影响及作用机制,为秦皮素治疗黑色素瘤的临床应用提供理论支持与参考。
1 材料
1.1 细胞
A375细胞购自中国科学院上海细胞库。
1.2 药品与试剂
秦皮素(质量分数>98%,批号B20990)购自上海源叶生物公司;p70S6K特异性抑制剂PF-4708671(质量分数>99%,批号HY-15773)购自美国MedChemExpresss公司;DMEM培养基(批号8121025)、胎牛血清(批号2232246)购自美国Gibco公司;Matrigel基质胶(批号9168007)、Transwell小室(批号07920027)购自美国Corning公司;p-mTOR抗体(批号11221)购自美国Signalway Antibody公司;p70S6K抗体(批号2708)、p-p70S6K抗体(批号9234)、S6抗体(批号2217)、p-S6抗体(批号2211)购自美国CST公司;基质金属蛋白酶2(matrix metalloproteinase-2,MMP2)抗体(批号AB92536)购自英国Abcam公司;MMP9抗体(批号00673298)、vimentin抗体(批号6619511)购自美国Affinity Biosciences公司;N-cadherin抗体(批号00059228)、HPR标记的羊抗兔IgG抗体(批号SA00001-4)购自美国Proteintech Group公司;β-actin抗体(批号AB0035)购自上海Abways Technology公司。
1.3 仪器
311型气套CO2培养箱、MSC Advantage 1.5生物安全柜(美国Thermo Fisher Scientific公司);ECLIPSE Ts2倒置显微镜(日本Nikon公司);Mini-Protein Tetra垂直电泳槽、湿式转印槽(美国Bio-Rad公司);5200 Multi化学发光凝胶成像仪(上海天能科技有限公司)。
2 方法
2.1 细胞培养
A375细胞用含10%胎牛血清、100 μg/mL青霉素、100 μg/mL链霉素的DMEM培养基,于37 ℃、95%相对湿度、5% CO2恒温培养箱中培养。
2.2 细胞计数法检测细胞增殖
取处于对数生长期的A375细胞,以2.5×105/mL接种至96孔板中,200 μL/孔,培养过夜,待细胞贴壁后加入药物,使秦皮素终浓度为25、50、100、200 μmol/L,对照组加入含有等体积药物溶媒的培养基。每个浓度设置3个复孔,继续培养48 h后,弃去培养基,胰酶消化后用血球计数板对每孔细胞密度进行计数,计算每孔细胞数量。
2.3 细胞克隆形成实验
取处于对数生长期的A375细胞,以500/孔接种于6孔板中,培养48 h后加入药物,使秦皮素终浓度为40、60、80 μmol/L,对照组加入含有等体积药物溶媒的培养基。每3天更换培养基和药物,当培养皿中出现肉眼可见的克隆斑时(约14 d)停止培养;弃去培养液,用PBS溶液洗涤2次后加入1.5 mL 4%多聚甲醛固定30 min,再用0.1%结晶紫染液染色20 min后流水清洗,待其自然风干后,拍照记录。
2.4 Western blotting实验
收集对照组及不同浓度秦皮素或PF-4708671(10 μmol/L)处理48 h后的A375细胞,加入含PMSF的RIPA裂解液提取蛋白,经BCA蛋白定量试剂盒测定蛋白浓度后,加入上样缓冲液煮沸变性10 min。蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF膜,加入封闭液封闭1 h,分别加入对应的抗体于4 ℃孵育过夜,TBST洗涤3次,10 min/次,再加入HPR标记的羊抗兔IgG抗体(1∶10 000)于室温孵育2 h,TBST洗涤3次,滴加ECL化学发光液,采用凝胶成像仪显影。
2.5 细胞划痕实验
A375细胞接种于6孔板,待细胞长满时,用灭菌的200 μL枪头垂直于皿底划线,每孔划3道划痕,PBS清洗3次,加入含1%胎牛血清的DMEM培养基,加入药物使秦皮素终浓度为40、60、80 μmol/L,PF-4708671终浓度为10 μmol/L,对照组加入含有等体积药物溶媒的培养基,继续培养48 h,于显微镜下拍照,使用Image J软件分析0 h和48 h所拍照片的划痕面积,计算划痕愈合率。
划痕愈合率=(0 h划痕面积-48 h划痕面积)/0 h划痕面积
2.6 细胞侵袭实验
用预冷的DMEM培养基稀释Matrigel基质胶至230 μg/mL,吸取100 μL Matrigel基质胶铺入Transwell上室,于培养箱放置4 h。取处于对数生长期的A375细胞,调整密度为1×106/mL,加入药物使秦皮素终浓度为80 μmol/L、PF-4708671终浓度为10 μmol/L,对照组加入含有等体积药物溶媒的培养基。吸取100 μL上述无血清细胞悬液于Transwell上室,下室加入600 μL含20%胎牛血清的培养基,培养18 h。Transwell小室经4%多聚甲醛固定30 min后,用0.1%结晶紫染液染色20 min,用湿润的棉签擦除Transwell膜上层的细胞,自然风干后,于显微镜下观察并拍照。
2.7 统计学方法
采用GraghPad Prism 8.0软件对数据进行分析,数据以±s表示,组间比较采用单因素方差分析,组间两两比较采用t检验分析。
3 结果
3.1 秦皮素对A375细胞增殖和克隆形成的影响
如图1-A所示,不同浓度秦皮素(25、50、100、200 μmol/L)处理A375细胞48 h后,与对照组比较,秦皮素显著抑制A375细胞的增殖(P<0.05、0.01),且呈剂量相关性。经计算,秦皮素作用于A375细胞48 h的半数抑制浓度(half maximal inhibitory concentration,IC50)为98.03 μmol/L,因此选用40、60、80 μmol/L的秦皮素进行后续实验。细胞克隆形成实验结果见图1-B,与对照组比较,秦皮素显著抑制A375细胞克隆形成率(P<0.01),且呈剂量相关性。表明秦皮素能够抑制A375细胞的增殖和克隆形成能力。

图1 秦皮素对A375细胞增殖 (A) 和克隆形成 (B) 的影响 (±s, n = 3)Fig.1 Effect of fraxetin on proliferation (A) and clonality (B) of A375 cells (±s, n = 3)
3.2 秦皮素对A375细胞p70S6K/S6信号通路相关蛋白表达的影响
mTORC1/p70S6K/S6信号通路影响细胞的存活、增殖,且该通路在黑色素瘤中异常活化。如图2所示,秦皮素(40、60、80 μmol/L)处理A375细胞48 h后,对mTOR蛋白的磷酸化水平无影响,但显著下调p70S6K及S6蛋白的磷酸化水平(P<0.01),提示秦皮素可能通过抑制p70S6K/S6信号通路来抑制A375细胞的增殖和克隆形成能力。
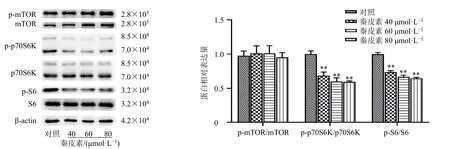
图2 秦皮素对A375细胞p70S6K/S6信号通路相关蛋白表达的影响 (±s, n = 3)Fig.2 Effect of fraxetin on p70S6K/S6 signaling pathway related proteins expressions in A375 cells (±s, n = 3)
3.3 PF-4708671对秦皮素抑制A375细胞增殖和p70S6K/S6信号通路相关蛋白表达的影响
为探究秦皮素是否通过p70S6K/S6信号通路影响A375细胞增殖,给予秦皮素(80 μmol/L)或p70S6K特异性抑制剂PF-4708671(10 μmol/L)处理细胞48 h,细胞计数结果见图3-A,PF-4708671和秦皮素均可显著抑制A375细胞增殖(P<0.01)。如图3-B所示,PF-4708671显著上调p70S6K蛋白磷酸化水平(P<0.01),同时下调S6蛋白磷酸化水平(P<0.01),与文献报道一致[13]。提示秦皮素可能通过下调p70S6K/S6抑制A375细胞增殖。

图3 PF-4708671对秦皮素抑制A375细胞增殖 (A) 和p70S6K/S6信号通路相关蛋白表达 (B) 的影响 (±s, n = 3)Fig.3 Effect of PF-4708671 on inhibition of fraxetin on proliferation (A) and p70S6K/S6 signaling pathway related proteins expressions (B) in A375 cells (±s, n = 3)
3.4 秦皮素对A375细胞EMT相关蛋白表达的影响
mTORC1/p70S6K/S6信号通路与EMT相关,如图4所示,秦皮素(40、60、80 μmol/L)处理A375细胞48 h后,显著下调间质细胞标志物(N-cadherin、vimentin)以及MMP2、MMP9蛋白表达水平(P<0.05、0.01),提示秦皮素可能通过影响EMT相关蛋白表达抑制A375细胞的迁移和侵袭能力。

图4 秦皮素对A375细胞EMT相关蛋白表达的影响 (±s, n = 3)Fig.4 Effect of fraxetin on EMT-related proteins expressions in A375 cells (±s, n = 3)
3.5 PF-4708671对秦皮素抑制A375细胞EMT相关蛋白表达的影响
如图5所示,与对照组比较,秦皮素(80 μmol/L)和PF-4708671(10 μmol/L)处理A375细胞48 h后,均显著下调N-cadherin、vimentin、MMP2、MMP9蛋白表达水平(P<0.05、0.01),提示秦皮素可能通过p70S6K/S6信号通路影响A375细胞EMT相关蛋白表达。
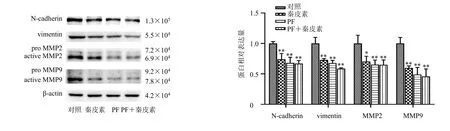
图5 PF-4708671对秦皮素抑制A375细胞EMT相关蛋白表达的影响 (±s, n = 3)Fig.5 Effect of PF-4708671 on inhibition of fraxetin on EMT-related proteins expressions in A375 cells (±s, n = 3)
3.6 秦皮素和PF-4708671对A375细胞迁移的影响
为探究秦皮素对A375细胞迁移能力的影响,同时避免秦皮素的细胞增殖抑制作用对实验结果的干扰,细胞划痕实验时培养基的血清浓度为1%。如图6所示,经秦皮素(40、60、80 μmol/L)和PF-4708671(10 μmol/L)处理后,A375细胞划痕愈合率显著降低(P<0.01),提示秦皮素可能通过p70S6K/S6信号通路抑制A375细胞迁移。

图6 秦皮素和PF-4708671对A375细胞迁移的影响 (±s, n = 3)Fig.6 Effect of fraxetin and PF-4708671 on migration of A375 cells (±s, n = 3)
3.7 秦皮素和PF-4708671对A375细胞侵袭的影响
如图7所示,与对照组相比,经秦皮素(80 μmol/L)和PF-4708671(10 μmol/L)处理后,A375细胞转至Transwell下室的数量显著降低(P<0.01),且二者联用时转移至下室的细胞进一步减少(P<0.01),提示秦皮素可能通过p70S6K/S6信号通路抑制A375细胞的侵袭能力。
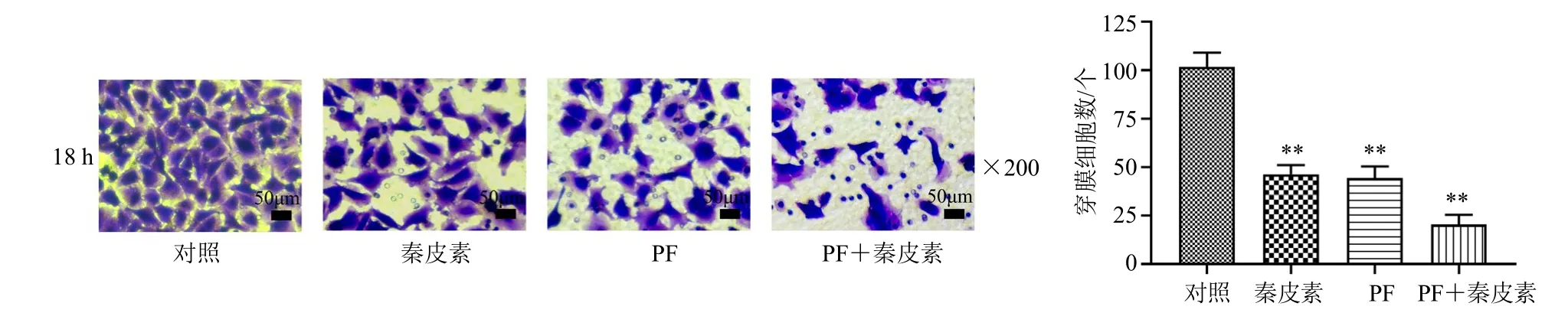
图7 秦皮素和PF-4708671对A375细胞侵袭的影响 (±s, n = 3)Fig.7 Effect of fraxetin and PF-4708671 on invasion of A375 cells (±s, n = 3)
4 讨论
黑色素瘤细胞具有增殖速度快、侵袭和转移潜能强、早期易转移等特点。本研究发现,秦皮素通过抑制p70S6K和S6的磷酸化水平,有效地抑制了人黑色素瘤A375细胞的增殖、迁移和侵袭,提示秦皮素有治疗黑色素瘤的潜质。
转移是导致黑色素瘤患者死亡的主要原因。黑色素瘤细胞在转移之前通常会经历EMT,表现为上皮细胞特性逐渐消失,并出现间质细胞特征,而发生EMT的肿瘤细胞更容易发生迁移和侵袭[14]。N-cadherin和vimentin是间质细胞标志蛋白,其蛋白表达水平的升高是细胞发生EMT的重要特征。N-cadherin是一种黏附分子,主要介导细胞与细胞间的动态黏附。N-cadherin表达上调可增强多种上皮癌细胞在体外的迁移和侵袭能力[15-17]。Vimentin是中间纤维蛋白最主要的组成成分,与微管、微丝共同构成细胞骨架,参与调控细胞黏附、细胞形状变化和迁移速度。研究表明,在EMT过程中,vimentin表达增加导致细胞黏附性减弱、细胞形态改变、细胞运动性增强[18]。MMP2和MMP9可促进基底膜以及胞外基质中明胶和胶原蛋白降解,增强细胞侵袭能力;在发生EMT的黑色素瘤细胞中,MMPs表达上调[19]。本研究发现,秦皮素抑制了A375细胞中N-cadherin、vimentin、MMP2和MMP9蛋白表达,提示秦皮素可能通过抑制A375细胞的EMT来抑制细胞的迁移和侵袭,从而阻止黑色素瘤细胞转移。
p70S6K是属于AGC激酶家族的一种丝氨酸/苏氨酸蛋白激酶,可以被不同的生长因子或胰岛素样因子通过磷脂酰肌醇3-激酶(phosphatidylinositol-3-kinase,PI3K)/mTOR通路磷酸化[20]。S6是核糖体40S亚基的重要蛋白质组成成分,是p70S6K激酶下游的重要靶蛋白。p70S6K/S6信号通路对肿瘤细胞的增殖、存活、细胞周期进展等有重要作用。抑制p70S6K可抑制乳腺癌细胞迁移[21];敲除p70S6K会抑制神经胶质瘤细胞增殖及裸鼠中肿瘤形成[22];敲除S6可以抑制上皮性卵巢癌细胞的增殖、迁移和侵袭[23]。本研究发现,秦皮素以p-mTOR非依赖性的方式下调了p70S6K和S6的磷酸化水平。为研究秦皮素对A375细胞的作用是否依赖于p70S6K激酶活性,使用p70S6K的特异性抑制剂PF-4708671进行对照实验,发现PF-4708671上调了p70S6K蛋白的磷酸化水平,下调了S6蛋白的磷酸化水平,与文献报道一致[13];PF-4708671抑制了A375细胞的增殖、迁移、侵袭,与秦皮素效果类似,表明秦皮素可能通过p70S6K/S6信号通路抑制A375细胞的增殖、迁移和侵袭。
p-mTOR上调表明mTORC1活性增加,mTORC1可以直接磷酸化下游蛋白p70S6K。本研究结果显示,秦皮素上调p-mTOR蛋白表达,下调p-p70S6K和p-S6蛋白表达。由于蛋白激酶B(protein kinase B,Akt)是mTOR的上游激酶,而p-S6能够负反馈抑制Akt活性[24],因此当秦皮素下调p-S6表达后,其对Akt的负反馈抑制作用解除,导致mTOR被活化即p-mTOR上调。推测秦皮素可能通过与mTOCR1或其调控因子结合而抑制mTOCR1活性,从而影响其对p70S6K的磷酸化;秦皮素在抑制mTORC1活性的同时累积了mTOR在S2448位点的磷酸化。秦皮素对mTORC1/p70S6K/S6信号通路的具体调控机制仍需进一步研究。
利益冲突所有作者均声明不存在利益冲突

