基于下丘脑-垂体-卵巢轴探讨藏药二十五味鬼臼丸对绝经后骨质疏松症大鼠的干预作用
李淑桢,王 琦,李沁园,申继强,李长兴,吴佩锋,张立雪,代冬芳*
1.青海大学医学院 基础医学研究中心,青海 西宁 810006
2.西北民族大学 医学部,甘肃 兰州 730000
绝经后骨质疏松症(postmenopausal osteoporosis,PMOP)是女性进入围绝经期后常见症状之一。随着人口老龄化加剧,女性绝经后骨质疏松症患者人数已高达2亿[1]。研究发现,雌激素减少是PMOP发生的主要原因,对因治疗是临床主要手段,但长期内源性雌激素治疗具有一定风险性,患者可能会并发乳腺癌、静脉血管栓塞、心血管疾病、子宫内膜癌等严重疾病[2]。为减少并发症,研究人员提出使用植物雌激素治疗方法。目前已有大量临床研究证实,植物雌激素具有防治PMOP的作用[3-5]。
藏药二十五味鬼臼丸作为青藏地区特色性药物,是当地用于治疗女性围绝经期综合征的首选药物之一,其主要组成为鬼臼,鬼臼中的木脂素属于植物雌激素[6]。已有临床试验证明,该药能够改善围绝经期女性出现的诸多症状[7-8]。然而二十五味鬼臼丸临床疗效机制的研究仍停留在临床经验的积累上,对其实验药效学和作用机制研究的报道极少,这远不能满足现代临床和市场的需要,因此,本实验通过建立PMOP动物模型观察二十五味鬼臼丸在下丘脑-垂体-卵巢轴(hypothalamus-pituitary-ovary axis,HPOA)上对PMOP的影响,为临床用药提供一定的理论依据。
1 材料
1.1 动物
SPF级雌性未孕SD大鼠40只,4月龄,体质量(220±20)g,由西安交通大学医学部实验动物中心所提供,动物许可证号:SCXK(陕)2018-001。饲养环境室温(22±1)℃,自由摄食、饮水,12 h昼夜自然规律。实验过程遵循青海大学医学院实验动物伦理委员会相关规定(批准文号QHDX2021000541)。
1.2 药物与试剂
戊酸雌二醇片(拜耳医药保健有限公司,国药准字J20171038,批号547A);藏药二十五味鬼臼丸(青海省藏医院,国药准字Z20140539,规格0.35 g×49丸/瓶,批号626189);TRIzol Reagent(美国Ambion公司,批号229001);PCR引物由日本TaKaRa公司合成;RNA提取试剂盒(北京全式金生物技术有限公司,批号AT311);荧光定量PCR试剂盒(北京全式金生物技术有限公司,批号AQ141);EDTA脱钙液(北京索莱宝科技有限公司,批号E1171);HE染色试剂盒(北京索莱宝科技有限公司,批号G1120);大鼠血清雌二醇、黄体生成素(luteinizing hormone,LH)、卵泡刺激素(follicle stimulating hormone,FSH)、促性腺激素释放激素(gonadotropin releasing hormone,GnRH)ELISA试剂盒(江苏酶标生物科技有限公司,批号分别为MB-2116A、MB-6623A、MB-2107A、MB-2062A)。大鼠ERα和ERβ多克隆抗体、β-actin(英国Abcam公司,批号ab3575、ab3576、ab8227);DAPI染色液(上海碧云天生物技术有限公司,批号C1006);Cy3标记羊抗兔IgG(北京博奥森生物工程有限公司,批号A0516)。
1.3 主要仪器
Centrifuge 5418R高速冷冻离心机(德国Eppendorf公司);Nanodrop 2000(美国Thermo公司);Light Cycler96实时荧光定量PCR仪(瑞士Roche公司);HistoCore Pearl全封闭组织脱水机(德国Leica公司);HistoCoreArcdia石蜡包埋机(德国Leica公司);SkyScan 1176小动物Micro-CT扫描仪(德国Bruker公司)。
2 方法
2.1 分组、造模及给药
适应性喂养1周后,将40只SD未孕雌性大鼠中随机分为假手术组、模型组、雌二醇组、二十五味鬼臼丸组。除假手术组仅摘除卵巢旁同等大小的脂肪组织,其余3组建立PMOP动物模型。术前禁食12 h不禁水,将大鼠固定在手术台后,每只大鼠ip 10%水合氯醛(3 mL/kg),深度麻醉后备皮,碘伏消毒,沿腹直肌中线做腹正中切口2~3 cm,暴露腹腔后将腹内容物推向一侧可见呈V字型的子宫,沿子宫角向上可见桑葚状卵巢。除假手术组外,其他各组大鼠均摘取双侧卵巢,建立PMOP动物模型。术后im青霉素(20万U/只)连续3 d预防感染。术后3 d对各组大鼠逐只进行阴道涂片,1次/d,连续5 d,若动物不出现动情期反应则表示造模成功。手术1周后开始ig给药处理,按照临床等效剂量计算,雌二醇组大鼠用药剂量为0.1 mg/kg,二十五味鬼臼丸组大鼠用药量为441 mg/kg,其余2组ig等体积蒸馏水,每日给药,持续12周。
2.2 标本制备
最后1次给药后,禁食12 h,大鼠深度麻醉,腹主动脉取血,分离出双侧股骨,冰上操作,剔除周围附着的肌肉和韧带等软组织后,用生理盐水反复冲洗,将左侧股骨置于冻存管中-80 ℃保存备用,右侧股骨置于4%多聚甲醛固定备用;大鼠断头处死后,冰上摘取下丘脑和垂体,生理盐水反复冲洗后,分别置于冻存管,-80 ℃保存备用。
2.3 ELISA检测各组大鼠血清性激素水平变化
EDTA抗凝管腹主动脉取血后,上下颠倒混匀,静置20 min左右,4 ℃,3000 r/min,离心20 min后收集上清液,按试剂盒要求检测雌二醇、LH、FSH、GnRH水平。
2.4 RT-PCR检测下丘脑、垂体和股骨的雌激素受体α(estrogen receptor α,ERα)、ERβ mRNA表达
各组分别取100 mg下丘脑、垂体和左侧股骨远端,加入Trizol提取组织总RNA,按试剂盒进行反转录和荧光定量。每组设3个平行复孔,以β-actin为内参基因,记录各组Ct值。运用2-ΔΔCt相对定量法计算各组目的基因相对表达量。引物序列见表1。

表1 引物序列及扩增产物长度Table 1 Primer sequences and amplification products length
2.5 免疫荧光双标检测下丘脑、垂体和股骨ERα及ERβ蛋白表达
将大鼠下丘脑、垂体、右侧股骨脱水包埋后,切成5 μm厚度的切片后,依次进行烤片、脱蜡、水化、抗原修复、封闭、一抗孵育(1∶200)、标记、染色、脱水、透明等步骤,封片后在荧光显微镜下观察并拍照,图像用Image J 6.0软件分析,测定平均荧光强度。
2.6 HE染色观察股骨形态变化
右侧股骨远端置于4%多聚甲醛固定48 h后,PBS缓冲液冲洗3次,20 min/次,放入EDTA脱钙液中,置于37 ℃恒温箱中脱钙4周,直至大头针能刺穿股骨后停止脱钙。随后进行脱水、透明、包埋、切片等步骤,按HE染色步骤染色后,显微镜下观察骨形态变化。
2.7 Micro-CT检测股骨微结构变化
应用Micro-CT CT50成像系统(Micro-CT CT50,Sanco Medical)评价大鼠右侧股骨远端的微观结构,分辨率为18 μm,并采用系统分析软件选定目的区域骨组织分析骨体积(bone volume,BV)、相对骨体积 [BV/组织体积(tissue volume,TV)]、骨小梁数量(trabecular number,Tb.N)、骨小梁分离度(trabecular separation/spacing,Tb.Sp),所有标本的分析范围保持一致。
2.8 统计学分析
研究数据采用xˉ±s表示,采用SPSS 19.0软件进行分析,组间比较进行单因素方差齐性分析,若方差齐,组间比较采用LSDt检验;若方差不齐,组间比较采用Dunnett’st检验,P<0.05表示有统计学意义。
3 结果
3.1 各组大鼠血清性激素水平的变化
与假手术组比较,模型组大鼠血清雌二醇水平显著下降(P<0.01),LH、FSH、GnRH水平显著升高(P<0.01);与模型组比较,雌二醇组大鼠血清雌二醇水平显著升高(P<0.01),LH、FSH、GnRH水平显著下降(P<0.01);与模型组比较,二十五味鬼臼丸组大鼠血清雌二醇水平变化无统计学意义,但LH、FSH、GnRH水平显著下降(P<0.05、0.01)。结果见表2。
表2 各组大鼠血清性激素水平的变化 ( ±s , n=9)Table 2 Changes of serum sex hormone levels in rats of each group ( ±s , n=9)

表2 各组大鼠血清性激素水平的变化 ( ±s , n=9)Table 2 Changes of serum sex hormone levels in rats of each group ( ±s , n=9)
与假手术组比较:**P<0.01;与模型组比较:#P<0.05 ##P<0.01,下同**P < 0.01 vs Sham group; #P < 0.05 ##P < 0.01 vs model group, same as below
组别 雌二醇/(pmol·L-1) LH/(mIU·mL-1) FSH/(IU·L-1) GnRH/(mIU·mL-1)假手术 71.59±1.66 10.72±0.36 10.79±0.40 75.60±4.15模型 59.31±0.68** 13.42±0.44** 14.10±0.17** 90.05±1.55**雌二醇 67.73±0.62## 11.32±0.22## 11.86±0.15## 81.85±1.08##二十五味鬼臼丸 60.67±0.48 11.78±0.26## 12.52±0.24## 85.05±1.78#
3.2 各组大鼠下丘脑、垂体和股骨ERα、ERβ mRNA水平变化
与假手术组比较,模型组大鼠下丘脑ERα、ERβmRNA显著下降(P<0.01);与模型组比较,雌二醇组和二十五味鬼臼丸组下丘脑ERαmRNA表达水平明显升高(P<0.01),但ERβmRNA表达水平差异无统计学意义。见图1。
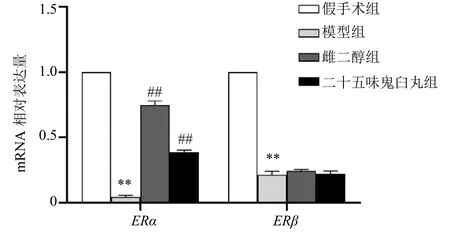
图1 各组大鼠下丘脑ERα、ERβ mRNA水平的变化(±s , n=9)Fig.1 Changes of ERα and ERβ mRNA levels in hypothalamus of rats in each group (±s , n=9)
与假手术组比较,模型组大鼠垂体ERα、ERβmRNA表达水平显著下降(P<0.01)。与模型组比较,雌二醇组和二十五味鬼臼丸组垂体ERαmRNA表达水平明显升高(P<0.01);雌二醇组垂体ERβmRNA表达水平明显升高(P<0.01),二十五味鬼臼丸组垂体ERβmRNA表达水平差异无统计学意义。结果见图2。

图2 各组大鼠垂体ERα、ERβ mRNA水平的变化(±s , n=9)Fig.2 Changes of ERα and ERβ mRNA levels in pituitary of rats in each group (±s , n=9)
与假手术组比较,模型组大鼠股骨ERα、ERβmRNA表达水平显著下降(P<0.01)。与模型组比较,雌二醇组股骨ERα、ERβmRNA表达水平明显升高(P<0.01),二十五味鬼臼丸组股骨ERβmRNA表达水平明显升高(P<0.01),但ERαmRNA表达水平差异无统计学意义。结果见图3。

图3 各组大鼠股骨ERα、ERβ mRNA水平的变化(±s , n=9)Fig.3 Changes of ERα and ERβ mRNA levels in femur of rats in each group (±s , n=9)
3.3 各组大鼠下丘脑、垂体和股骨ERα、ERβ蛋白水平变化
下丘脑免疫荧光染色显示(图4),ERα蛋白表达阳性为红色,ERβ蛋白表达阳性为绿色。免疫荧光结果(图5)显示,与假手术组比较,模型组ERα、ERβ蛋白平均荧光强度显著降低(P<0.01)。与模型组比较,雌二醇组和二十五味鬼臼丸组ERα蛋白平均荧光强度显著增强(P<0.01),而ERβ蛋白平均荧光强度差异无统计学意义。

图4 下丘脑ERα、ERβ荧光染色 (×100)Fig.4 Fluorescence staining of ERα and ERβ inpituitary in hypothalamus (× 100)

图5 下丘脑ERα、ERβ蛋白半定量分析结果 (±s , n=9)Fig.5 Results of semi-quantitative analysis of ERα and ERβ proteins in hypothalamus (±s , n=9)
垂体免疫荧光染色显示(图6),ERα蛋白表达阳性为红色,ERβ蛋白表达阳性为绿色。免疫荧光结果(图7)显示,与假手术组比较,模型组ERα、ERβ蛋白平均荧光强度显著降低(P<0.01)。与模型组比较,雌二醇组ERα、ERβ蛋白平均荧光强度显著增强(P<0.01);二十五味鬼臼丸组ERα蛋白平均荧光强度显著增强(P<0.01),ERβ蛋白平均荧光强度差异无统计学意义。

图6 垂体ERα、ERβ荧光染色 (×100)Fig.6 Fluorescence staining of ERα and ERβ in pituitary (× 100)

图7 垂体ERα、ERβ蛋白半定量分析结果 (±s , n=9)Fig.7 Results of semi-quantitative analysis of ERα and ERβ proteins in pituitary (±s , n=9)
股骨免疫荧光染色显示(图8),ERα蛋白表达阳性为红色,ERβ蛋白表达阳性为绿色。免疫荧光结果(图9)显示,与假手术组比较,模型组ERα、ERβ蛋白平均荧光强度显著降低(P<0.01)。与模型组比较,雌二醇组ERα、ERβ蛋白平均荧光强度显著增强(P<0.01);二十五味鬼臼丸组ERβ平均荧光强度显著增强(P<0.01),ERα蛋白平均荧光强度差异无统计学意义。
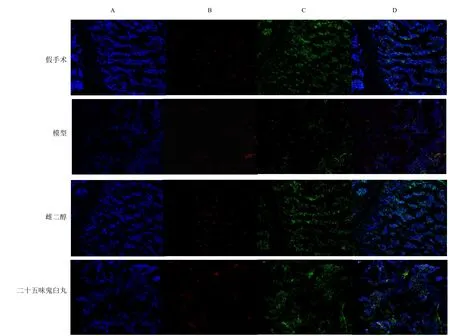
图8 股骨ERα、ERβ荧光染色 (×50)Fig.8 Fluorescence staining of ERα and ERβ in femur (× 50)

图9 股骨ERα、ERβ蛋白半定量分析结果 (±s , n=9)Fig.9 Results of semi-quantitative analysis of ERα and ERβ proteins in femur ( ±s , n=9)
3.4 股骨形态变化
假手术组骨小梁排列有序,结构致密完整;模型组大鼠骨小梁稀疏,排列紊乱甚至中断,腔隙变大,网状结构损坏;与模型组比较,雌二醇组骨小梁明显增多,排列尚规则,网状结构明显修复;二十五味鬼臼丸组骨小梁明显增多,但排列仍有中断,可见腔隙间仍有少量脂肪细胞填充。见图10。

图10 各组大鼠股骨形态变化 (HE,×400)Fig.10 Morphological changes of femur in each group (HE, × 400)
3.5 各组大鼠股骨Micro-CT扫描及微结构参数的变化
与假手术比较,模型组大鼠BV、BV/TV、Tb.N显著下降(P<0.01),Tb.Sp显著升高(P<0.01)。与模型组比较,雌二醇组和二十五味鬼臼丸组BV、BV/TV、Tb.N显著升高(P<0.01),Tb.Sp显著下降(P<0.01)。见图11和表3。
表3 各组大鼠股骨计量学结果 (±s , n=9)Table 3 Femur histometric results in rats of each group (±s , n=9)

表3 各组大鼠股骨计量学结果 (±s , n=9)Table 3 Femur histometric results in rats of each group (±s , n=9)
组别 BV/mm3 (BV/TV)/% Tb.N/(μm-1) Tb.Sp/μm假手术 3.52±0.23 63.56±3.02 0.004 5±0.000 2 107.15±14.54模型 0.60±0.26** 11.34±3.03** 0.001 1±0.000 5** 412.20±72.08**雌二醇 2.73±0.29## 50.41±7.18## 0.004 2±0.000 1## 135.19±23.56##二十五味鬼臼丸 1.58±0.26## 31.44±5.18## 0.003 2±0.000 4## 214.97±23.02##

图11 各组大鼠股骨远端Micro-CT扫描结果Fig.11 Micro-CT scan results of rat distal femurs in each group
4 讨论
HPOA作为经典调节轴,是调节女性体内性激素水平稳定的主要神经内分泌轴。在女性进入围绝经期之前,HPOA轴能够维持激素水平稳定,而女性进入围绝经期之后,由于卵巢功能衰退,体内雌激素水平显著下降,HPOA轴已不能发挥其正常功能,导致下丘脑、垂体释放大量GnRH、LH、FSH。体内性激素水平紊乱导致女性出现一系列临床症状,如燥热、失眠、情绪波动、骨量减少等。围绝经期是女性骨量丢失最多、最迅速的时期,在此期间,体内雌激素水平仍在正常范围,而促性腺激素处于高水平阶段;到疾病中后期,雌激素缺乏才是骨量丢失的主要原因[9]。因此,近年来有大量研究证明,在围绝经期促性腺激素与骨量之间存在一定相关性[10-11]。Liu等[12]在研究FSH多克隆抗体对去卵巢小鼠脂肪组织的影响时发现,FSH抗体与受体结合后还会增加小鼠骨量,推测FSH受体可能是治疗绝经后肥胖及骨质疏松的潜在靶标,该研究与Ji等[13]的实验结果一致。Wang等[14]在观察围绝经期妇女FSH与破骨细胞活性标志物I型胶原肽羧基端交联肽(C-terminal cross-linked telopetides of type I collagen,CTX)的关系时发现,围绝经期间女性FSH与CTX都显著升高,提示高水平的FSH能促进破骨细胞活性,导致骨量丢失。LH是雌激素水平降低后负反馈刺激HPOA轴分泌的另一种激素,Blair等[15]实验证明,降低血清LH水平后会引起去卵巢大鼠骨密度增加。大量实验研究都已验证HPOA轴中的促性腺激素对骨质疏松有直接调控作用,可能这也是临床中补充雌激素后导致体内促性腺激素水平降低,对破骨细胞促进作用减弱,从而防治骨质疏松的机制之一。本研究表明,二十五味鬼臼丸显著降低血清LH、FSH、GnRH水平,增加远端股骨密度,该结果与Zhou等[16]和Wong等[17]的结果一致,提示HPOA轴可能参与骨代谢。同时二十五味鬼臼丸选择性上调下丘脑、垂体ERα表达,推测二十五味鬼臼丸可能通过与ERα结合降低血清LH、FSH、GnRH水平,从而间接调控骨密度。
骨组织同样能够表达ER,雌激素可直接作用于骨组织ER调控骨细胞(破骨细胞和成骨细胞)活性,进而控制骨量变化。针对这一机制,选择性雌激素受体调节剂成为临床研究热点,巴多昔芬是该类药物代表之一,已有大量实验长期研究其安全性及有效性,实验证明巴多昔芬通过结合雌激素受体能有效增加骨密度,降低骨折发生率,并减少不良反应的发生[18-20]。植物雌激素由于与雌激素有共同的酚环结构,因此能够与ER结合发挥相同效应,并具有双重调节作用,被认为具有选择性ER调节作用。近年来由于临床常规治疗方法的远期并发症较多,植物雌激素成了研究对象,其治疗PMOP的有效性在各实验中早已得到了验证[21-22]。ERβ在骨组织中分布广泛,有研究表明ERβ多态性与高骨密度相关[23]。Lee等[24]研究雷公藤的多糖提取物对去卵巢小鼠更年期症状的影响时发现,雷公藤多糖提取物是通过调节ERβ而不是ERα相关的蛋白激酶B(protein kinase,Akt)信号通路减轻PMOP。本研究结果显示,与模型组比较,二十五味鬼臼丸组显著上调大鼠股骨ERβ的表达,结果提示二十五味鬼臼丸可能通过ERβ直接调控骨密度。
综上所述,藏药二十五味鬼臼丸对防治PMOP有一定作用,能有效改善绝经后骨密度下降及骨微结构紊乱,其机制可能与药物作用骨组织ER后直接调控骨密度,或作用HPOA轴靶器官相关ER后通过改变体内性激素的水平间接调控骨代谢有关。
利益冲突所有作者均声明不存在利益冲突

