鸦胆子中苦木素类化学成分及其药理作用研究进展
邬 琪,孙 薇,王力玄,刘 晴,周小平,王 艳
吉林大学药学院,吉林 长春 130021
鸦胆子Bruceae Fructus又称老鸦胆、鸦蛋子、苦参子等,为苦木科(Simaroubaceae)鸦胆子属BruceaJ.F.Mill.植物鸦胆子Brucea javanica(L.)Merr.的干燥成熟果实,主要产于广东、广西、福建、台湾等地[1]。鸦胆子果实成熟后采收晒干,除去果壳和杂质后方可入药,具有截疟、止痢、清热解毒、治疗赘疣等功效[2]。
目前,对鸦胆子的应用主要是提取鸦胆子油,将其制备成乳剂或软胶囊,广泛应用在各种癌症的辅助治疗方面。苦木素类化合物是鸦胆子中含量最高且活性最好的成分,特别是抗肿瘤作用和抗疟作用,代表化合物有bruceine D、brusatol和bruceantin等,而鸦胆子中的其他化学成分,如苯丙素类、黄酮类、三萜类、甾体类、生物碱类、脂肪酸类和酚酸类等的药理作用鲜有报道。因此,本文仅综述了鸦胆子中的苦木素类化学成分,并对其药理作用进行了归纳。
1 苦木素类化学成分
苦木素类化合物大多由3个六元环(A、B、C环)和1个内酯环(D环)构成(图1),在C环的C8与C13位之间多有C8-CH2-O-C13桥连接,且常在C2或C3位成苷,具有较高的生物学活性,是鸦胆子中研究最多的成分。现已从鸦胆子中分离出近百种苦木素类化合物。

图1 鸦胆子中苦木素类化合物母核Fig.1 Nuclear parent of quassinoids from Bruceae Fructus
1.1 Bruceines类化合物
Bruceines又称鸦胆子苦素、鸦胆因,这类化合物具有较好的药理作用,其代表化合物bruceine D(1)[3]具有显著的抗肿瘤作用,与其结构类似的bruceines类化合物还有bruceine H(2)[4],bruceine E、F(3、4)[3-4],bruceine M(5)[5],bruceine K、L(6、7)[6],bruceine J(8),bruceine A(9)[7],bruceine B、C(10、11)[8]和bruceine I(12)[9]。其中,化合物6结构较特殊,与其他苦木素具有的C8-CH2-O-C13桥不同,其-CH2-O-键连接在C8和C12位之间。
化合物brusatol(13)[10]、bruceantarin(14)、bruceantin(15)、bruceantinol(16)[11]、desmethyl-brusatol(17)[12]和bruceantinol B(18)[7]结构相似,仅C13位和C15位侧链不同。其中化合物14在C15上具有苯甲酸酯结构。化合物13~16具有较好的药理作用,包括抗肿瘤、抗炎、抗医学原虫等,但化合物17和18几乎没有研究。化合物1~18的结构见图2。
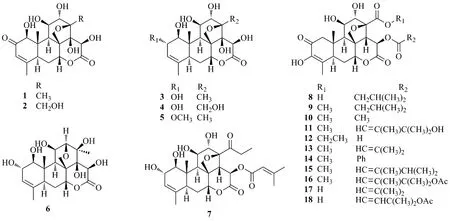
图2 鸦胆子中bruceines类苦木素类化合物的结构Fig.2 Chemical structures of bruceines of quassinoids from Bruceae Fructus
1.2 Yadanziolides类化合物
Yadanziolides类化合物中yadanziolide A(19)和yadanziolide C(20)[13]具有较好的药理作用,在抗肿瘤、抗炎、抗医学原虫中均有涉及。Yadanziolides类化合物还有yadanziolide B(21)[13]、yadanziolide D(22)[14]、yadanziolide W(23)[15]、yadanziolide X~Z(24~26)[16]、yadanziolide S(27)[17]和yadanziolide Q(28)[16]。其中,化合物22结构较特殊,其A环和B环均为五元环,A环为内酯环,且未和B环稠合在一起。化合物24和25的结构也比较特殊,其C7和C14位间未形成内酯环(D环),而在C12和C16位间形成内酯环,具有1,2-seco-1-nor-6(5→10)abeo-picrasane骨架,二者的主要区别在于化合物24的A环为五元环,而化合物25的A环为六元环。其中化合物27在C8与C13位间不具有C8-CH2-O-C13桥。化合物19~28的结构见图3。

图3 鸦胆子中yadanziolides类苦木素类化合物的结构Fig.3 Chemical structures of yadanziolides of quassinoids from Bruceae Fructus
1.3 Javanicolides类化合物
Javanicolides类化合物中的javanicolide H(29)[18]和javanicolide E(30)[19]具有抗肿瘤作用。此类化合物还包括javanicolide F(31)[19],javanicolide A、B(32、33)[20]和javanicolide C、D(34、35)[21]。其中化合物32的结构比较独特,其C12和C16位之间的桥环内酯结构与化合物24、25相似;A环和B环结构与化合物22相似,即A环为内酯环且未和B环稠合。化合物33是苦木素类中唯一的C17位上连有羟基的苦木素。化合物34是唯一的A环上连有2个羟基的苦木素。化合物29~35的结构见图4。

图4 鸦胆子中javanicolides类苦木素类化合物的结构Fig.4 Chemical structures of javanicolides of quassinoids from Bruceae Fructus
1.4 鸦胆子酮酸类化合物
鸦胆子酮酸是A环氧化开环的苦木素类化合物,包括bruceaketolic acid(36)[3]、bruceanic acid E(37)、bruceanic acid F(38)、bruceanic acid C(39)、bruceanic acid E methyl ester(40)、javanic acid A(41)和javanic acid B(42)[18]。化合物brujavanol A、C、D(43~45)被Chumkaew等[22-24]首次分离得到,同时还得到了苦木素类化合物中唯一的C5位上有取代基(羟基)的5α,14β,15β-trihydroxyklaineanone(46)。从结构上看,化合物43~46与传统的苦木素类化合物相比,在C8与C13位之间不具有C8-CH2-O-C13桥。化合物36~46的结构见图5。
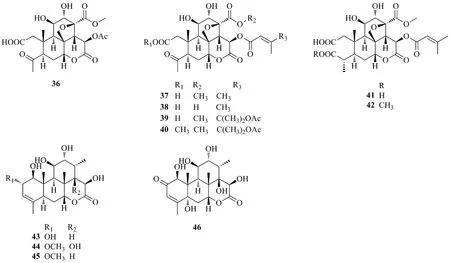
图5 鸦胆子中酮酸类苦木素类化合物的结构Fig.5 Chemical structures of bruceanic acids of quassinoids from Bruceae Fructus
1.5 苦木素苷类化合物
苦木素苷类包括bruceosides、yadanziosides、javanicosides和其他苷类,其糖苷键连在C2或C3位上,药理作用研究较少。
Bruceosides包括bruceoside C(47)、bruceoside B(48)、bruceoside A(49)[25]和bruceoside D~F(50~52)[26]。化合物47、48的糖苷键连在C3位上,而化合物49~52的糖苷键连在C2位上。其中,化合物47与化合物23结构相似,均在C6位上连有酯的结构。结构见图6。

图6 鸦胆子中bruceosides类苦木素苷类化合物的结构Fig.6 Chemical structures of bruceosides of quassinoids glucosides from Bruceae Fructus
Yadanziosides包括yadanzioside B、D、E、H、A、C、G(53~59)[27],yadanzioside F、J(60、61)[13],yadanzioside O、M、N、K(62~65)[28],yadanzioside I、L(66、67)[13]和yadanzioside P(68)[29]。其中,化合物63的C15侧链与化合物14一样,也具有苯甲酸酯结构,化合物14和化合物63是目前发现的仅有的2个在C15位侧链酯结构中具有苯环的化合物。化合物64 A环上的羰基位于C1位上,而其他苦木素A环上的羰基一般位于C2或C3位上。结构见图7。
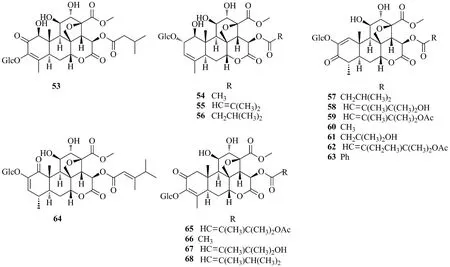
图7 鸦胆子中yadanziosides类苦木素苷类化合物的结构Fig.7 Chemical structures of yadanziosides of quassinoids glucosides from Bruceae Fructus
Javanicosides包括javanicoside A、B(69、70)[20],javanicoside C~F(71~74)[21]和javanicoside G、H(75、76)[30],目前几乎未见有关此类化合物药理作用的研究报道。结构见图8。
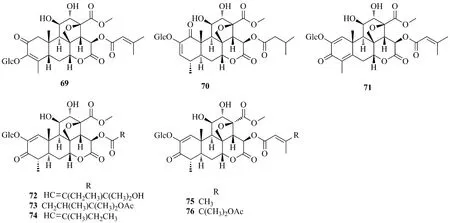
图8 鸦胆子中javanicosides类苦木素苷类化合物的结构Fig.8 Chemical structures of javanicosides of quassinoids glucosides from Bruceae Fructus
此外,苦木素苷类化合物还包括bruceantinoside A(77)[21]、desmethyl-bruceantinoside A(78)、butyl ester of bruceoside D(79)[12]、bruceine E 2-β-Dglucoside(80)[31]、yadanzigan(81)[17]和20-hydroxy-yadanzigan(82)等[4]。化合物77~82的结构见图9。

图9 鸦胆子中其他苦木素苷类化合物的结构Fig.9 Chemical structures of other quassinoids glucosides from Bruceae Fructus
1.6 其他化合物
除上述化合物外,鸦胆子中还分离得到了一些其他苦木素类化合物,如quassin A(83)[18],其D环(内酯环)开环变为酸。Bruceene A(84)[32]和bruceene(85)[33]为苦木素类中仅有的2个C4位上连有=CH2结构的化合物,二者结构相似,区别在于前者C13位取代基为甲基,而后者为羟甲基。化合物javanicin(86)[34]A环开环,变为酸和1个与B环、C环稠合的内酯环。2020年,Su等[35]得到2个结构新颖的新化合物quassilactone A、B(87、88),其D环开环,而A环变为内酯环,C4和C7之间连有氧,且二者结构十分接近,quassilactone A(87)仅在C15位侧链上比quassilactone B(88)多1个碳碳双键。
此外,苦木素类化合物还有dehydrobrusatol(89)、dehydrobruceantinol(90)[27]、dehydrobruceine A(91)、dehydrobruceine B(92)[11]、dehydrobruceine C(93)[8]、dihydrobruceine A(94)、bruceolide(95)[11]和aglycone of yadanzioside D(96)[21]。化合物83~96的结构见图10。
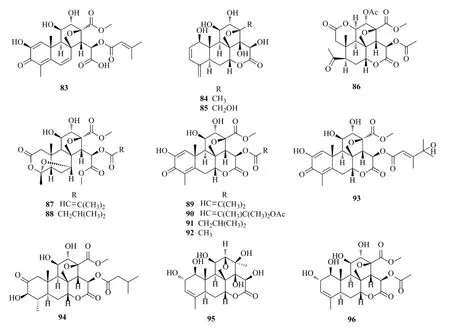
图10 鸦胆子中其他苦木素类化合物的化学结构Fig.10 Chemical structures of other quassinoids from Bruceae Fructus
2 药理作用
2.1 抗肿瘤
在众多苦木素类化学成分中,bruceine D(1)是抗肿瘤作用研究最多的化合物,它能通过多种作用机制抑制肿瘤细胞的增殖、迁移和侵袭,诱导其凋亡和自噬,且对多种肿瘤细胞有效。Bruceine D对非小细胞肺癌A549细胞、人骨髓瘤NCI-H292细胞和人大细胞肺癌H460细胞均具有一定的抑制作用[36-38];Fan等[37]发现,bruceine D可诱导A549细胞和NCI-H292d细胞自噬体和自体溶酶体聚集,从而促进其自噬通量。Lau等[39]发现,bruceine D可通过激活p38-丝裂原活化蛋白激酶信号通路,改变多种凋亡相关蛋白表达,诱导胰腺癌PANC-1细胞凋亡。Bruceine D对乳腺癌MDA-MB-231细胞也具有较好的抑制作用[40-42],张贺等[40]发现,bruceine D可将其细胞周期阻滞在G0/G1期;王雨等[41]发现bruceine D可抑制磷脂酰肌醇-3-羟激酶/蛋白激酶B(protein kinase B,Akt)信号通路,抑制有氧糖酵解过程,从而降低其能量供应;Luo等[42]还发现bruceine D可通过逆转上皮-间质转化过程降低其迁移和侵袭能力。王文龙等[43]通过从多个数据库中采集数据发现,DAP3基因在多种肿瘤,包括乳腺癌中存在高表达迹象,并证实了bruceine D对乳腺癌MCF7细胞DAP3基因的下调作用。Bruceine D还可抑制多种肝癌细胞的生长,包括MIHA、PLC、HepG2、Hep3B、Huh7、MIHA和Bel-7404细胞,其作用机制之一可能为抑制miR-95基因的表达;同时裸鼠体内实验也证实了bruceine D对Hep3B细胞的抑制作用,且无明显毒性[44]。此外bruceine D还可通过抑制Notch和Wnt信号通路抑制肝癌细胞生长[45]。除上述机制外,bruceine D还能通过抑制信号转导及转录激活因子3(signal transducers and activators of transcription,STAT3)抑制骨肉瘤细胞的增殖和迁移,诱导细胞周期阻滞及凋亡,并可通过该途径抑制骨肉瘤干细胞,其活性显著且无副作用[46]。此外,bruceine D对慢性粒细胞白血病K562细胞也具有一定的抑制作用[47]。
核因子E2相关因子2(nuclear factor-E2 related factor 2,Nrf2)是协助细胞抵抗氧化应激的重要转录因子,在肿瘤细胞中能够促进肿瘤的生长与形成,降低肿瘤细胞对化疗的敏感性,从而诱导化疗耐药[48]。研究发现许多肿瘤细胞中存在Nrf2的表达,近年来对Nrf2抑制剂的研究呈指数增长趋势,而brusatol(13)是目前已知最强的Nrf2抑制剂[49]。Sun等[50]发现,brusatol可通过该途径使A549细胞对电离辐射的敏感性增强,说明brusatol可与放疗联用,增强放疗对肿瘤细胞的杀伤作用。王敏等[51]的研究表明,brusatol可通过下调Nrf2和Notch1蛋白的表达发挥对A549和H460细胞的抑制作用,其半数抑制浓度(median inhibitory concentration,IC50)分别为0.70、0.47 μmol/L。陈果等[52]发现brusatol可下调A549细胞转移相关蛋白的表达水平,显著抑制其迁移能力。由此可见,brusatol有望作为Nrf2抑制剂和细胞转移抑制剂在癌症治疗中发挥重要作用。Brusatol还可通过抑制Akt/哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)信号通路抑制鼻咽癌细胞CNE-1、CNE-2、5-8F和6-10B的增殖,并促进其凋亡,MTT检测结果显示,其IC50值在22.69~244.20 nmol/L[53]。此外,brusatol还可显著抑制结直肠癌HCT116和HT29细胞[54],前列腺癌DU145和PC3细胞[55],黑色素瘤A375细胞[56],胰腺癌MIA PaCa-2、AsPC-1、PANC-1、SW1990细胞,特别是对MIA PaCa-2细胞的抑制,其IC50值为0.007 μmol/L[57]。贺今等[58]通过体内实验表明,brusatol可改善苯致急性髓细胞白血病小鼠的T淋巴细胞免疫功能,并诱导细胞凋亡。
鸦胆子中还存在许多具有抗肿瘤作用的化合物,如bruceantin(15),可显著抑制多发性骨髓瘤干细胞的生长和迁移,同时对肿瘤血管生成具有抑制作用,其机制之一可能为抑制Notch信号通路[59]。Bruceantin还可抑制胰腺癌MIA PaCa-2、AsPC-1、PANC-1和SW1990细胞,对上述细胞也有较好抑制作用的还包括化合物bruceine A(9)、bruceine B(10)、bruceantinol(16)和yadanziolide C(20),特别是bruceantinol对后3种细胞的抑制作用的IC50值均小于阳性对照药喜树碱。此外,bruceantinol、bruceine A、brusatol和bruceantarin(14)可显著抑制乳腺癌MCF-7和MDA-MB-231细胞[32]。其中的bruceine A还可抑制非小细胞肺癌H460、H1299、H1355和A549细胞[60-61]及乳腺癌T47D细胞[62]。刘俊宏[18]发现bruceine L(7)可显著抑制肝癌HepG2细胞和卵巢癌SKVO3细胞,其IC50值均小于0.1 μmol/L。Huang等[63]发现dehydrobruceine B(92)与顺铂联用对诱导A549细胞凋亡具有协同作用,且能够降低多药耐药相关蛋白的表达。另外,bruceine H(2)、bruceine E(3)、javanicolide H(29)、javanicolide E(30)和dehydrobrusatol(89)对HCT-8、HepG 2、BGC-823、A549和SKVO3细胞均具有较好的抑制作用,其IC50值在0.12~9.30 μmol/L[64]。化合物yadanzioside P(40)还被证实具有抗白血病活性[29]。
2.2 抗炎
鸦胆子中许多苦木素类化学成分具有抗炎作用,如化合物bruceine E(3)、bruceine B(9)、bruceine C(11)、bruceantinol(16)和dehydrobruceine C(93)可抑制一氧化氮(nitric oxide,NO)生成,从而抑制炎症反应,其中bruceine C和bruceantinol的抑制作用更加显著[8,64]。Zhan等[65]发现,bruceine D(1)、bruceine E(3)、bruceine F(4)、yadanziolide A(19)、yadanzigan(81)和20-hydroxy-yadanzigan(82)具有显著的抗补体活性,对经典途径和旁路途径均有显著的抑制作用。其中yadanzigan可抑制核转录因子-κB(nuclear transcription factor-κB,NF-κB)信号通路,显著降低各种促炎因子的水平[4]。Zhou等[66]发现,brusatol(13)可抑制NF-κB p65在细胞核内积累,降低多种促炎因子水平,同时提高Nrf2基因的表达,从而使过氧化氢酶、超氧化物岐化酶和谷胱甘肽水平提高,减轻氧化应激。此外还通过大鼠体内实验测试了brusatol对结肠炎的治疗作用,结果显示brusatol可明显改善结肠缩短及结肠组织坏死,结肠损伤程度明显降低[66]。
2.3 抗医学原虫
苦木素类化学成分的抗医学原虫作用主要包括抗恶性疟原虫和抗阿米巴原虫,其作用效果非常显著,但目前对其作用机制的研究较少。
Bruceantin(15)是苦木素中抗恶性疟原虫作用最强且研究最多的化合物。O'neill等[67]通过测试bruceantin及化合物bruceine A~D(9~11,1)、brusatol(13)、bruceantinol(16)、yadanziolide A(19)和dehydrobruceine A(91)对恶性疟原虫摄取3H-次黄嘌呤的抑制作用,证实了上述化合物具有对恶性疟原虫核酸和蛋白质合成的抑制作用,其中bruceantin活性最强,其IC50值可达到0.000 8 μg/mL,其他化合物的IC50值在0.002~0.046 μg/mL。Lee等[10]发现,brusatol(13)能抑制有氯喹抗性的恶性疟原虫,其半数有效量(median effective dose,ED50)为7.58 ng/mL;同时发现苦木素类化合物的C15位取代基的存在特别是刚性结构,可增强抗疟作用,且C23位引入刚性烷基也可增强抗疟作用。化合物brujavanols C、D(44、45)对恶性疟原虫也有一定的抑制作用[23-24]。
化合物bruceantin(15)和bruceine A~D(9~11、1)具有很好的抗阿米巴原虫作用,其IC50值在0.019~0.386 μg/mL,yadanzioside F(60)也有一定的抗阿米巴作用。
通过对比上述化合物对两种医学原虫的抑制作用,可以发现二者具有相同的趋势,这表明苦木素类化学成分对二者可能有相同或相似的作用机制[68]。
2.4 其他
除抗肿瘤、抗炎和抗医学原虫外,鸦胆子中的苦木素类化学成分还具有抗人乳头瘤病毒(human papilloma virus,HPV)、抗帕金森、治疗脊髓性肌萎缩及分解脂肪的药理作用。
宫颈癌与高危型HPV病毒持续感染密切相关,体外研究表明,bruceine D(1)可通过降低HPV16病毒E6、E7基因的表达抑制其复制,抑制人宫颈鳞状上皮永生化细胞Ect1/E6E7(HPV16感染模型)的增殖,并促进其凋亡,从而抑制病毒持续感染[69]。
Yang等[70]通过小鼠体内实验发现,bruceine D(1)还具有抗帕金森作用,可明显改善帕金森小鼠的运动功能,且通过激活Nrf2信号通路而发挥作用,具体表现为抑制NF-κB的激活、抑制神经炎症反应以及改善1-甲基-4-苯基-1,2,3,6-四氢吡啶攻击的抗氧化系统,且无副作用。
Baek等[71]通过小鼠体内实验发现bruceine D(1)、brusatol(13)、bruceantinol(16)和yadanziolide C(20)对脊髓性肌萎缩具有显著治疗作用,特别是对肌肉功能的改善。其中活性最强的化合物为bruceine D,可使小鼠翻正反射明显改善,存活时间延长2~3 d,运动神经元生存蛋白(survival of motor neurons protein,SMN)水平提高约3.5倍,其机制为通过调节关键因子异质性胞核核糖核蛋白A1的表达,纠正或部分纠正SMN2剪接缺陷。
Lahrita等[72]发现bruceine A~C(9~11)、brusatol(13)和bruceantinol(16)对3T3-L1脂肪细胞有显著的分解作用,其中bruceantinol的活性最强。研究同时发现,酰基侧链的长度可能对分解脂肪的活性有重要影响。
3 结语与展望
鸦胆子中含有丰富的苦木素类化学成分。研究发现,提取鸦胆子油后的药渣中仍含有许多活性化合物,主要为苦木素类化合物,这表明鸦胆子的价值未得到充分利用[4,16,73-74]。目前对苦木素类化合物的研究主要集中在bruceine D(1)和brusatol(13)上,仍有许多化合物的药理作用有待深入研究,药理作用机制有待阐明。药动学研究表明,bruceoside A(49)在体内可转化为抗肿瘤作用显著的brusatol(13),这表明一些活性较弱的苦木素类化合物也可能具有深入研究和应用的价值[75]。同时,苦木素类化学成分在抗肿瘤转移及耐药逆转方面也具有较大的应用前景。因此,鸦胆子中的苦木素类化合物具有一定的研究价值和研究前景。
利益冲突所有作者均声明不存在利益冲突

