一株磺胺二甲嘧啶抗性菌的筛选及抗性机制研究
车 琦, 王继华, 崔 红, 黄 涵
哈尔滨师范大学, 黑龙江 哈尔滨 150025
抗生素的不合理与大量使用,在全球范围内引起广泛关注,已被视为对生物体和人类健康的新威胁[1]. 磺胺类药物(sulfonamides, SAs)价廉、广谱,广泛用于畜牧、医药临床等领域,且可以通过甲氧苄啶(trimethoprim, TMP)提高其抗菌活性,增强普遍适用性,扩大抗菌治疗范围[2-4]. SAs因在体内不能完全代谢,30%~90%的母体大分子会随代谢废物进入环境[5-6],且难以被自然降解[7],已在各类水环境中检测出其残留浓度在ng/L~mg/L级别[8-9]. 磺胺二甲嘧啶(sulfadimidine, SMZ)作为典型的SAs,广泛用于动物疾病的防御与治疗[10]. 在自然水体中的残存浓度最高可达104ng/L,风险较高[11-14],且极易诱发和传播抗性菌(antibiotics resistance bacteria, ARB)及抗性基因(antibiotics resistance genes, ARGs)[15-17]. 同时,ARB消亡后,其携带ARGs的裸露DNA可在微生物之间再次传播[18-20].
抗生素抗性数据库(comprehensive antibiotic resistance database, CARD)已列示的19个磺胺类ARB属中,不动杆菌属(Acinetobacter)和假单胞菌属(Pseudomonas)具备多重抗性[21-23]. 研究[24-25]发现,ARB携带的磺胺类ARGs主要有sul1、sul2和sul3,sul1基因组成Int1基因的3′保守区段,sul2、sul3基因在菌株质粒中被发现[26]. TMP的ARGs主要包括dfrA与dfrB两大类,载体为整盒子,与磺胺类ARGs共存[27]. Wang等[21]在不动杆菌属、芽孢杆菌属和无色杆菌属中均检测到磺胺类ARGssul1、sul2、sul3以及甲氧苄啶ARGsdfrA. Smiline等[22]对鲍曼不动杆菌编码ARGs质粒的研究发现,编码dfrA1基因的ARB有17.8%同时编码sul1、sul2基因,均可由质粒、整合子、转座子等可移动元件介导传播,且SAs的抗性机制与dfrA1、sul1和sul2基因的遗传有关[28]. 进一步研究发现,ARB可通过改变药物作用靶位、主动外排药物、改变孔蛋白阻止抗生素渗透等机制对抗生素产生抗性[29]. 而SAs导致细菌抗性的机制主要是ARGs编码蛋白改变药物“旁路”代谢途径[30-31].
目前,地下水中SAs污染的研究主要集中在SAs的检测、ARGs检出水平及生态风险评价等方面[32-33]. 该研究基于传统微生物培养技术从地下水中筛得一株SMZ抗性菌,在形态学观察、生理生化试验、16S rRNA 基因测序的基础上,通过荧光定量PCR与普通PCR定量对磺胺类ARGs、甲氧苄啶ARGs以及Int1基因进行检测,结合NCBI同源性比对、KEGG功能注释,分析其抗性特性及抗性机制,以期为研究地下水中SAs抗性菌的环境行为、抗性机制以及抗生素风险评估提供数据支持.
1 材料与方法
1.1 水样的采集与处理
地下水样取自北京市东南发展区地下水监测井(60~80 m),取样容器经甲醇(Thermo Fisher Scientific, AR)和乙醇(>95%,AR)多次润洗,样品采集后保存在冰盒中运回实验室. 一部分样品经过滤、调节pH、加内标后,在24 h之内完成固相萃取,萃取后的样品采用高效液相色谱-串联质谱法检测SAs残留;另一部分样品经4 ℃保存,用于微生物筛选.
由图1(a)可知,地下水样品中除TMP外共检测到7种SAs,分别为磺胺地索辛(SDM)、磺胺嘧啶(SDZ)、磺胺苄胺(SML)、磺胺二甲嘧啶(SMZ)、磺胺甲基嘧啶(SMR)、磺胺甲恶唑(SMX)和磺胺噻唑(STZ),其中SMZ检出浓度最高,为 11 112 ng/L. 根据Verlicchi等[34-35]提出的风险熵(risk quotiet,RQ)评估模型,将RQ值划分为生态风险的3个级别(RQ>1 表示高风险,0.1
1.2 SMZ抗性菌的富集、分离、纯化
SMZ储备液:以甲醇做溶剂,经0.22 μm滤膜(津腾)过滤后避光保存在4 ℃冰箱,保存时间不超过7 d.
培养基:液体LB肉汤培养基和固体LB肉汤培养基中添加SMZ储备液用于菌株的富集与筛选.
取10 mL地下水样品,加入到90 mL液体LB培养基中,SMZ的浓度为1 mg/L,置于恒温水浴振荡培养箱(37 ℃、150 r/min)中培养15 d,完成第1周期富集. 利用高速冷冻离心机,PBS缓冲液制备第1周期菌悬液,取10 mL菌悬液,同第1周期培养条件进行第2周期的富集,此时SMZ的浓度为5 mg/L. 按照上述方法,依次完成后续3个周期的富集,SMZ浓度梯度依次为10、15、20 mg/L. 取第5周期富集液,用灭菌的生理盐水进行梯度稀释,均匀涂布于SMZ浓度为20 mg/L的固体LB培养基平板上,在37 ℃恒温生化培养箱中培养24~48 h,挑取单菌落进行菌株纯化,最终筛得一株SMZ抗性菌,命名为SMZ-R9.
1.3 SMZ抗性菌的鉴定
形态学观察:菌株置于37 ℃恒温培养24 h,观察菌株纯化过程中形成单菌落的大小、颜色、形状、边缘、质地、透明度等,并通过革兰氏染色记录菌株细胞大小.
生理生化试验:测定微生物增殖过程中代谢产物的生理生化反应是微生物分类鉴定的重要依据,观察某些化学反应,如糖发酵产酸产碱、柠檬酸盐产酸产碱、甲基红产酸、硝酸盐还原、伏普糖代谢、尿素酶、接触酶、氧化酶、淀粉酶酶催化等固有现象进行试验鉴定,试验结果参考《伯杰氏鉴定手册》.
分子生物学鉴定(16S rRNA):将固体LB培养基上分离得到的纯种菌株进行16S rRNA基因序列测定(上海生工生物工程技术服务有限公司),利用NCBI数据库对测序结果进行同源性比对,选取10条以上同源性较高的序列,利用MEGAX软件构建系统发育树.
1.4 菌株抗性特征及机制分析
以3种磺胺类ARGs、2种甲氧苄啶ARGs以及Int1基因为目标基因,对SMZ-R9菌株中的ARGs进行荧光定量PCR(BioRad CFX96 Touch,美国)检测. 引物信息如表1所示.

表1 ARGs引物信息
qPCR采用20 μL体系,包含10.0 μL SYBR Premix Ex TaqTM(TaKaRa),引物各0.4 μL,DNA模板1 μL及ddH2O 8.2 μL. 反应程序为95 ℃预变性1~2 min,95 ℃变性30 s,退火30 s,72 ℃延伸30 s,共40个循环. 溶解曲线温度为55~95 ℃,每0.5 ℃读数一次,期间停留30 s,测定时将标准质粒以10倍梯度稀释,再根据质粒浓度计算得到标准质粒的拷贝数,多次重复,计算检出率.
近年来,基于试验方法的优化,蛋白质功能预测准确性提高,利用蛋白质同源性分析或结合结构数据库Cdd[36]、Pfam[37]等进行功能注释研究时发现,同源性蛋白拥有相似甚至相同的生化功能[38]. 因此,将菌株SMZ-R9检出率最高的磺胺类ARGs和甲氧苄啶ARGs作为目的基因进行普通PCR定性检测,并对核酸序列进行解析获得蛋白序列信息,通过NCBI数据库与KEGG数据库进行序列同源性比对与功能注释,解析菌株SMZ-R9的SAs抗性特征及抗性机制.
2 结果与讨论
2.1 菌株鉴定
如图2(a)菌落形态所示,菌株SMZ-R9的菌落呈现暗白色、圆形、有黏性、边缘不齐无光泽;如图2(b)细胞形态所示,菌株细胞呈短杆状,革兰氏染色鉴定为阴性菌. 如表2所示,氧化酶反应、硝酸盐反应呈阴性,接触酶反应呈阳性,糖发酵不产碱,参照《伯杰氏鉴定手册》,初步判定与不动杆菌属生理生化特征较为相似. 经16S rRNA基因测序及序列同源性比对,SMZ-R9与多株不动杆菌的序列相似性较高;根据系统进化分析(见图3)发现,SMZ-R9与Acinetobacterlactucaestrain同源性为97%. 因此,鉴定菌株SMZ-R9为乳酸不动杆菌(Acinetobacterlactucae).
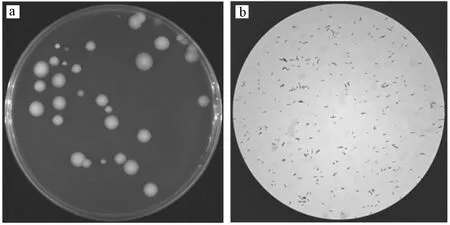
图2 菌株SMZ-R9形态学鉴定

表2 菌株SMZ-R9生理生化鉴定结果

图3 菌株SMZ-R9的16S rRNA系统发育树
2.2 抗性特征分析
如表3所示:菌株SMZ-R9磺胺类ARGssul2检出率最高,为69.05%,sul3基因检出率最低,为19.05%;Int1、sul1基因检出率分别为54.76%与64.29%,可能与sul1基因与Int1基因片段重合有关[26];甲氧苄啶ARGsdfrA1检出率为40.48%,dfrA12未检出.

表3 SMZ-R9菌株ARGs检出率
以检出率最高的磺胺类ARGssul2和甲氧苄啶ARGsdfrA1作为目的基因,进行基因扩增测序、序列解析及同源性分析,结果如图4所示. 由图4(a)可见,sul2基因编码蛋白与鲍曼不动杆菌二氢蝶呤合成酶(DHPs,QBR76772.1)、二氢蝶呤合成酶(sul1)(DHPs,AAA22697.1)的同源性均为100%. DHPs是一种功能性同型二聚体,在生物合成叶酸的过程中催化对氨基苯甲酸(pABA)的缩合,是核酸和蛋白质生物合成中不可或缺的辅助因子[39]. 如图4(b)所示,dfrA1基因编码蛋白与耐甲氧苄啶二氢叶酸还原酶(DHFR,WP010890144.1)的同源性为99%. DHFR是一种质粒编码的酶,参与介导细菌的抗性,与染色体编码的DHFR有一定的相似性[40].
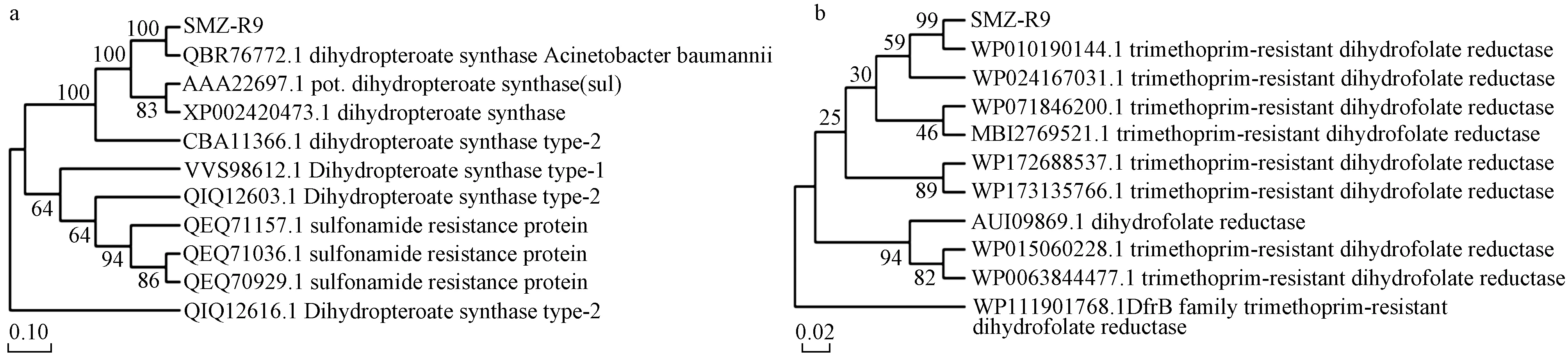
图4 SMZ-R9菌株ARGs蛋白同源性比对
2.3 抗性机制分析
叶酸参与微生物的生物合成与氨基酸代谢,在SAs环境压力下,菌株SMZ-R9体内四氢叶酸的合成受磺胺类ARGssul2和甲氧苄啶ARGsdfrA1的调控. 如图5所示,SAs与pABA具有相似结构,与底物pABA竞争蝶啶结合位点,导致细菌体内叶酸合成受阻,细菌生长、繁殖受挫[41-42]. SMZ-R9质粒基因sul2编码产生DHPs(EC 2.5.1.15),可作为二氢叶酸前体二氢蝶酸合成的关键酶,催化蝶啶与pABA合成二氢蝶酸,导致SAs竞争抑制降低,叶酸上游合成途径不受影响,SMZ-R9对SAs获得抗性. 部分研究也在革兰氏阳性细菌中分离出由sul1和sul2编码的DHPS1型和DHPS2型产物[43].

图5 SMZ-R9菌株抗性机制分析
SAs的靶标DHPs是叶酸途径中DHFR的上游酶[44],TMP是一种二氨基嘧啶类药物,与SAs之间起协同作用,以高于二氢叶酸的亲和力与DHFR结合,抑制酶的活性,干扰叶酸合成的下游途径[45]. 菌株SMZ-R9携带的dfrA1属于A类dfr基因家族,这些基因间氨基酸序列有64%~88%的同源性,介导高水平的抗性[46].dfrA1编码产生的DHFR(EC 1.5.1.3)即甲氧苄啶抗性蛋白,催化SMZ-R9菌株叶酸合成下游途径,促使二氢叶酸还原成四氢叶酸,参与生物合成及代谢. 以上研究表明,sul2基因与dfrA1基因表达产物催化菌株SMZ-R9的叶酸正常合成,生物合成与代谢得以顺利进行,细菌生长、繁殖未受SAs影响,即对SAs产生抗性.
3 结论
a) 从地下水中筛得一株SMZ抗性菌SMZ-R9,经形态学观察、生理生化试验及16S rRNA基因测序鉴定后,确定为乳酸不动杆菌(Acinetobacterlactucae),属于革兰氏阴性细菌.
b) SMZ-R9同时携带3种磺胺类ARGs(sul1、sul2、sul3)、1种甲氧苄啶ARGs(dfrA1)以及Int1基因.
c)sul2、dfrA1基因为编码DHPs与DHFR的核酸序列,表达产物分别催化叶酸合成的上游途径,pABA与蝶啶反应生成二氢蝶呤,以及下游途径二氢叶酸还原成四氢叶酸,共同介导菌株SMZ-R9的SAs抗性.

