α7烟碱型受体的激动剂和正变构调节剂改善精神分裂症大鼠的社会缺陷及机制研究
甘全喜,李晓勇,范银燕
胆碱能和多巴胺能系统之间失衡是精神分裂症病理生理学假说之一[1,2]。研究表明,烟碱型乙酰胆碱受体(nicotinic acetylcholine receptor,nAChR)(尤其是α7亚型)功能障碍与精神分裂症感觉运动缺陷相关[1]。α7 nAChR激动剂(如A-582941)不仅可改善精神分裂症认知缺陷,还可逆转γ-氨基丁酸能缺陷,如降低大鼠脑组织中小清蛋白和谷氨酸脱羧酶的表达[3,4]。增强脑组织中α7 nAChR的功能可能是治疗精神分裂症的潜在方案。但α7 nAChR激动剂常在低剂量时疗效低,在高剂量时迅速脱敏,存在“倒U”型的量效曲线[4],而α7 nAChR的正变构调节剂可以克服激动剂快速脱敏这一不利条件[5]。正变构调节剂与受体结合时不会诱导下一步反应,但会增强α7 nAChR天然和外源激动剂的作用[6]。α7 nAChR激动剂通过正构结合位点介导其作用,而正变构调节剂通过受体的变构结合位点介导其作用[7]。但α7 nAChR的激动剂和正变构调节剂对精神分裂症社会行为缺陷的影响的神经生物学机制还尚未彻底阐明。因此,本研究建立慢性精神分裂症大鼠模型,探讨α7 nAChR激动剂、Ⅰ型正变构调节剂、Ⅱ型正变构调节剂和非典型抗精神病药物对大鼠社会行为的影响及其潜在的分子机制。
1 材料与方法
1.1 主要试剂与材料
雄性SD大鼠48只购自湖北省医学实验动物中心,8~12周龄,体质量180~250 g,标准条件饲养。MK-801购自美国Sigma公司;α7 nAChR激动剂A-582941购自美国Adooq公司;CCMI(Ⅰ型正变构调节剂)、PNU-120596(Ⅱ型正变构调节剂)、氯氮平(非典型抗精神病药物)和二甲基亚砜(dimethyl sulfoxide,DMSO)均购自美国MedChemExpress公司。BCA蛋白定量试剂盒、ELISA试剂盒购自武汉默沙克生物科技有限公司。兔抗鼠α7 nAChR、磷酸二酯酶(phosphodiesterase,PDE)4A和PDE4D一抗购于美国Abcam公司。
1.2 方法
1.2.1 分组及造模 所有大鼠随机分为:对照组,模型组(MK-801+DMSO),激动剂组(MK-801+A-582941),Ⅰ型变构组(MK-801+CCMI),Ⅱ型变构 组(MK-801+PNU-120596),药 物 治 疗 组(MK-801+氯氮平);每组8只。后5组大鼠腹腔注射MK-801(0.2 mg/kg),2次/d(8∶00和20∶00),连续7 d[8];对照组在同一时间点注射相同体积的生理盐水。7 d洗脱期后,对照组和模型组腹腔注射等体积10%DMSO,激动剂组腹腔注射1 mg/kg A-582941,Ⅰ型变构组腹腔注射1 mg/kg CCMI,Ⅱ型变构组腹腔注射3 mg/kg PNU-120596,药物治疗组腹腔注射5 mg/kg氯氮平;1次/d,连续10 d。
1.2.2 社会行为测试 在黑色有机玻璃盒(50 cm×50 cm×30 cm)、半光条件下进行。第1天为适应期,第2天为测试期。测试方法:将待测鼠A和不熟悉的健康鼠B放到同一个小室中,自由度过10 min,记录每只待测鼠的跟随、回避和嗅探行为的时间。每只大鼠的总交互作用:跟随行为时间+嗅探行为时间-回避行为时间。由2位实验者根据视频记录进行评分,持续3 d,取2者3次的平均分为最后的数据。
1.2.3 指标检测 社会行为测试结束后,麻醉处死大鼠取脑,在冰上分离前额叶皮质和海马组织。ELISA试剂盒检测各组前额叶皮质和海马组织中环磷酸腺苷(cyclic adenosine monophosphate,cAMP)水平。采用BCA蛋白定量试剂盒测定上清液中的总蛋白,取20μg定量后的总蛋白,SDS-PAGE凝胶分离总蛋白,3%BSA封闭45 min;加入α7 nAChR、PDE4A和PDE4D一抗(1∶2 000稀释),4℃孵育过夜;TBST洗3次,加入二抗,室温摇床孵育1 h,TBST洗3次;化学发光。Image J软件统计处理条带,GAPDH为内参。
1.3 统计学处理
2 结果
2.1 各组大鼠社会行为比较
与对照组比较,模型组跟随行为和总交互作用时间显著降低(P<0.05),回避行为时间显著增加(P<0.05);Ⅰ型变构组总交互作用时间显著降低(P<0.05)。与模型组比较,激动剂组跟随行为和总交互作用时间显著增加(P<0.05),回避行为时间显著降低(P<0.05);Ⅰ型变构组、Ⅱ型变构组和药物治疗组的回避行为时间显著降低(P<0.05),而跟随行为和总交互作用时间差异无统计学意义(P>0.05);各组间嗅探行为时间差异无统计学意义(P>0.05),见表1。
表1 各组大鼠社会行为比较(s,±s)

表1 各组大鼠社会行为比较(s,±s)
注:与对照组比较,①P<0.05;与模型组比较,②P<0.05
组别对照组模型组激动剂组Ⅰ型变构组Ⅱ型变构组药物治疗组只数8 8 8 8 8 8跟随行为4.52±0.23 2.01±0.16①5.49±0.21②1.97±0.11 3.05±0.18 3.40±0.15回避行为1.34±0.05 3.21±0.09①1.75±0.06②0.87±0.05②1.68±0.10②1.22±0.08②嗅探行为28.39±3.71 21.43±5.25 32.50±6.18 18.62±4.02 27.95±4.68 25.33±5.01总交互作用31.57±4.56 21.21±3.19①36.26±5.36②19.70±3.57①29.31±3.03 27.53±3.41
2.2 各组大鼠α7 nAChR蛋白表达比较
与对照组比较,模型组前额叶皮质和海马组织中α7 nAChR蛋白表达量显著降低(P<0.05)。与模型组比较,激动剂组、Ⅰ型变构组、Ⅱ型变构组和药物治疗组前额叶皮质和海马组织中α7 nAChR蛋白表达量显著增加(P<0.05),见表2。
表2 各组大鼠α7 nAChR蛋白表达比较(±s)
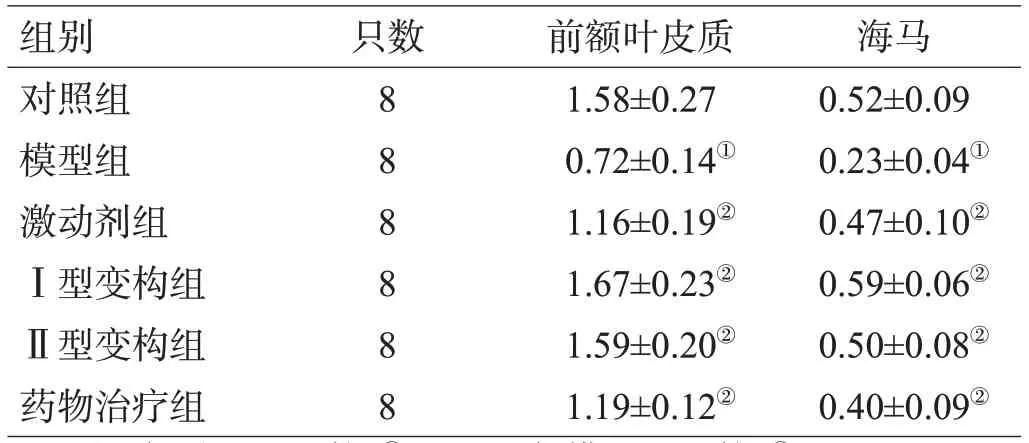
表2 各组大鼠α7 nAChR蛋白表达比较(±s)
注:与对照组比较,①P<0.05;与模型组比较,②P<0.05
组别对照组模型组激动剂组Ⅰ型变构组Ⅱ型变构组药物治疗组只数8 8 8 8 8 8前额叶皮质1.58±0.27 0.72±0.14①1.16±0.19②1.67±0.23②1.59±0.20②1.19±0.12②海马0.52±0.09 0.23±0.04①0.47±0.10②0.59±0.06②0.50±0.08②0.40±0.09②
2.3 各组大鼠cAMP水平比较
与对照组比较,模型组前额叶皮质cAMP水平显著降低(P<0.05)。与模型组比较,激动剂组、Ⅰ型变构组、Ⅱ型变构组和药物治疗组前额叶皮质cAMP水平显著增加(P<0.05);各组间大鼠海马组织中cAMP水平差异无统计学意义(P>0.05),见表3。
表3 各组大鼠cAMP水平比较(pmol/mL,±s)

表3 各组大鼠cAMP水平比较(pmol/mL,±s)
注:与对照组比较,①P<0.05;与模型组比较,②P<0.05
分组对照组模型组激动剂组Ⅰ型变构组Ⅱ型变构组药物治疗组只数8 8 8 8 8 8前额叶皮质13.06±2.49 7.43±1.51①12.95±2.07②13.40±2.13②12.71±2.84②12.88±1.97②海马13.81±3.05 13.89±2.64 13.28±3.19 12.67±2.50 12.53±2.72 12.29±2.38
2.4 各组大鼠PDE4A和PDE4D蛋白表达比较
与对照组比较,模型组前额叶皮质中PDE4A和PDE4D蛋白表达量显著增加(P<0.05);Ⅰ型变构组额叶皮质和海马中的PDE4A显著降低(P<0.05)。与模型组比较,激动剂组、Ⅰ型变构组和药物治疗组前额叶皮质中PDE4A和PDE4D蛋白表达量显著降低(P<0.05),Ⅱ型变构组前额叶皮质仅PDE4D蛋白表达量显著降低(P<0.05)。其余各组间海马组织中PDE4A和PDE4D蛋白表达量差异无统计学意义(P>0.05),见表4。
表4 各组大鼠PDE4A和PDE4D蛋白表达比较(±s)

表4 各组大鼠PDE4A和PDE4D蛋白表达比较(±s)
注:与对照组比较,①P<0.05;与模型组比较,②P<0.05
分组对照组模型组激动剂组Ⅰ型变构组Ⅱ型变构组药物治疗组只数8 8 8 8 8 8前额叶皮质PDE4A 0.38±0.08 0.96±0.13①0.51±0.11②0.16±0.04①②0.20±0.06 0.29±0.06②PDE4D 0.40±0.14 0.89±0.20①0.42±0.12②0.25±0.09②0.36±0.10②0.57±0.13②海马PDE4A 0.31±0.12 0.29±0.08 0.27±0.07 0.11±0.05①②0.27±0.11 0.36±0.15 PDE4D 0.27±0.10 0.35±0.14 0.29±0.09 0.23±0.06 0.26±0.05 0.28±0.08
3 讨论
精神分裂症是一种严重的精神疾病,其症状主要分为3类:阳性(妄想等)、阴性(缺乏社交和动机等)和认知(学习和注意缺陷)症状。目前主要采用的典型和非典型抗精神病药物治疗精神分裂症[9]。但研究发现,非典型药物在治疗阴性和认知症状方面效果不如典型抗精神病药物[10],患者还可能出现粒细胞缺乏症和代谢综合症等副作用。而长期使用典型抗精神病药也会导致严重的锥体外系副作用。因此,探寻治疗精神分裂症的新方法及新药物对治疗极具价值。
精神分裂症的病理生理学假说中被广泛接受的是谷氨酸能亢进假说。皮质脑干途径中的谷氨酸能N-甲基-D-天冬氨酸受体(N-methyl-D-aspartic acid receptor,NMDAR)功能降低会导致精神分裂症症状[9]。NMDAR拮抗剂(如MK-801)可导致啮齿动物的精神分裂症样行为和神经生物学变化[11]。本研究采用MK-801建立慢性精神分裂症大鼠模型,结果显示,MK-801可有效降低大鼠的跟随行为和总交互作用,增加大鼠的回避行为,大鼠出现社会交互行为缺陷,即神经分裂症样行为缺陷。
α7 nAChR功能障碍与精神分裂症行为缺陷密切相关[1,2]。α7 nAChR激动剂是治疗精神分裂症的新颖且有前途的药物[12],但临床疗效仍不确定。另一种改善α7 nAChR功能的方法是其正变构调节剂,其似乎也是治疗精神分裂症的有潜力的新方法。本研究表明,激动剂在改善精神分裂症大鼠社交行为缺陷方面比正变构调节剂更有优势。这种差异不是很容易解释,已知激动剂和正变构调节剂的主要区别之一是单独的激动剂可以在受体上产生应答,而正变构调节剂仅可以增加激动剂的现有应答[6,7]。另外,α7 nAChR激动剂可引起突触前神经元释放内源性乙酰胆碱[4]。尽管本研究尚未研究与社会行为相关的大脑组织中乙酰胆碱(nAChR天然激动剂)的水平,但我们的数据显示,单独使用正变构调节剂时,由于内源性激动剂的缺乏,导致正变构调节剂的疗效受限,而外源性激动剂可能更好地弥补了内源性激动剂数量减少的这种情况。
目前关于α7 nAChR激动剂和正变构调节剂对胞内第二信使系统(如脑中的cAMP系统)功效的了解有限。基于此,本研究主要阐明它们是否能够克服MK-801对细胞内主要运输途径(包括cAMP及其上游调节剂PDE4A和PDE4D途径)的损伤作用。研究表明,PNU-120596可增加参与学习与记忆相关的cAMP反应元件结合蛋白(CREB)的磷酸化[16]。本研究结果显示,MK801可显著增加前额叶皮质中PDE4A和PDE4D的表达,这被α7nAChR激动剂、正变构调节剂和氯氮平所逆转。但是,这些影响在海马中并未出现(除了CCMI)。MK-801也可显著降低前额叶皮质中cAMP水平,而在海马中则没有变化。此外,MK-801诱导海马和前额叶皮质中α7 nAChR蛋白表达下调,而α7nAChR激动剂、正变构调节剂和氯氮平均可逆转增加海马和前额叶皮质中α7 nAChR的蛋白表达。报道已表明,α7 nAChR激动剂而非正变构调节剂可诱导细胞中的受体表达上调[17]。原因可能为细胞对阴阳离子平衡的一种保护作用,α7 nAChR激动剂由于阻止了过多的正离子进入细胞而引起受体快速脱敏,但细胞可能需要招募更多新的受体来进行下一次生理刺激,因此导致α7 nAChR上调。而正变构调节剂不会引起受体上调,是因为它们在生理情况下不会使α7 nAChR脱敏[18]。已有研究显示I型正变构调节剂不抑制激动剂诱导的受体上调,因为其对脱敏动力学没有影响;而II型正变构调节剂抑制它,是因为其可使α 7 nAChR重新敏化并且不需要再上调受体表达[17]。在本研究中,脑中α7 nAChR表达的结果与先前报道不同。本研究中,MK-801给药的大鼠,激动剂、正变构调节剂和氯氮平均对α7 nAChR有上调作用,这可能是它们对MK-801诱导的脑损伤的逆转作用。
本研究还有不足之处,I型与II型正变构调节剂是否在体内的功效、安全性和耐受性等方面有差异,正变构调节剂在体内是否还具有其他优势,都需要进一步的实验研究。但本研究结果提示α7 nAChR在精神分裂症的细胞内分子机制可能与cAMP/PDE4通路有一定的关系,值得继续研究。
综上所述,α7 nAChR激动剂和正变构调节剂对精神分裂症样的社会缺陷有一定的改善作用,其分子机制可能与PDE-4/cAMP通路有一定的关,确切的结论尚需进一步研究。

