HPLC-MS/MS法测定血液病患者血浆中伊布替尼血药浓度的方法学研究及临床应用
位 宁,郭进艳,孙文利,王 磊*
(1 漯河市中医院药学部,漯河 462000;2 河北燕达陆道培医院检验医学科,廊坊 065201)
伊布替尼(ibrutinib)是一种高效、高选择性的口服小分子布鲁顿酪氨酸激酶(Brutons tyrosine kinase,BTK)抑制剂,通过选择性地共价结合靶蛋白BTK活性中心的半胱氨酸残基(Cys-481)结合位点,不可逆地抑制BTK活性和抑制B细胞抗原受体通路的激活,从而有效地阻止肿瘤细胞从B细胞转移到适合肿瘤生长的淋巴组织[1]。伊布替尼用于治疗套细胞淋巴瘤和慢性淋巴细胞白血病[2];口服吸收迅速,与血浆蛋白可逆性结合率为97.3%,达峰时间为 1~2 h,进餐时的血药浓度是空腹服药时的2~4倍;主要通过肝脏CYP3A代谢,消除半衰期 4~6 h,主要以代谢物形式通过粪便排出体外[3]。研究证明[4-5],伊布替尼药动学个体差异大,且与强CYP3A抑制剂或强CYP3A诱导剂同时服用时,其暴露量将会受到影响[血药浓度时间下面积(area under the curve,AUC)增加或减少10~20倍]。患者在治疗过程中易出现出血、高血压等不良反应或者疗效不佳甚至治疗失败。临床医生在考虑患者依从性差、药物相互作用等可能的原因之外,还应考虑标准剂量是否为该患者的最佳治疗剂量,是否实现了伊布替尼治疗效益最大化。这就需要通过检测血药浓度来判断患者体内真实的药物浓度,从而对患者进行个体化治疗,减少不良反应[5]。国外文献报道了伊布替尼血药浓度测定的HPLC-MS/MS法[6-8],国内目前尚无关于血液病患者伊布替尼血药浓度检测方法的报道。因此,本研究旨在建立测定血液病患者血浆中伊布替尼血药浓度的HPLC-MS/MS法,并对此方法进行方法学验证,确保建立的HPLC-MS/MS法可用于临床常规监测伊布替尼血药浓度,为伊布替尼的个体化用药剂量调整提供可靠依据。
1 材料与方法
1.1 一般资料
1.1.1仪器
岛津LC-20A液相色谱串联AB Sciex 4000 QTRAP型三重四极杆质谱仪(美国AB SCIEX公司);分析方法软件为Analyst®MD 1.5.2。
1.1.2试药
伊布替尼标准品(批号:1-JMO-111-1,Toronto Research Chemicals公司);伊布替尼-d5标准品(批号:ZZS18062702,Toronto Research Chemicals公司);伊布替尼胶囊(Pharmacyclics LLC,国药准字H20170350,规格140 mg);甲醇(色谱纯,美国Fisher公司);甲酸(色谱纯,北京迈瑞达科技有限公司);乙酸铵(分析纯,北京迈瑞达科技有限公司);屈臣氏蒸馏水(广州屈臣氏蒸馏水有限公司)。
1.1.3基质及临床样本
空白血浆基质为新鲜小牛血清(北京百奥莱博科技有限公司)。收集本院5例服用伊布替尼的慢性淋巴细胞白血病患者的血液样本,服药剂量均为560 mg,qd,于给药后2 h抽血检测。
1.2 方法
1.2.1色谱条件
Ultimate XB-C18色谱柱(50 mm×4.6 mm,5 μm),柱温60 ℃,流动相为含2 mmol/L乙酸铵+0.1%甲酸的水溶液(A)与含0.1%甲酸的甲醇溶液(B),流速0.8 ml/min。梯度洗脱:0.0~0.5 min,95%B~25%B;0.5~2.0 min,25%B;2.0~2.5 min,25%B~95%B;2.5~3.0 min,95%B。进样量为1 μl。
1.2.2质谱条件
在电喷雾正离子(ESI+)模式下,以多离子反应监测(MRM)方式进行检测。离子源参数:离子喷射电压5500 V,离子源温度550 ℃,喷雾气55 psi,辅助加热气55 psi,气帘气25 psi,碰撞气medium。同时监测伊布替尼m/z441.3~138.1(定量离子),伊布替尼m/z441.2~304.1(定性离子);伊布替尼-d5m/z446.2~138.1。质谱条件见表1;伊布替尼和伊布替尼-d5的碎片离子质谱图见图1。

表1 质谱条件
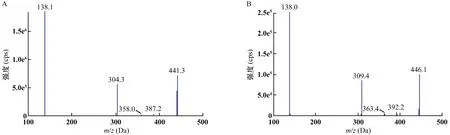
A:伊布替尼;B:伊布替尼-d5图1 伊布替尼与伊布替尼-d5的二级质谱图
1.2.3溶液的配制
1.2.3.1 储备液的配制
精密称取伊布替尼标准品5.000 mg,用甲醇溶解,多次洗涤,依次转移至10 ml量瓶中,再用甲醇定容,配制成浓度为0.5 mg/ml的储备液。同样精密称取伊布替尼-d5标准品1.000 mg,用甲醇溶解,配制成浓度为0.1 mg/ml的储备液,分装,备用。
1.2.3.2 校准溶液与内标溶液的配制
取0.5 mg/ml的伊布替尼储备液,用甲醇稀释成浓度为0.1、0.2、1.0、2.0、10.0、20.0 μg/ml的伊布替尼系列校准溶液。然后取伊布替尼-d5储备液,用甲醇稀释,制得浓度为0.25 μg/ml的伊布替尼-d5内标溶液,可沉淀血浆蛋白,作为样本前处理液使用。
1.2.4样本处理
取患者外周血样本3500 r/min离心7 min,取100 μl血浆上清液于1.5 ml离心管中,加入100 μl含0.1%甲酸+2 mmol/L乙酸铵的水溶液,再加入300 μl伊布替尼-d5内标溶液,最后加入500 μl甲醇,涡旋60 s,充分混匀,13 000 r/min离心8 min。移取170 μl上清液于进样瓶中,进样1 μl。
1.2.5方法学验证[9-14]
1.2.5.1 特异性考察
取屈臣氏蒸馏水直接进样,检测,得色谱图A。再取空白血浆100 μl,除不加内标外,其余按照“1.2.4”项进行处理,进样1 μl,得色谱图B。将一定浓度的伊布替尼标准溶液和伊布替尼-d5内标溶液加入空白血浆中,除不加内标外,其余按照“1.2.4”项进行处理,进样1 μl,得色谱图C。取受试者口服伊布替尼胶囊后的血浆样品,按照“1.2.4”项进行处理,进样1 μl,得色谱图D。比较色谱图A、B、C、D,查看色谱峰保留时间,得出空白血浆中的内源性物质是否干扰伊布替尼和伊布替尼-d5的检测。
1.2.5.2 残留验证
取浓度为20 μg/ml的伊布替尼标准溶液和空白屈臣氏蒸馏水样品,按照“1.2.4”项进行处理,依次进样检测。
1.2.5.3 基质效应评价
通过评价目标化合物在血浆基质和无血浆基质中的信号值来评价基质效应。选取3个浓度(0.3、3.0、15.0 μg/ml)水平校准液分别置于空白血浆和水中,按“1.2.4”项进行处理,通过血浆中目标化合物(内标)的信号强度与水中目标化合物(内标)的信号强度来计算内标归一化的基质因子,进而评价基质效应,计算公式参照《中国药典》2020年版[10]。
1.2.5.4 标准曲线和定量限
取10 μl浓度为0.1、0.2、1.0、2.0、10.0、20.0 μg/ml的伊布替尼系列校准溶液分别加入1.5 ml离心管中,再平行加入90 μl空白血浆,按照“1.2.4”项进行处理。经HPLC-MS/MS分析。以伊布替尼与内标伊布替尼-d5峰面积之比作为纵坐标(y),以血浆伊布替尼浓度作为横坐标(x),采用加权(W=1/x2)最小二乘法进行回归和线性拟合。连续测3天,每天1条标准曲线。通过评价3条标准曲线,计算线性回归的相关系数r2,要求r2≥0.9900。以S/N=10,计算定量限。
1.2.5.5 精密度
取空白血浆,分别加入一定体积的伊布替尼储备液,制备高、中、低(1.50、0.30、0.03 μg/ml)3种浓度的质量控制(QC)样品,按“1.2.4”项进行处理。每一浓度进行6个样本分析,连续测定3天。根据当天的标准曲线,计算QC样品的测定浓度,根据QC样品的测定浓度计算精密度,要求变异系数(CV)<15%。
1.2.5.6 回收率
取空白血浆,制备高、中、低(1.50、0.30、0.03 μg/ml)3种浓度的QC血浆样品,各6份。按“1.2.4”项进行处理,经HPLC-MS/MS分析,得到分析物伊布替尼及内标伊布替尼-d5峰面积之比A1。另取空白血浆,经蛋白沉降处理得血浆上清液,制备高、中、低(1.50、0.30、0.03 μg/ml)3种浓度的QC血浆上清液样品,各6份。按“1.2.4”项进行处理,经HPLC-MS/MS分析,得到分析物伊布替尼及内标伊布替尼-d5峰面积之比A2。以A1/A2比值计算回收率。
1.2.5.7 稳定性试验
配制伊布替尼高、中、低(1.50、0.30、0.03 μg/ml) 3种浓度的血浆样品,按“1.2.4”项进行处理,每个浓度3个样品,考察其在室温放置24 h、4 ℃冰箱放置24 h、24 h内反复冻融3次的稳定性。
1.3 统计学方法
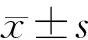
2 结果
2.1 特异性考察
由图2可见,伊布替尼保留时间为2.06 min,伊布替尼-d5保留时间为2.06 min,二者色谱行为一致。说明伊布替尼-d5作为伊布替尼的内标较为合适;亦表明血浆中内源性物质不干扰伊布替尼和内标伊布替尼-d5的测定,专属性良好。
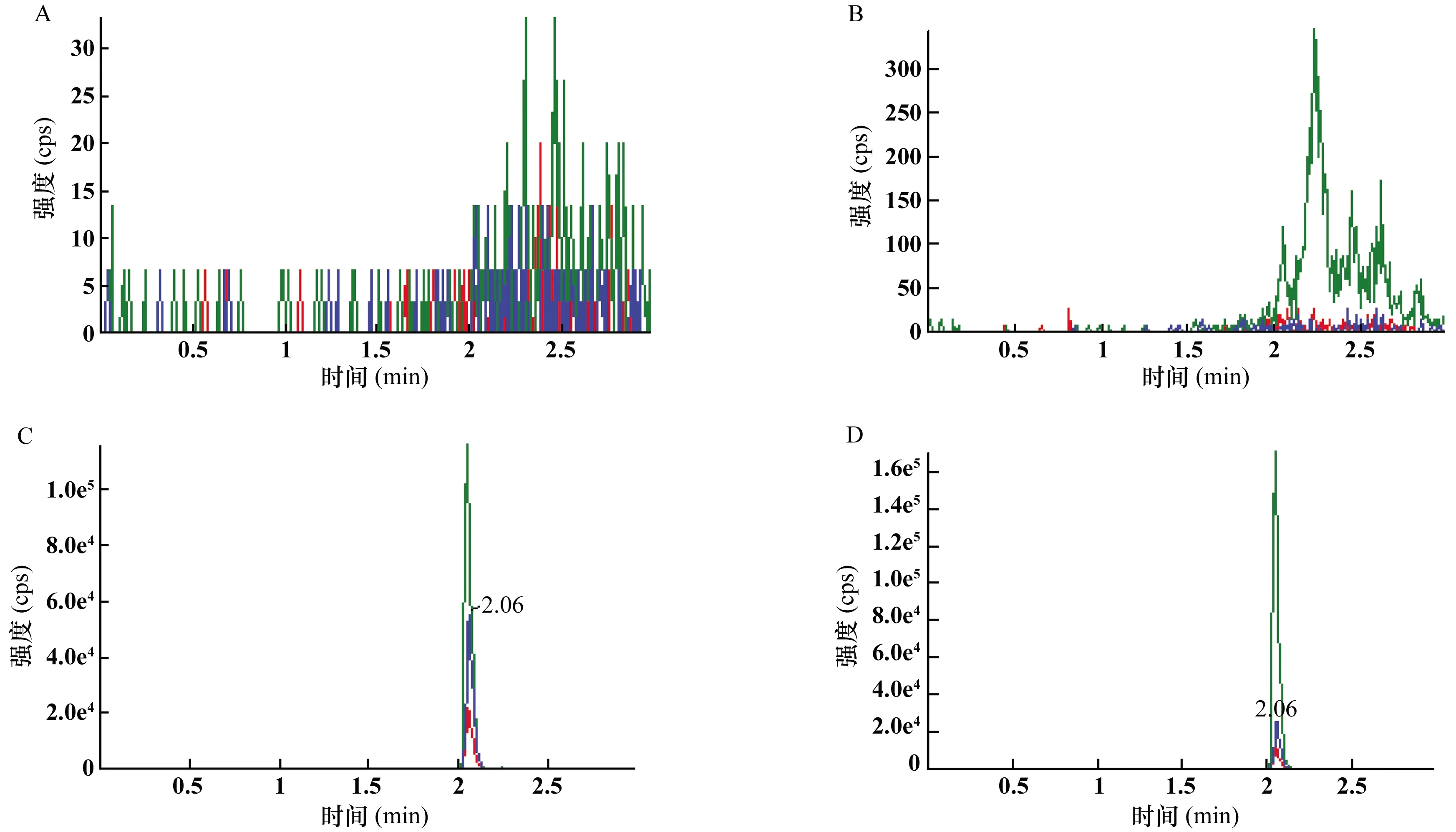
A:空白水;B:空白血浆;C:空白血浆+伊布替尼+伊布替尼-d5;D:患者血浆+伊布替尼-d5图2 空白水、空白血浆、伊布替尼和伊布替尼-d5色谱图
2.2 残留验证
高浓度样品后伊布替尼的第一个空白样品的残留为15.60%,第二个空白样品的残留为4.30%,均小于分析物定量下限20%;高浓度样品后伊布替尼-d5的第一个空白样品的残留为0.10%,第二个空白样品的残留为0.07%,低于内标峰面积的5%。见表2。

表2 伊布替尼残留实验结果
2.3 基质效应评价
有血浆和无血浆基质中不同加标浓度伊布替尼的内标归一化基质因子在0.99~1.02之间,CV在1.57%~3.67%之间,小于15%,符合《中国药典》2020年版[10]要求。见表3。
2.4 标准曲线和定量限
采用内标法进行定量分析,得到直线方程y=0.004 64x+0.004 42,r2=0.9997。表明伊布替尼在10~2000 ng/ml内线性关系良好,最低定量限为1.65 ng/ml。见表4。

表4 伊布替尼标准曲线结果
2.5 精密度
伊布替尼日内RSD为2.84%~5.41%,日间RSD为4.89%~5.19%,二者均小于15%。表明精密度好,数据较集中。见表5。
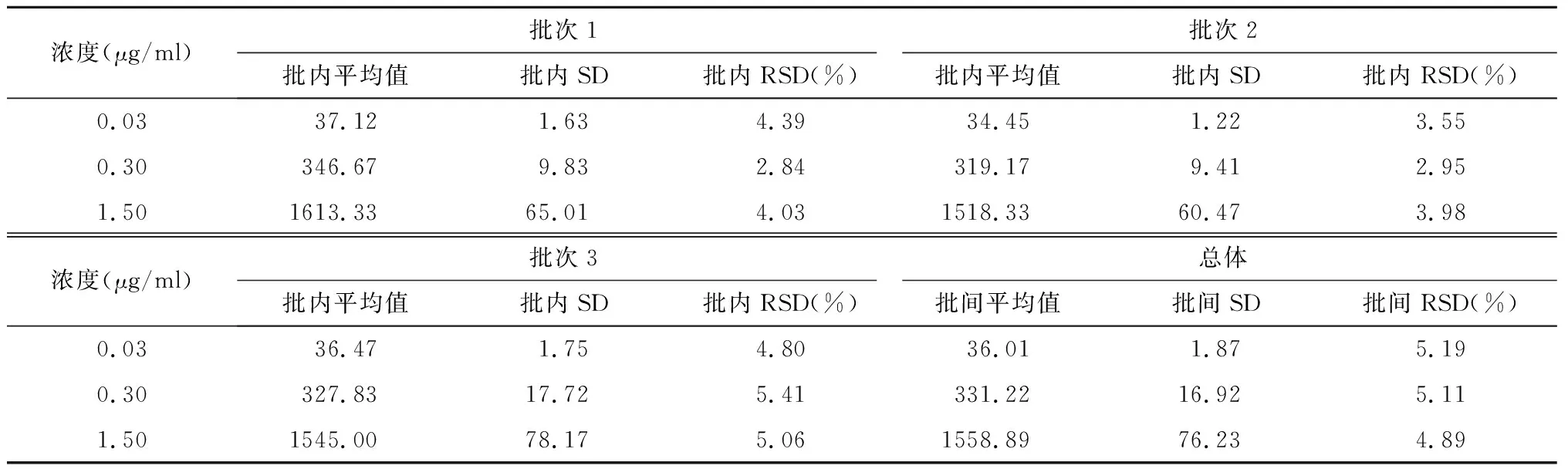
表5 伊布替尼精密度测定结果 n=6
2.6 回收率
通过计算A1/A2比值,得到回收率为101.31%~102.54%,位于85%~115%之间,准确度较高。见表6。
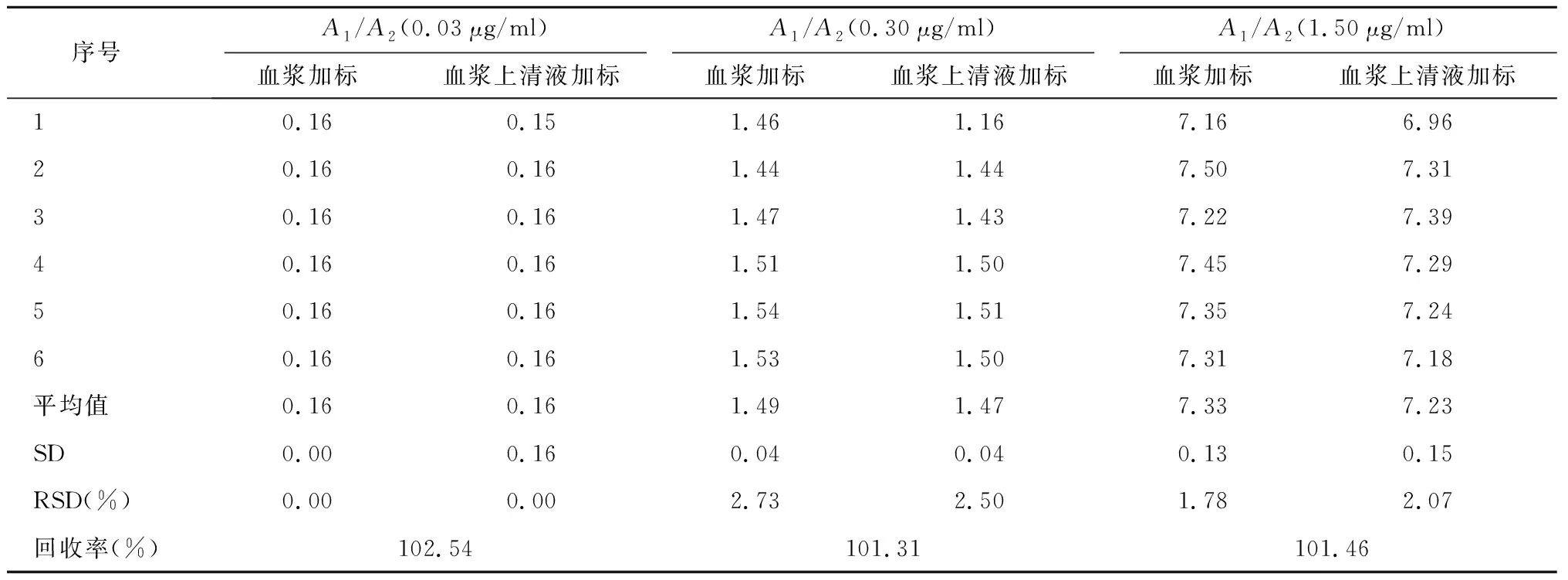
表6 伊布替尼回收率测定结果 n=6
2.7 稳定性试验
在相应考察的稳定性条件下,对结果数据进行单因素方差分析,伊布替尼稳定性数据RSD 0.38%~2.93%,小于15%。表明伊布替尼样品较为稳定,在血中稳定性好,可进行临床常规血药浓度检测。见表7。
表7 伊布替尼稳定性结果
2.8 临床应用
应用上述建立的检测伊布替尼血药浓度的HPLC-MS/MS法,对5例患者伊布替尼血药浓度进行检测。结果为:13.2、3.07、7.7、13.3、254 ng/ml,可见服用同一剂量的不同患者的伊布替尼血药浓度不同,且前4例患者结果都低于正常值37.1 ng/ml[4]。最后1例患者浓度明显偏高。经询问,该患者服用了伏立康唑作为抗感染预防用药。伏立康唑为CYP3A4抑制剂,导致伊布替尼血药浓度偏高[5]。
3 讨论
HPLC-MS/MS可在较短时间内完成待测物的检测,且具有良好的灵敏度和特异性,成为各种药物体外研究和体内分析的首选方法[9]。在伊布替尼的临床前和临床研究过程中,对生物基质中药物的定量研究是非常有必要的。Veeraraghavan等[6]在2015年采用甲苯磺丁脲作为内标,同时监测大鼠血清中来那度胺、伊布替尼及其代谢产物。由于选用色谱柱较长,导致出峰时间延长,检测耗时;选用乙腈作为洗脱剂,提取回收率为75.2%。Beauvais等[7]在2018年建立了同时检测脑脊液中伊布替尼及其代谢产物的UHPLC-MS/MS法,采用乙腈-水进行梯度洗脱,色谱柱短,出峰时间快,但其线性范围较窄。Sun等[8]在2019年采用UPLC-ESI-MS/MS法检测套细胞淋巴瘤大鼠血浆中伊布替尼浓度,采用维拉佐酮作为内标,其出峰时间(0.73 min)与伊布替尼出峰时间(0.51 min)不一致,明显延后,不利于临床样本(血清基质复杂、干扰物质种类多等)检测。
本研究建立的测定伊布替尼血药浓度的HPLC-MS/MS法,采用同位素伊布替尼-d5作为内标,能一定程度降低生物基质对伊布替尼含量测定的影响。以甲酸-乙酸铵作为缓冲盐,甲醇-水梯度洗脱,基质无干扰,出峰时间早,峰型好,且前处理简单,回收率及精密度和稳定性均较好,线性范围适宜,可用于临床常规伊布替尼血药浓度测定。但在实验过程中,QC低浓度点准确度和方法回收率虽然符合《中国药典》2020年版规定范围,但相对偏高,可能与伊布替尼离子对选择有关。
在对伊布替尼离子+NH3、+Na、+K峰进行优化时,发现其子离子不稳定或者子离子峰响应低,不能作为常规检测离子选用。对洗脱梯度和溶剂及色谱柱进行考察,亦发现不能消除此种现象。故选择本实验室常用色谱系统对伊布替尼血药浓度进行临床常规检测[15]。本研究建立的测定人血浆中伊布替尼血药浓度的HPLC-MS/MS法,可以常规测定伊布替尼血药浓度,为伊布替尼的个体化合理用药提供支持。由于价格原因,本院目前服用伊布替尼的患者少,伊布替尼血药浓度与临床疗效的研究还需后续临床病例的增加而逐步开展。

