不同部位来源的耐碳青霉烯类肠杆菌目细菌检出情况及耐药性分析
张鸿娟,单 斌,孟雪斐,宋贵波,苏艳丹*
(1 昆明医科大学第一附属医院医学检验科,昆明 650032;2 云南省医学检验临床研究中心,昆明 650032;3 昆明医科大学第一附属医院临床检验诊断省创新团队,昆明 650032)
细菌耐药已严重威胁全球公共健康领域,其中耐碳青霉烯类肠杆菌目细菌(carbapenem-resistant Enterobacterales,CRE)引起的感染形势最为严峻。美国疾病预防控制中心对CRE的定义[1]:满足以下任意一个条件的肠杆菌目细菌即定义为CRE。① 对亚胺培南、美罗培南、厄他培南或多利培南任何一种碳青霉烯类抗菌药物耐药者。天然对亚胺培南敏感性低的细菌(如摩根菌属、变形杆菌属和普罗威登菌属等),需参考除亚胺培南外的其他碳青霉烯类抗菌药物的药敏结果。② 产生碳青霉烯酶。不同国家、地区、医院、人群以及细菌所产的碳青霉烯酶种类均有差异[2-3]。本研究对不同部位来源的CRE进行分类统计,探讨不同部位来源的CRE检出情况及耐药性,供临床参考。
1 材料与方法
1.1 细菌来源
菌株来源于2018~2020年本院门诊和住院患者送检的各部位样本,经临床微生物室进行分离、培养,药敏结果显示对任何一种碳青霉烯类抗菌药物不敏感,摩根菌属、变形杆菌属对亚胺培南以外的其他碳青霉烯类抗菌药物亦不敏感,剔除同一患者相同部位的重复菌株后纳入分析。按照不同部位来源[脑脊液、血液、体液(胸水、腹水、关节腔积液等)、尿液、痰液、其他(引流液、脓液、脓肿等)]进行分类统计。
1.2 药敏试验
试验方法包括纸片扩散法、自动化仪器法和 E-test 法等,结果判读参考当年美国临床实验室标准化协会(Clinical and Laboratory Standards Institute,CLSI)标准。药敏结果为敏感(S)、中介(I)和耐药(R),中介结果不展示。
1.3 数据分析
采用WHONET 5.6和SPSS 22.0分析处理结果,比较采用R×C表卡方检验,P<0.05表示有统计学差异。
1.4 质控菌株
质控菌株采用大肠埃希菌ATCC 25922、金黄色葡萄球菌ATCC 25923、表皮葡萄球菌ATCC 49134、肺炎克雷伯菌ATCC700603、阴沟肠杆菌ATCC700323、铜绿假单胞菌ATCC 27853、肺炎链球菌ATCC 49619、粪肠球菌ATCC 29212、屎肠球菌ATCC 35667,每周进行一次质控。
2 结果
2.1 菌株分布
2.1.1总体分布
2018~2020年共检出肠杆菌目细菌11 389株,2018年3492株、2019年3982株、2020年3915株。检出CRE 1690株,2018年657株、2019年555株、2020年478株。检出的CRE占肠杆菌目细菌的比例为2018年18.81%、2019年13.94%、2020年12.21%。CRE占肠杆菌目细菌的比例呈逐年下降趋势。
2.1.2菌株的构成
2018~2020年CRE菌株排名前3位的均是肺炎克雷伯菌、大肠埃希菌、阴沟肠杆菌,共检出肺炎克雷伯菌1452株(占85.92%)、大肠埃希菌94株(占5.56%)、阴沟肠杆菌56株(占3.31%),黏质沙雷菌、弗氏柠檬酸杆菌等偶有检出。CRE的菌株构成见表1。
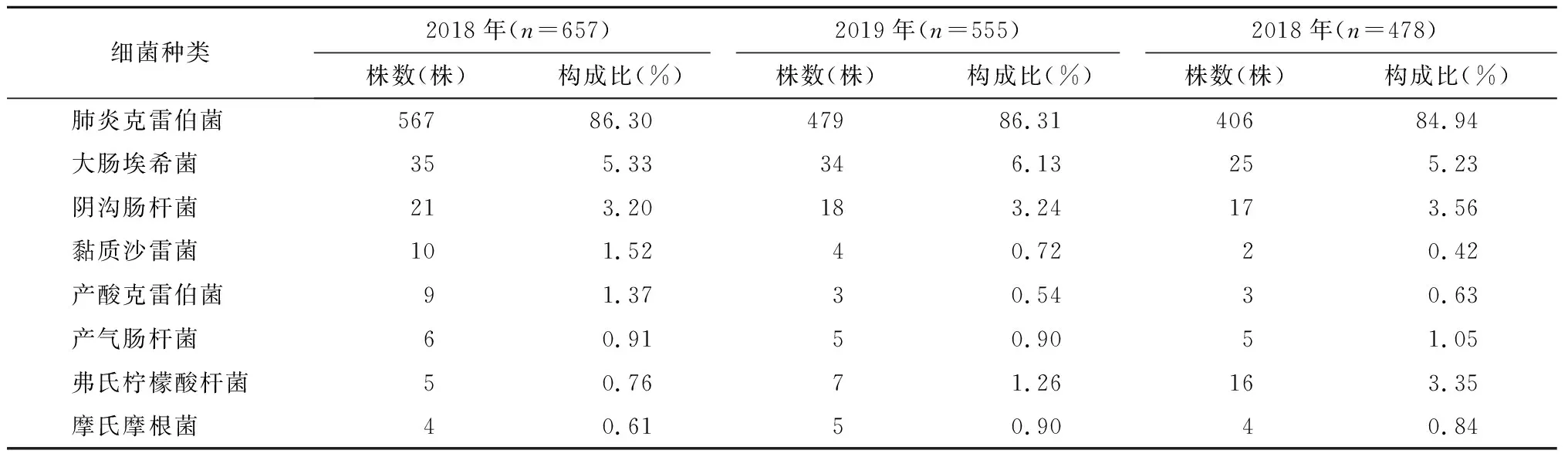
表1 2018~2020年CRE的构成情况
2.1.3不同部位来源的CRE检出情况
不同部位来源的肠杆菌目细菌的检出排名前3位的均是肺炎克雷伯菌、大肠埃希菌、阴沟肠杆菌。其中,阴沟肠杆菌排名均为第3位,肺炎克雷伯菌与大肠埃希菌标本来源不同排名有差异。尿液中分离出的大肠埃希菌最多,与其他部位分离的大肠埃希菌相比具有统计学差异(χ2=123.921,P=0.0001)。不同部位来源的肠杆菌目细菌检出情况见表2。不同部位来源的肠杆菌目细菌中CRE的占比不同。其中,脑脊液中CRE的占比最高,连续3年均超过30%,且呈增长趋势;尿液标本中CRE的占比最低,低于10%。不同部位来源的CRE占肠杆菌目细菌中的比例具有统计学差异(χ2=561.5646,P=0.0001)。见表3。
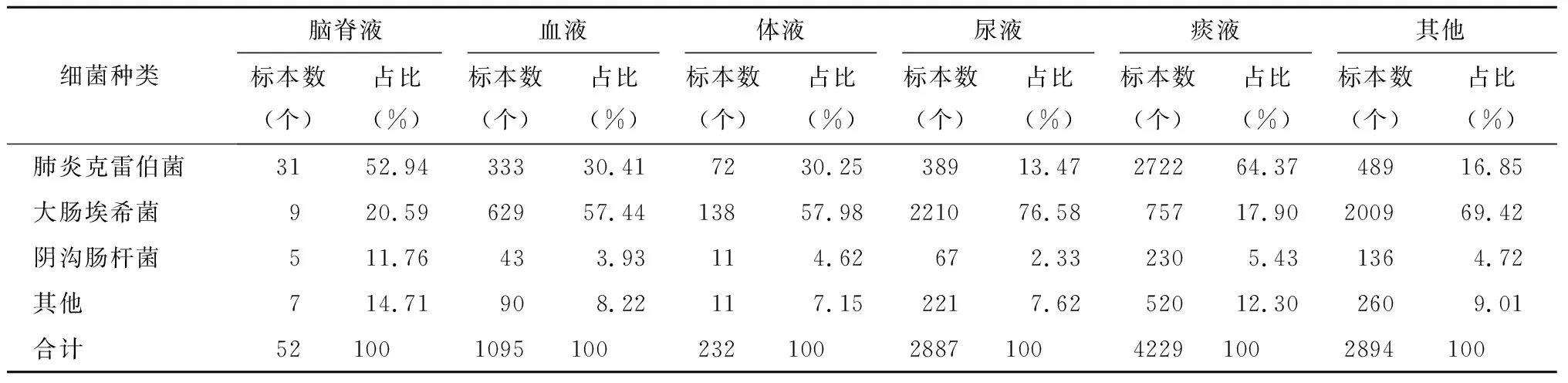
表2 不同部位来源的肠杆菌目细菌检出情况
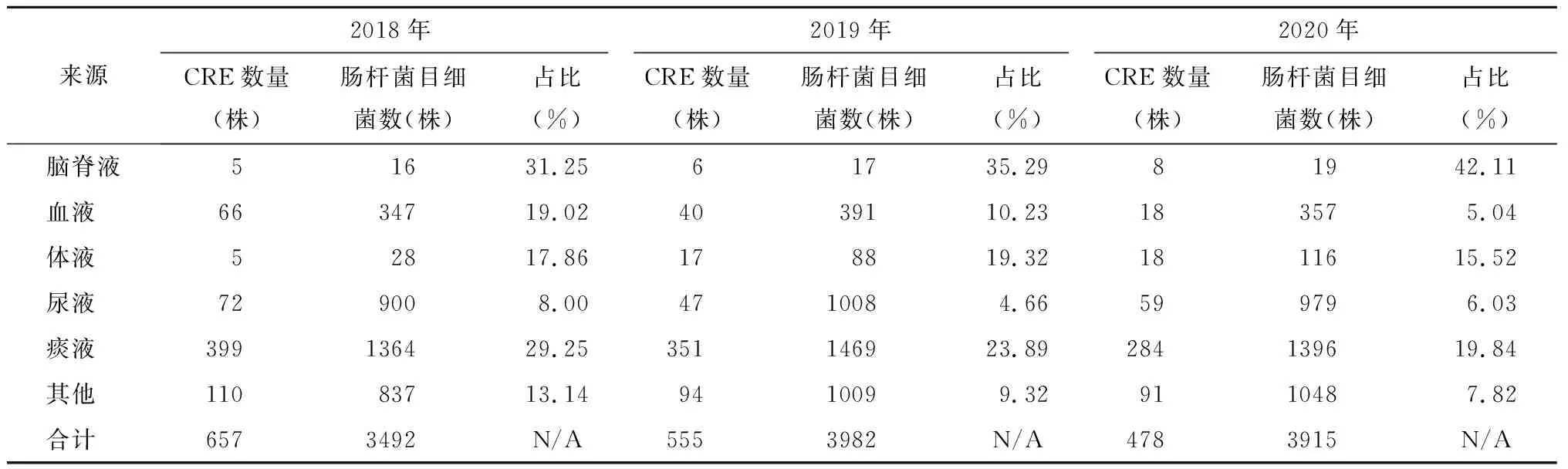
表3 不同部位来源的肠杆菌目细菌中CRE检出情况
2.2 药敏情况
2.2.1碳青霉烯类耐药肺炎克雷伯菌药敏情况
2018~2020年分离出碳青霉烯类耐药肺炎克雷伯菌共1452株。碳青霉烯类耐药肺炎克雷伯菌对碳青霉烯类抗菌药物的耐药率均>95%,除对阿米卡星、复方新诺明、磷霉素、四环素部分敏感外,对其他的抗菌药物几乎全部耐药。其中,不同部位来源分离的碳青霉烯类耐药肺炎克雷伯菌对复方新诺明的耐药率比较无统计学差异(χ2=9.8849,P=0.4506);对阿米卡星(χ2=34.5387,P=0.0001)、磷霉素(χ2=37.62,P=0.0001)、四环素(χ2=79.559,P=0.0001)的耐药率比较有统计学差异。未发现对替加环素耐药的菌株。见表4。
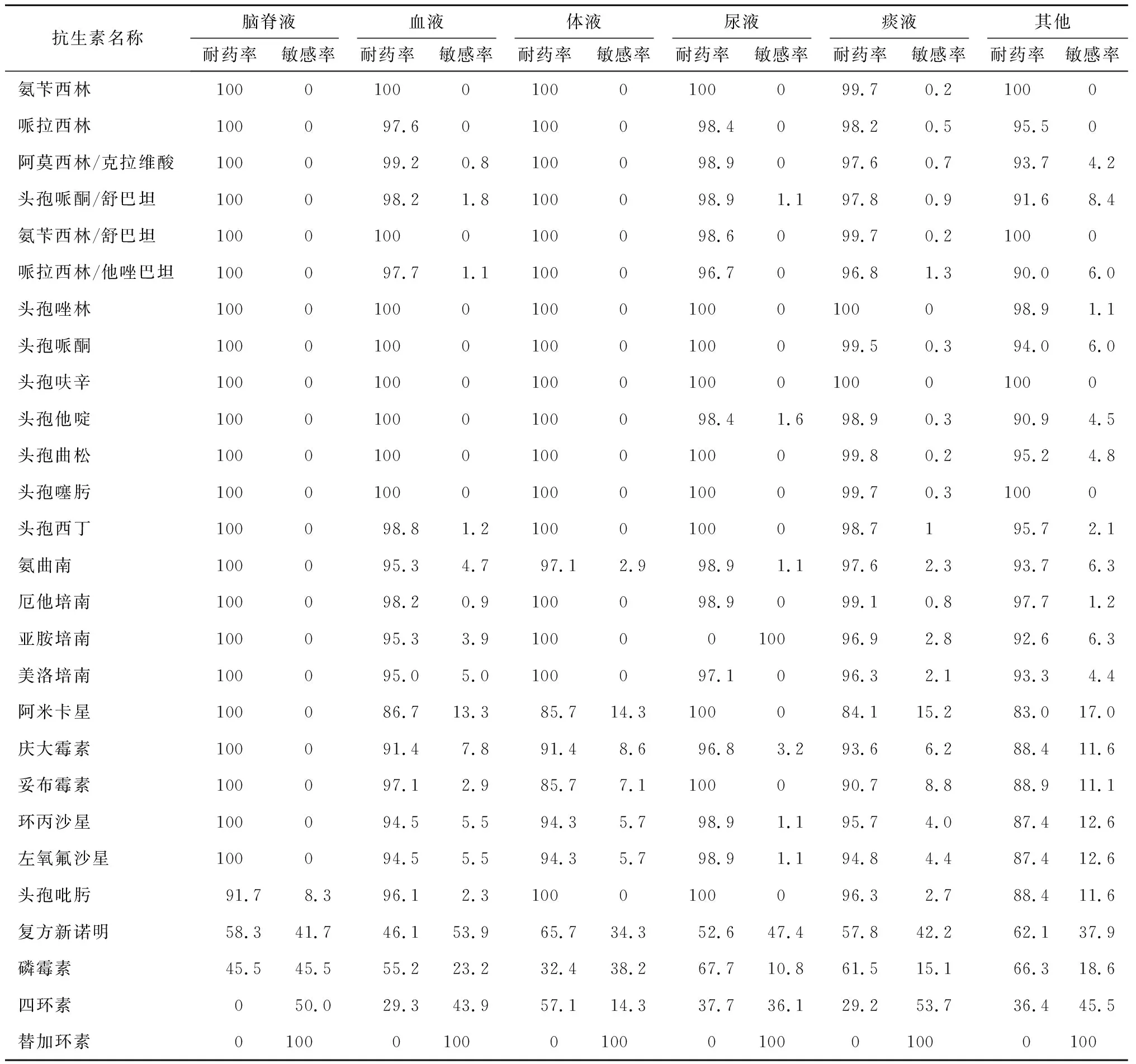
表4 碳青霉烯类耐药肺炎克雷伯菌药敏情况 %
2.2.2碳青霉烯类耐药大肠埃希菌药敏情况
2018~2020年分离出碳青霉烯类耐药大肠埃希菌共94株。其中,脑脊液中未分离出碳青霉烯类耐药大肠埃希菌;尿液中分离出的最多,为22株。碳青霉烯类耐药大肠埃希菌对碳青霉烯类抗菌药物的耐药率≥50.0%。痰液中分离出的大肠埃希菌耐药率最高,为91.7%;尿液中分离出的耐药率最低,为50.0%。对复方新诺明、庆大霉素、阿米卡星、磷霉素部分敏感,不同部位来源分离出的菌株对复方新诺明(χ2=41.3338,P=0.0001)、阿米卡星(χ2=26.5861,P=0.0008)、磷霉素(χ2=30.9682,P=0.0001)耐药率比较有统计学差异,对庆大霉素(χ2=10.813,P=0.2125)耐药率比较无统计学差异。未发现对替加环素耐药的菌株。见表5。
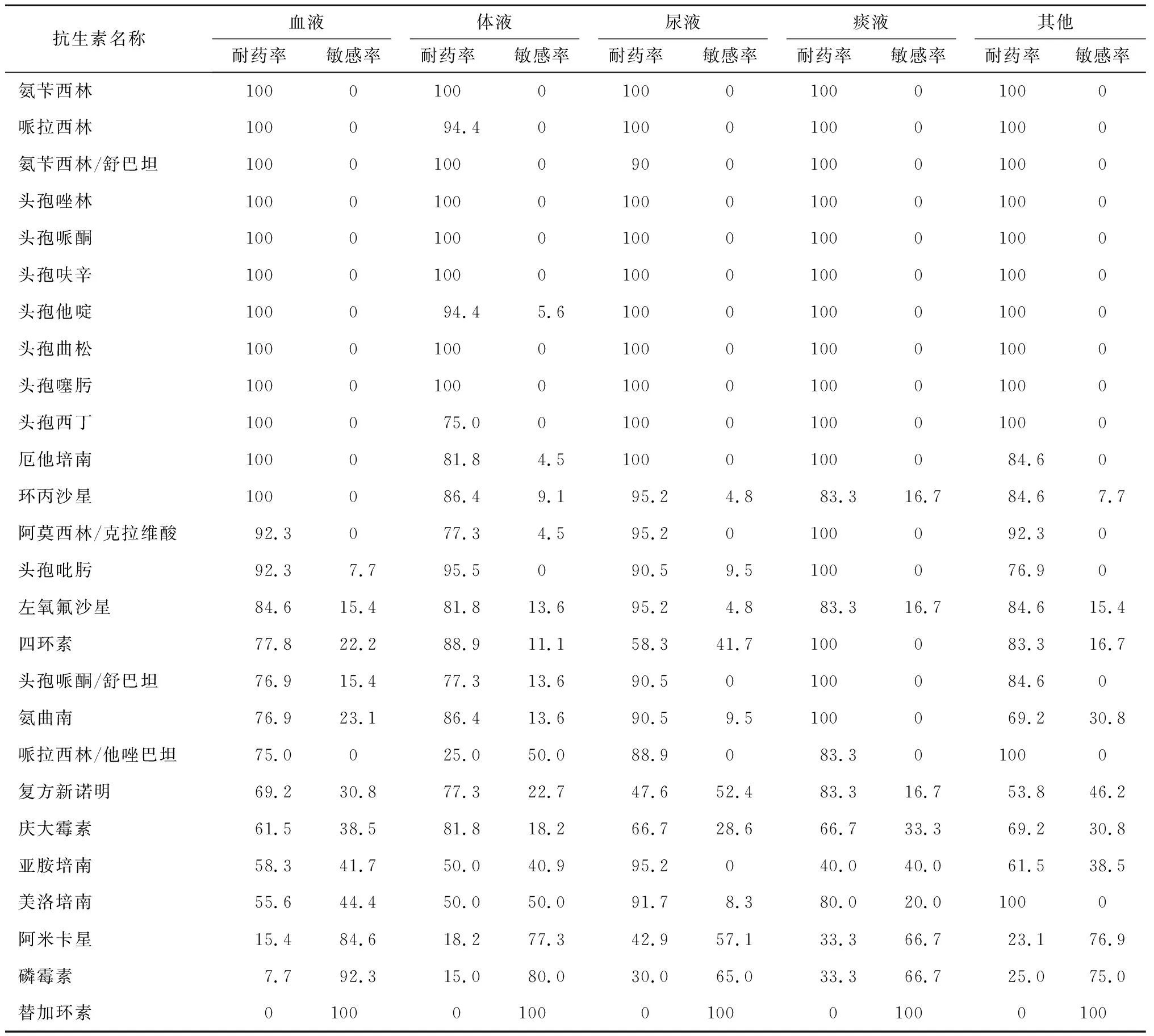
表5 碳青霉烯类耐药大肠埃希菌药敏情况 %
2.2.3碳青霉烯类耐药阴沟肠杆菌药敏情况
2018~2020年分离出碳青霉烯类耐药阴沟肠杆菌56株。其中,脑脊液中未分离出碳青霉烯类耐药阴沟肠杆菌,血液中分离出1株、体液中分离出2株。血液中分离出的碳青霉烯类耐药阴沟肠杆菌除对替加环素敏感外,对其他抗菌药物全部耐药。体液中分离出的碳青霉烯类耐药阴沟肠杆菌除对替加环素敏感外,1株对复方新诺明敏感,对其他抗菌药物全部耐药。尿液、痰液、其他部位分离出的碳青霉烯类耐药阴沟肠杆菌对碳青霉烯类抗菌药物的耐药率为25%~75%。其中,痰液中分离出的耐药率最低,尿液中分离出的耐药率最高,对庆大霉素、阿米卡星、磷霉素、妥布霉素有一定的敏感率。未发现对替加环素耐药的菌株。见表6。
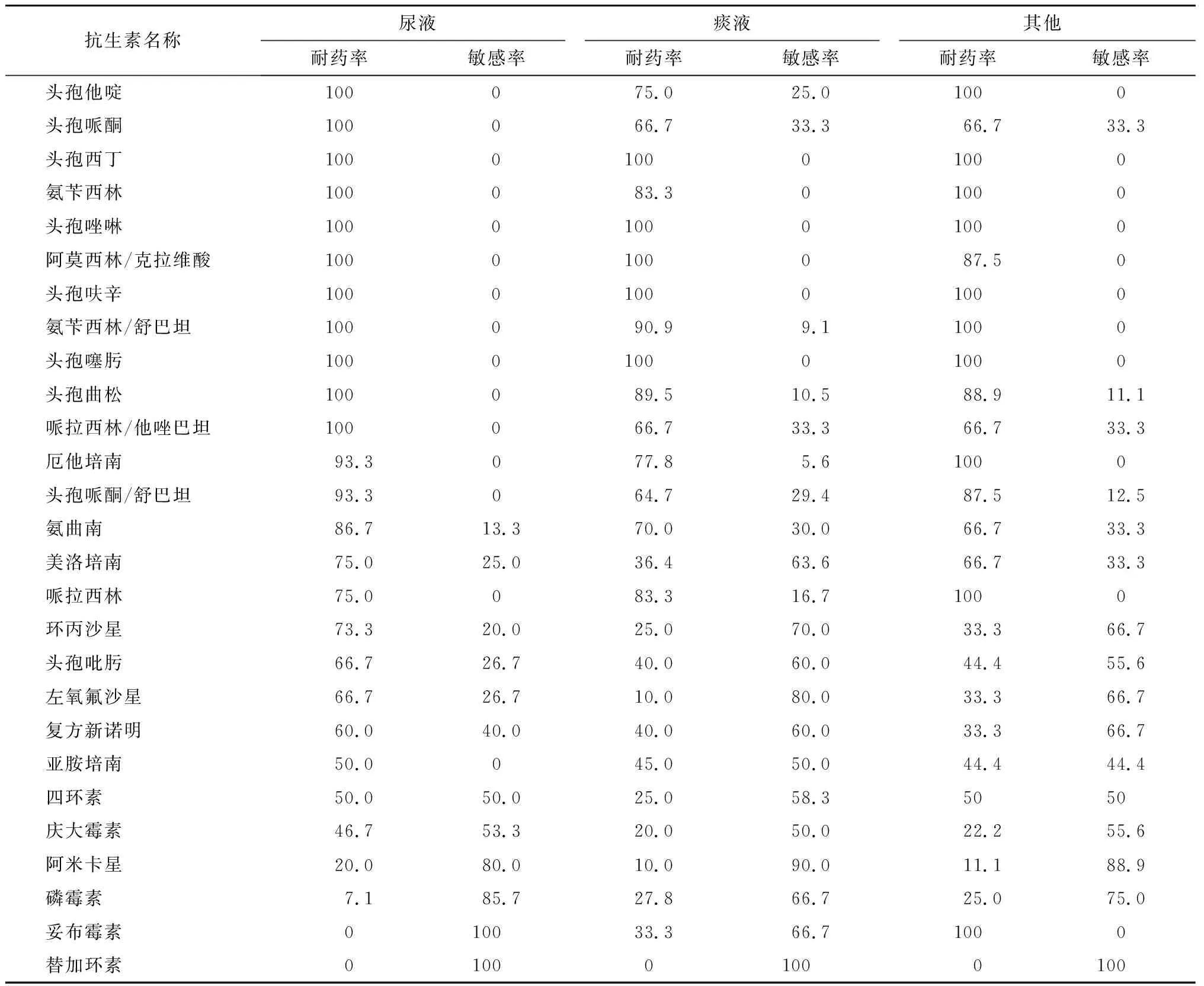
表6 碳青霉烯类耐药阴沟肠杆菌药敏情况 %
3 讨论
碳青霉烯类抗菌药物被认为是抗产超广谱β内酰胺酶菌株的最后一道防线[4]。近年来,随着碳青霉烯类抗菌药物的广泛使用,肠杆菌目细菌对其耐药率呈快速增长趋势。CHINET中国细菌耐药监测网显示,我国临床分离肺炎克雷伯菌对碳青霉烯类抗菌药物的耐药率从2005年的3%快速攀升至2019年的25%以上,上升幅度高达8倍[5]。临床分离出的CRE对抗菌药物呈广泛耐药甚至全耐药的特征[6],可以选择的抗菌药物有限,死亡率高。研究显示[7-8],CRE所致侵袭性感染(如血流感染)的死亡率可达40%~50%,甚至更高。早期合理使用抗菌药物能有效降低CRE感染导致的死亡率[9]。本研究对本院临床微生物室2018~2020年分离出的CRE按感染途径进行统计分析。结果显示,2018~2020年CRE中排名前3位的都是肺炎克雷伯菌、大肠埃希菌、阴沟肠杆菌,其中肺炎克雷伯菌与大肠埃希菌占比达90%以上,与CHINET中国细菌耐药监测网的结果一致[10-11]。随着临床对CRE认识的进一步提升,尤其是《遏制细菌耐药国家行动计划(2016—2020年)》推广后,在多部门的共同努力下,2018~2020年医院CRE的检出株数及CRE在肠杆菌目细菌中的占比持续下降。
主动筛查在CRE的防控中具有重要意义。本研究中,不同部位来源检出的CRE数量不同,CRE占同类标本中肠杆菌目细菌比例不同。其中,痰液中检出的CRE数量最多,脑脊液检出的肠杆菌目细菌中CRE占比最高,尿液中检出的CRE占比最低。脑脊液中检出的CRE高,与全国数据一致[12]。这可能与中枢神经系统的解剖结构相关,脑脊液中检出的全部是碳青霉烯类耐药肺炎克雷伯菌。痰液在临床分离细菌的标本来源中排名第一[10,13],痰液中有大量的细菌定植。CRE定植导致CRE感染率高达16.5%[13-14]。本研究中,所有脑脊液中检出CRE,同时段的痰液中均检出CRE,是否为同一菌株,还需要进一步分析。尿液中分离出肠杆菌目细菌中大肠埃希菌占比为76.55%,高于其他标本,而碳青霉烯类耐药大肠埃希菌的比例较低。因此,尿液中CRE的占比最低。主动筛查能及时发现定植患者,有助于及时采取感染防控措施,预防耐药菌的院内传播,降低患者死亡率[15-17],有条件的医院应根据本院CRE情况开展主动筛查。
不同细菌对抗菌药物的耐药率不同,CRE菌株除对碳青霉烯类抗菌药物耐药外,对其他抗菌药物呈广泛耐药,仅对阿米卡星、复方新诺明、磷霉素、四环素部分敏感。碳青霉烯类耐药大肠埃希菌对碳青霉烯类抗菌药物的耐药率低于碳青霉烯类耐药肺炎克雷伯菌;对复方新诺明、庆大霉素、阿米卡星、磷霉素部分敏感,对同类药物的耐药率低于碳青霉烯类耐药肺炎克雷伯菌。在不同部位来源的肠杆菌目细菌的检出中,碳青霉烯类耐药阴沟肠杆菌均为第3名,占比约为3%,有上升的趋势。目前对碳青霉烯类耐药阴沟肠杆菌的研究较少,但是有研究表明[18],碳青霉烯类耐药阴沟肠杆菌虽然为低毒细菌,但其耐药模式、耐药基因、多位点序列分型呈现异质性,应采取有效的感染预防措施,减少碳青霉烯类耐药大肠埃希菌的传播。
传统临床微生物室的工作模式为细菌的鉴定和药敏试验同步进行,2种结果反馈给临床的时间间隔不长。近年来,随着基质辅助激光解析电离飞行时间质谱(MALDI-TOF MS)、分子生物学技术、宏基因组学第二代测序(以下简称二代测序)等技术的快速发展,微生物的鉴定速度快速提升。常悦等[19]通过多重聚合酶链式反应(PCR)与MALDI-TOF MS联用,建立了一套可以快速、准确地鉴定引起血流感染的7种常见病原菌检测方法。该方法不仅可以缩短细菌的鉴定时间,还可检测多重细菌混合感染,弥补混合感染漏检可能。使用Xpert Carba-R Assay检测系统可以在呼吸道感染时,直接对痰液中的CRE耐药基因进行鉴定[20]。使用MALDI-TOF MS技术对尿路感染的致病菌进行诊断[21]。二代测序可以检测到其他传统方法无法检测到的病原体[22]。从传统培养转向分子生物学诊断,不仅对临床微生物室是一个挑战,对临床抗感染治疗也是挑战,临床经验用药显得尤为重要。中枢神经系统感染具有起病急、病程长、难治愈、死亡率高等特点。其中,医院获得性感染患者脑脊液分离常见病原菌是革兰阴性杆菌[22]。本研究中,脑脊液中肠杆菌目细菌均为肺炎克雷伯菌,其中碳青霉烯类耐药肺炎克雷伯菌占比高于30%。采用传统的脑脊液培养方法阳性率较低,一般低于40%[23-24]。因此,对于脑脊液培养结果为阴性,但是二代测序等方法检出肺炎克雷伯菌时,应进行CRE感染高危因素评估[25]。如果存在长期住院、入住重症加强护理病房(ICU)、碳青霉烯类抗菌药物暴露史等危险因素时,应尽早开始CRE经验性治疗。
CRE菌株表现为多重耐药,本研究中未发现对替加环素耐药的菌株。替加环素是甘氨酰环素类抗菌药物,是半合成四环素米诺环素的衍生物,可通过抑制细菌蛋白质合成而发挥抗菌作用[26-28]。CRE感染的有限治疗,使一些药物再次应用于临床一线,如多黏菌素成为治疗CRE感染的重要治疗药物[29]。此外,新的抗生素及其复合制剂也不断被开发并应用于临床,如头孢他啶/阿维巴坦是一种新型头孢菌素与β内酰胺酶抑制剂的复合制剂,2019年5月在我国上市。该药对产丝氨酸碳青霉烯酶菌株具有高度抗菌活性,作为一种新药广泛应用于临床[30-31]。实验室对多黏菌素药敏试验开展较晚,药敏数据较少,未进行统计分析,但是作为针对CRE的最后防线,有条件的实验室应尽快开展多黏菌素药敏试验,规范报告解读,以为临床提供用药指导[32]。
不同感染部位CRE的经验性治疗方案不同[29,33],对于血流感染以及呼吸道感染,推荐高剂量美罗培南联合多黏菌素;尿路感染推荐高剂量美罗培南联合磷霉素或者氨基糖苷类抗菌药物。在临床治疗中,还需要考虑抗生素的体内药动学及药效学以及毒副作用,如替加环素在血液、尿液中的浓度低,黏菌素在肺组织的穿透性差[34],长期应用氯霉素会抑制骨髓,氨基糖苷类抗菌药物有肾毒性和耳毒性。不同种类的抗菌药物对产生不同碳青霉烯酶菌株的抗菌活性不同[33],如头孢他啶/阿维巴坦对产KPC和OXA-48型丝氨酸碳青霉烯酶菌株具有高度抗菌活性,但对产金属β内酰胺酶菌株无抗菌活性。此外,可根据不同碳青霉烯酶的特征开展联合药敏试验以制定精准的抗感染治疗方案[5]。因此,碳青霉烯酶型的确定非常重要,实验室应结合自身条件及临床需求开展碳青霉烯酶型的检测。
感染途径不同危害不同、经验治疗策略不同,尤其对于未培养出致病菌但是二代测序等检出致病菌的危重症患者,不同感染部位的致病菌的特点及对抗菌药物的耐药率的统计分析对于制定抗感染治疗方案具有重要意义。CRE引起的感染死亡率高,可选择的抗菌药物少。因此,动态监测不同感染部位CRE的检出情况、菌株分布情况及耐药情况对于临床合理使用抗菌药物、改善患者结局、减轻患者疾病负担具有重要意义。

