青岛市部分地区女性HPV感染现状分析
赵希芹 宋海洋 孙有湘 王云
(1 青岛大学基础医学院病原生物学系,山东 青岛 266071; 2 青岛大学附属医院检验科; 3 青岛市黄岛区人民医院)
人乳头瘤病毒(HPV)对皮肤和黏膜上皮细胞具有高度亲嗜性,可引起良性和恶性增殖性病变。目前已发现200多种HPV基因型,根据是否能引起恶性病变分为高危型HPV(HR-HPV)和低危型HPV(LR-HPV)[1]。宫颈癌是严重威胁女性生命健康的恶性肿瘤之一,最新数据显示宫颈癌的发病率和病死率在全球女性恶性肿瘤中排第4位[2]。众多研究表明HR-HPV持续性感染是宫颈癌及癌前病变发生发展的关键因素[1-3]。同时流行病学数据显示,HPV感染率和基因型分布在不同国家、地区和人种中均存在差异[4-7],在不同年龄、不同宫颈疾病人群中也存在差异[4-8],甚至在同一地区不同年代也有变化[9-10],因此及时掌握不同地区和不同人群HPV的感染特点,对制定有效的HPV预防和筛查策略非常必要。本研究以2019年6月—2020年5月在我院健康体检者及门诊、住院病例为代表,分析青岛地区HPV感染特点,并探讨HPV感染与宫颈病变之间的关系,为青岛地区女性优化宫颈癌筛查和精准防控策略提供客观的数据支持。
1 对象与方法
1.1
以在青岛大学附属医院中心实验室进行HPV基因型检测的门诊、住院患者及体检者37 267例为研究对象。纳入标准:户籍为青岛地区的女性,排除妊娠、哺乳妇女及宫颈锥切、子宫切除和宫颈癌复查的患者。研究对象年龄13~87岁,平均年龄(40.43±10.97)岁,按不同年龄分为5组:≤25岁组2 487例,26~35岁组11 690例,36~45岁组10 633例,46~55岁组8 868例,>55岁组3 589例。所有研究对象中,有2 651例进行了阴道镜宫颈的活检,宫颈活检的指征:薄层液基细胞学检测(TCT)结果异常者、HPV16或(和)HPV18阳性者、任意一种除HPV16和HPV18以外的HR-HPV阳性且年龄>40岁者。由我院经过专业培训的妇产科医师和经验丰富的病理科医师完成宫颈活检及病理学检查,对于疑难切片的分级由专家会诊判定。依据宫颈癌及癌前病变病理诊断规范(2019版)对不同病理学检查结果的患者进行分组,分别为慢性宫颈炎组1 288例,低级别鳞状上皮内病变(LISL)组711例,高级别鳞状上皮内病变(HISL)组560例,宫颈癌组92例(宫颈鳞状细胞癌72例和宫颈腺癌20例)。LISL级别及以上定义为有宫颈病变。
1.2
采用PCR-DNA反向点杂交相结合的方法,检测宫颈脱落细胞中HPV感染情况,检测试剂盒购买于亚能生物技术(深圳)有限公司。样本采集、检测和结果判定全部严格按照试剂说明书要求操作。样本检测出1种或者1种以上HPV基因型即为HPV阳性,该病例定义为HPV感染;样本中仅检测出1种HPV基因型为HPV单一感染,检测出2种或者2种以上HPV基因型为HPV多重感染。HPV阳性率=分组HPV阳性数/分组总例数。多重感染率=分组多重感染病例数/分组HPV阳性病例数。
1.3
采用SAS 9.4统计软件进行数据分析,各组间HPV阳性率的比较采用行×列表卡方检验,进一步采用q检验进行两两比较;采用线性趋势卡方检验分析HPV感染与不同病理类型宫颈疾病的关系。以P<0.05为差异有显著性。
2 结 果
2.1
在所有研究对象中HPV阳性患者8 980例(24.1%),其中HPV单一感染6 231例(16.7%),多重感染2 749例(7.4%)。HPV阳性样本中检测出23种HPV基因型,HR-HPV基因型阳性7 646例(20.5%),占所有HPV基因型阳性者的85.1%。其中单一HR-HPV基因型阳性者4 987例,多重HR-HPV基因型阳性者1 377例,多重HR-HPV/LR-HPV基因型阳性者1 282例;单一LR-HPV基因型阳性者1 244例,多重LR-HPV基因型阳性者90例。
所有研究对象当中各HR-HPV基因型阳性率由高到低分别为HPV52(4.2%)、HPV16(3.8%)、HPV53(2.7%)、HPV58(2.6%)、HPV51(2.0%)、HPV56(1.8%)、HPV59(1.6%)、HPV68(1.5%)、HPV66(1.4%)、HPV18(1.1%)、HPV31(1.0%)、HPV39(0.9%)、HPV33(0.9%)、HPV35(0.8%)、HPV45(0.4%)、HPV82(0.3%)和HPV73(0.2%);各LR-HPV基因型阳性率由高到低分别为HPV81(2.8%)、HPV42(1.7%)、HPV43(1.4%)、HPV6(0.9%)、HPV11(0.7%)和HPV83(0.2%)。
2.2
各年龄组HPV、HR-HPV和主要HR-HPV基因型阳性率比较均有显著差异(χ2=9.61~126.24,P<0.05);其中≤25岁组HPV和HR-HPV阳性率显著高于其他各组(q=9.01~14.59,P<0.05);其中≤25岁组HPV53阳性率显著高于26~35岁组(q=3.21,P<0.05),另外5种主要HR-HPV基因型和其他HR-HPV基因型阳性率≤25岁组均显著高于其他各组(q=4.71~13.80,P<0.05);>55岁组HR-HPV、HPV52、HPV58和其他HR-HPV基因型阳性率显著高于36~45岁组和46~55岁组(q=3.40~6.35,P<0.05);26~35岁组HR-HPV、HPV52以及HPV51的阳性率显著高于36~45岁组和46~55岁组(q=3.72~5.22,P<0.05);其余各组间进行比较均不具有显著性差异(P>0.05)。见表1。
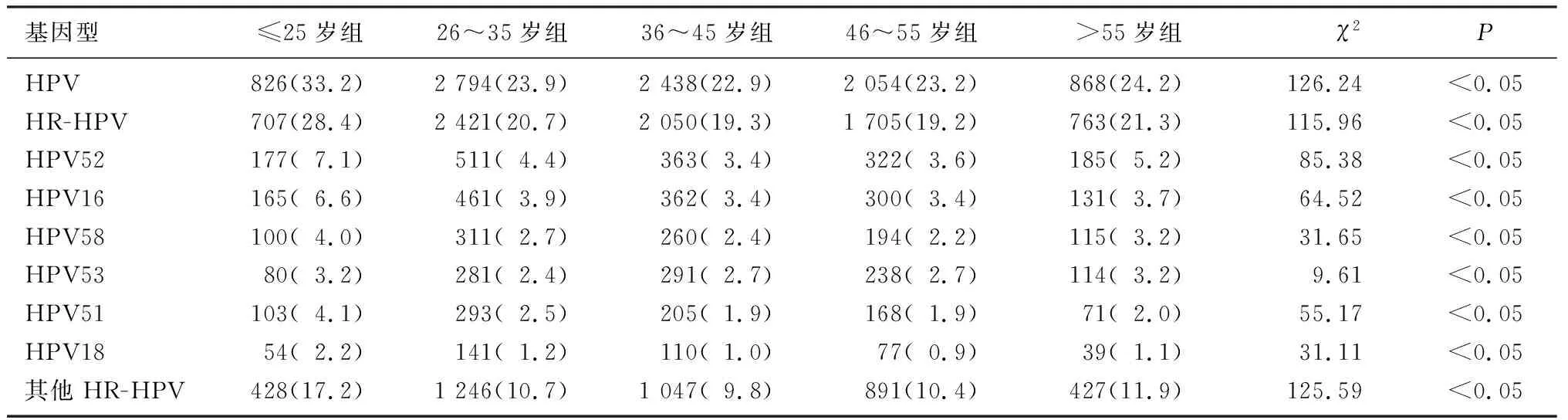
表1 各组HPV、HR-HPV和主要HR-HPV基因型阳性情况比较[例(χ/%)]
2.3 各病理学分级组HPV、HR-HPV阳性率及多重感染情况比较


表2 各组HPV、HR-HPV阳性率及多重感染情况比较[例(χ/%)]
2.4


表3 各病理学分级组HR-HPV基因型阳性情况比较[例(χ/%)]
3 讨 论
本研究对象的HPV阳性率为24.10%,与近期文献报道的数据比较,低于吉林的34.4%[11]和西安的26.3%[12],高于深圳的17.83%[13]及杭州上城区的22.41%[14]。另外山东17个城市的郊区和农村地区的调查结果显示,HPV阳性率为28.41%[15],其中济宁市为27.9%[16]。青岛市2011年11月—2014年10月和2016年6月—2017年6月妇科门诊女性HPV阳性率分别为32.2%[17]和33.3%[18]。本研究结果中HPV阳性率较低,可能原因:①研究对象的收集途径不同,本研究除门诊和住院患者外,还纳入了查体人员,而查体人员HPV阳性率可能较门诊患者低;②与各级医院推广宫颈癌早期筛查和对HPV阳性人群的干预治疗有关[5],致HPV阳性率呈逐年下降趋势,如华东地区从2012年的25%下降至2016年的16%[19]。
本研究还发现,在所有研究对象中HPV、HR-HPV和主要HR-HPV基因型阳性率在年龄上呈“U”型分布,以≤25岁组最高,随后逐渐降低,>55岁组阳性率又略有升高,这与以往研究结果相一致[5-6,15,18]。这种分布可能反映了HPV感染的自然过程,年轻女性未建立对HPV的免疫力,性生活活跃,宫颈细胞更容易受到损伤,易受病毒感染,但大多为一过性感染,71%~90%的感染会在1~2年内被机体清除,仅少数女性会转变为HPV持续性感染[20]。而55岁后阳性率升高,可能与围绝经期女性性激素水平发生改变、对病毒的易感性增加、清除力下降以及性生活保护意识降低等因素有关[21]。HPV阳性率的年龄分布趋势提示在宫颈癌筛查时,既要重点关注年轻女性,也不能忽视围绝经期女性。
本研究中所有研究对象HR-HPV基因型阳性率位于前6位的分别为HPV52、HPV16、HPV53、HPV58、HPV51和HPV56,与国内其他的地区报道结果基本相似,但是排序略有不同。先前研究报道青岛地区位居前3位的HR-HPV基因型分别为HPV16、HPV52和HPV58[17-18],既往研究显示我国多数地区检出的前3位的HR-HPV基因型亦分别为HPV52、HPV16和HPV58[7,10,13]或HPV16、HPV52和HPV58[11-12,14-15]。本研究中HPV53阳性率在所有HR-HPV基因型居第3位,最新报道的来自2017年我国多个地域的大样本(427 401例)综合数据显示,HR-HPV基因型阳性率由高到低排序分别为HPV52、HPV58、HPV53、HPV16以及HPV51[5]。有Meta分析显示,中国大陆HR-HPV基因型阳性率占前5位分别为HPV16、HPV52、HPV58、HPV53和HPV18[6]。以上数据,提示了各地区女性HR-HPV感染存在地域和年代的差异。宫颈癌中HR-HPV基因型分布同样存在地域差异,本研究当中宫颈癌组HR-HPV基因型阳性率居前6位的分别为HPV16、HPV18、HPV56、HPV33、HPV58、HPV52,而之前报道的青岛市居前6位的HR-HPV基因型分别为HPV16、HPV52、HPV31、HPV33、HPV58和HPV51[22];江苏泰州市基因型分别为HPV16、HPV33、HPV58、HPV18、HPV52以及HPV31[23];长江三角洲地区则分别为HPV16、HPV18、HPV58、HPV52、HPV33以及HPV53[24],西安市基因型分别为HPV16、HPV18、HPV33、HPV52、HPV31以及HPV35[12]。
既往研究和本研究结果均显示,不同病理学分级组中HR-HPV基因型分布存在显著差异,提示不同HR-HPV基因型致癌能力不同。Meta分析显示,在世界范围内,宫颈癌患者中阳性率最高的HR-HPV基因型为HPV16,其次是HPV18,亚洲地区宫颈癌患者HR-HPV基因型阳性率由高到低分别为HPV16、HPV18、HPV58、HPV33、HPV52、HPV45、HPV31以及HPV35,而在HSIL患者当中排序分别为HPV16、HPV58、HPV52、HPV18、HPV51、HPV33、HPV31以及HPV56[25]。一项针对国内数据的Meta分析显示,在LSIL患者中HR-HPV基因型阳性率位居前5位的分别为HPV52、HPV16、HPV58、HPV18和HPV53,HSIL患者中则分别为HPV16、HPV58、HPV52、HPV33以及HPV31[8]。HPV16是公认的致癌力最强的基因型,本研究中HPV16在宫颈癌组中的阳性率为64.1%,而且其阳性率病理学级别的升高呈递增趋势,与以往结果一致[8,12,22-24]。
HPV多重感染能否促进宫颈病变的进展一直存在争议,有研究认为HPV多重感染病毒载量大,不利于机体及时清除病毒,因此能够促进宫颈病变的进展[23,26,27]。也有研究显示,HPV多重感染与宫颈病变的进展无明显相关性[12,24]。本研究中HPV多重感染率随宫颈病变级别升高呈递减趋势,与之前青岛市[22]和北京市[28]研究结果一致,提示HPV多重感染可能并不促进宫颈病变进展。HPV多重感染与宫颈病变的确切关系,尚待进一步研究。
综上所述,青岛部分地区女性HPV易感年龄呈低龄和高龄双峰分布,而且以HPV52、HPV16和HPV53为最常见HR-HPV基因型;HR-HPV基因型感染与宫颈病变密切相关,但HPV多重感染可能无促进宫颈病变进展的作用。本研究为当地宫颈癌筛查和预防提供了有价值的数据,可能有助于制定符合本地区特点的HPV检测和预防策略。

