外泌体在类风湿关节炎发病机制和诊疗中的作用
董鑫鹏,翟耘浩,陈广洁
(上海交通大学医学院 上海市免疫学研究所,上海 200025)
类风湿关节炎(rheumatoid arthritis,RA)是一种慢性系统性自身免疫性疾病,其主要特征有持续性滑膜炎、全身性炎症以及出现自身抗体(特别是RF和瓜氨酸化肽)[1]。可以根据是否存在抗瓜氨酸化蛋白抗体(anti-citrullinated protein antibody,ACPA)将RA分为2个亚型,其中ACPA阳性亚群比ACPA阴性亚群具有更强的临床表型[2]。不受控制的活动性RA将会导致关节损伤,甚至残疾,还有可能引发心血管疾病和其它合并症,严重影响患者的生活质量。
外泌体是直径40~100 nm的膜性囊泡,由磷脂双分子层包裹,是细胞外囊泡(extracellular vesicle,EV)中的一个重要亚群,可以通过携带多种生物大分子对受体细胞的各项生物学特性及生理状态进行调节[3]。早期由于人们对外泌体功能知之甚少,认为外泌体是细胞外排废弃物的一种形式,随着近年来诸多外泌体相关研究的展开,外泌体的免疫调节功能也逐步被证实[4-5]。目前多项研究揭示外泌体在诸多生理病理过程中发挥重要的作用,并对RA发病过程中的免疫反应具有一定的调节作用,对RA患者中的自身免疫反应产生对应的激活或抑制效果,因此,外泌体或可成为新型RA疗法的突破性靶点,进一步评估其潜在价值将对临床上RA的实验性治疗具有较大的意义。
1 外泌体
1.1 外泌体的定义、分布和成分外泌体是一种可由多种细胞分泌的脂质双层膜结构的小囊泡,通常被认为是由胞内的多泡体与细胞膜融合释放到细胞外而产生的,可来源于体内任何细胞,外泌体广泛分布于血液、唾液、母乳、关节滑膜液等不同体液中。外泌体的脂双层富含胆固醇、鞘磷脂和神经酰胺,将内部与外界隔离开,可显著保护内容物免于酶解。外泌体的主要成分蛋白质来源于细胞非特异性蛋白分子和特异性蛋白分子两类。前者为与来源细胞无关的共有蛋白,包括四跨膜蛋白超家族、热休克蛋白、参与胞内信号转导的蛋白、细胞溶质蛋白和外泌体酶等;后者为与来源细胞密切相关的一类特殊蛋白,可作为外泌体来源的鉴定指标,如成年心肌细胞来源的外泌体含肌节蛋白,APC来源的外泌体含MHC和共刺激信号蛋白CD86等[3-5]。外泌体内还含有丰富的RNA,如mRNA和包括miRNA、长链非编码RNA(long non-coding RNA,lncRNA)在内的非编码RNA等[5],其通过各种RNA在不同细胞间的传播来实现对靶细胞基因表达的调控。
1.2 外泌体的产生、作用机制和生物学功能
目前认为,外泌体是由胞内核体与高尔基体作用形成的多泡体(multivesicular body,MVB)通过质膜出芽释放或与膜泡融合释放而形成。现已发现蛋白激酶D1/2通路在调控MVB的成熟和外泌体的释放过程中发挥关键作用,同时介导了二酰基甘油激酶α对MVB分泌的调控[6]。外泌体在被释放后与内环境中的可溶性因子结合,以旁分泌或内分泌的方式被定向运输至靶细胞。外泌体通过直接被靶细胞内吞摄取或靶细胞表面受体介导的胞内信号转导2种方式作用于靶细胞。但外泌体作用于靶细胞的具体机制还不明确,有研究认为,外泌体的摄取依赖于胆固醇和酪氨酸激酶活性,通过不依赖网格蛋白的内吞作用和大型胞饮作用进入靶细胞[7]。外泌体携带的物质在自身免疫过程中可以成为自身抗原的来源,还能够作为介导病原体在细胞间转移或造成组织损伤的相关载体。
2 外泌体对RA发生、发展的影响
2.1 外泌体携带的蛋白质介导RA发病大量存在于RA患者外泌体中的瓜氨酸化蛋白主要来源于由肽酰精氨酸脱亚氨家族酶催化的精氨酸的脱氨基作用,产物瓜氨酸化蛋白可作为抗原触发自身免疫反应,形成大量沉积于滑膜空间内的免疫复合物(immune complex,IC),进而刺激肥大细胞、中性粒细胞等产生多种炎性因子,使RA病情进一步恶化[8];而巨噬细胞通过外泌体释放的核DNA结合蛋白,也可作为自身抗原参与RA的发病过程[9]。RA患者体内的滑膜液和成纤维样滑膜细胞(fibroblast-like synoviocytes,FLS)分泌的外泌体中都被证实含有DNA结合抑制因子1(inhibitor of DNA binding 1,Id1)。Id1可通过激活胞内Jnk信号通路加速炎症位置新血管的生成[10],促进FLS增殖,以及抑制免疫细胞IL-6和IL-8的分泌等多方面联合作用于RA的发病[11]。Morgan等[12]在RA患者体内血浆、滑膜液和FLS上清液中都分离出了带有CD13的外泌体,随后CD13被证实可大幅增强关节内FLS的增殖和迁移能力,最终使FLS病理性增生;此外,CD13还可募集T细胞进入炎症组织,分泌多种炎性因子促进FLS增殖,使RA患者病情恶化。研究表明,FLS分泌的外泌体携带的膜型TNF-α可以激活PKB/AKT和NF-κB信号通路,促进FLS分泌破坏细胞外骨和软骨基质的基质金属蛋白酶1(matrix metalloproteinase 1,MMP-1)以及阻断胞内细胞凋亡通路来抑制T细胞的正常凋亡[13-14]。
2.2 外泌体相关RNA介导RA发病外泌体内的RNA所负责的基因调控功能主要依靠miRNA,其中的miR-155和miR-146a是近年来研究的热点。相比正常人,ACPA阳性的RA患者的外周血样本中IgD-CD27-的记忆B细胞内的miR-155表达水平显著升高,其结合转录因子PU.1促进BCR发生交联,进而促进抗体生成,形成大量IC[15];miR-155还会增强单核细胞招募外来免疫细胞,同时通过抑制滑膜组织内单核-巨噬细胞CC趋化因子受体2(CC chemokine receptor 2,CCR2)的表达来使其滞留于滑膜组织内,加重局部炎症[16]。RA患者体内FLS中miR-155的表达明显上调,与滑膜空间内形成的慢性炎症状态密切相关;相同环境在IL-1β、TNF-α刺激下,表达上调的miR-146对IL-6、IL-8、IL-1受体相关激酶及肿瘤坏死因子受体相关因子6对应基因的表达产生抑制作用[17]。
miR-let-7b包含在巨噬细胞或FLS的EV中,滑膜细胞的死亡也可释放大量miR-let-7b。miR-let-7b可通过结合幼稚单核细胞表面的TLR7来诱导其分化为M1型巨噬细胞,从而促进TNF、IL-6等促炎因子的释放,导致RA患者病情恶化。Kim等[18]测得RA滑膜液中miR-let-7b的表达水平远高于骨关节炎滑膜液、RA患者血浆和正常人血浆,充分说明miR-let-7b是造成关节炎症加重的关键因素。
除上述3种miRNA,其他的miRNA也会对RA发病产生作用。由TNF诱导的miR-211-3p表达上调可通过抑制Wnt信号通路中的Dkk2(Dickkopf2)来抑制成骨细胞的分化与钙化,影响磨损区域的骨修复[19]。miR-17则可以靶向结合转化生长因子βⅡ类受体(transforming growth factor β receptor Ⅱ,TGFBR Ⅱ)来抑制Treg的分化,削弱自身免疫的负调节作用[20]。miR-124a、miR-19a在调节滑膜细胞增殖和炎性因子的释放过程中也有一定作用。
Song等[21]发现,除miRNA外,名为Hotair的反转录lncRNA大量存在于RA患者的血清外泌体和外周血单核细胞中,其过量表达可诱导活化后的巨噬细胞迁移至炎症区域;Hotair还会通过活化MMP-2、MMP-13来加速骨和软骨基质的溶解,破坏溶骨成骨平衡,对关节造成不可逆的病理损伤。
2.3 不同细胞来源的外泌体对RA发病的影响已经证实,细胞来源的外泌体可参与RA发病,但对于其所含的具体成分仍知之甚少,此部分将外泌体按照不同细胞来源进行分类以进一步描述其作用。
RA患者T细胞及单核细胞来源的外泌体可以刺激FLS分泌MMP-1、MMP-3、IL-6、IL-8、单核细胞趋化因子(monocyte chemotactic protein,MCP)-1、MCP-2等[22];B细胞来源的外泌体主要负责自身抗原的递呈,其中由B细胞分化而来的淋巴母细胞则可以分泌带有MHC-Ⅱ和FasL的外泌体诱导CD4+T细胞凋亡,负调节病理性自身免疫反应[23];CD4+CD25+Foxp3+Treg来源的外泌体可以通过携带的miRNA沉默Th1的相关基因来削弱由Th1介导的自身免疫[24];CD8+CD25+Foxp3+Treg来源的外泌体则能够抑制自身杀伤性T细胞,延缓RA发病和病情进一步恶化[25];成熟DC分泌的外泌体可利用MHC分子和共刺激分子等向T细胞呈递抗原,触发自身免疫反应[26];未成熟DC来源的外泌体低表达共刺激分子,但通过自身高表达TGF-β、CD95L等免疫抑制性配体来抑制自身免疫反应[27];FLS来源的外泌体携带的TNF-α可以活化NF-κB信号通路,强化T细胞的抗凋亡能力,加强T细胞介导的炎症反应[28];血小板来源的外泌体也参与RA的炎症发生过程,与RA活动度密切相关[29]。
3 外泌体在RA临床诊疗上的应用
3.1 外泌体在RA临床诊断上的应用RA患者滑膜液和血清中的外泌体含有一系列与RA发病相关的蛋白,这类蛋白一半以上含有瓜氨酸残基。这些瓜氨酸化蛋白主要以纤维蛋白原和波形蛋白等形式存在。在RA患者血清样本中提取的外泌体内检测到淀粉样蛋白A(amyloid A,AA)和淋巴管内皮透明质酸受体1(lymphatic vessel endothelial hyaluronan receptor1,LYVE-1)与CRP之间存在显著正相关[30],提示前两者可能参与RA发病。
与正常人相比,RA患者血清中的外泌体含有7种表达水平明显上调的lncRNA,分别是Hotair、LUST、anti-NOS2A、MEG9、SNHG4、TUG1及NEAT1;同时,另有6种相同来源的lncRNA表达水平明显下调,分别是Malat1、SNHG1、mascRNA、PR antisense transcripts、PRINS及HOXA3as[21]。除lncRNA外,包括miR-155、miR-146、miR-let-7b在内的多种miRNA在RA患者与正常人体内也呈现差异表达。
基于外泌体携带的蛋白及RNA成分在RA患者体内的异常表达,其可作为生物学标志物提示RA发病。传统的RA诊断主要根据滑膜液中的炎性标志物、抗类风湿性因子抗体以及抗CCP抗体等,但研究逐渐证实外泌体相关的多种成分也可以作为典型的RA诊断标志物应用于临床。这类“新型”RA诊断标志物主要有瓜氨酸化蛋白、AA蛋白、LYVE-1蛋白、包括Hotair在内的多种lncRNA、miR-let-7b、miR-221-3p等,可以相对准确地反应疾病状态。无论是作为RA生物标志物进行诊断,还是作为标志物对患者的预后进行评估,外泌体相关成分都具有极大的临床潜在价值。
3.2 外泌体在RA临床实验性治疗上的展望目前为止,所有关于外泌体疗法的研究都还只停留在动物实验阶段,这类疗法的临床应用尚未在人体开展。本文对利用外泌体实验性治疗RA动物模型的可能机制进行了归纳(表1)。
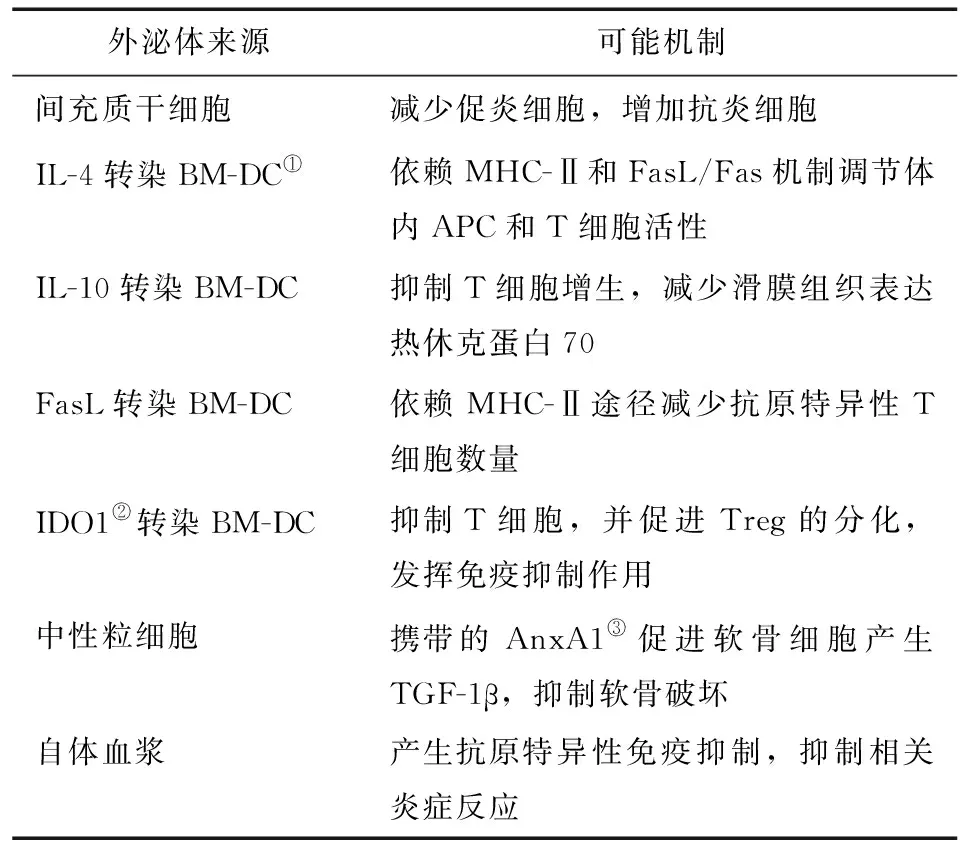
表1 外泌体治疗RA动物模型(CIA小鼠)的可能机制
此外,还有文献提到肿瘤细胞来源的外泌体可以对肿瘤微环境中T细胞的增殖、活化起抑制作用,减弱相关免疫应答,并且可以增强抗肿瘤疫苗的作用[31];而DC来源的外泌体则可以作为抗肿瘤疫苗和生物工程外泌体用于体外和临床前动物研究[32]。这些研究都表明,外泌体在各类疾病微环境中都有着关键性的调节作用,其作为一种重要的信息传递介质能够对疾病的进程产生多方面的影响。因此,利用外泌体的这一特性将其应用于临床前相关研究是一个有效的切入手段。
总体来说,外泌体疗法是一种具有广阔临床应用前景的新式疗法。外泌体来源广泛,在体内半衰期长,脂溶性高,能够跨越包括血脑屏障在内的生物屏障,并且不会引起免疫排斥,其内容物还可以免于酶的降解,有着较好的稳定性,能直接靶向作用于局部特定细胞。但目前外泌体疗法尚不成熟,自体外泌体的提取纯化、高特异性回收等多方面效果仍不理想。
4 结语
目前来看,外泌体在RA发病中的研究主要集中在外泌体的产生及其作用机制、外泌体相关物质在RA中的生物学功能和外泌体在RA诊治中的潜在价值三方面。大量实验证明,外泌体在RA发病及诊治的过程中有其独特的优越性,是现代医学在RA诊疗方面的崭新突破口。外泌体作为标志物对RA的早期诊断起到的警示作用将极大地改善患者的预后。但由于RA发病机制复杂多变、外泌体提纯量化技术不够完善、外泌体作用的具体机制尚不明朗,将外泌体广泛地应用于临床仍然需要进一步的研究。

