参仙升脉口服液对病态窦房结综合征小鼠ROS 表达的影响和对HCN4 离子通道的调控作用
毛 丹, 李志爽, 程佳新, 侯 平
(1.辽宁中医药大学第一临床学院,辽宁 沈阳 110032;2.辽宁中医药大学附属医院心内二科,辽宁 沈阳 110032)
病态窦房结综合征(sick sinus syndrome,SSS)也称窦房结功能障碍,SSS 患者心脏窦房结细胞结构发生病理性改变,结缔组织增生,导致窦房结功能障碍,起搏受到抑制,心率减缓,引起身体其他系统特别是中枢神经系统的功能异常,造成昏厥甚至猝死,外科手术、冠心病、心肌病和全身免疫性疾病均可导致该病的发生[1]。年龄增长是该病的主要原因之一,SSS患者平均年龄为68岁,每600例65岁或以上的心脏病患者中就有1例发生窦房结功能障碍,且不分性别[2]。1990年美国,因窦房结功能障碍植入起搏器者占起搏器植入者总数的50% 以上[3]。中枢神经麻醉诱导的交感神经切除术和使用诸如丙泊酚、瑞芬太尼、右美托咪定或维库溴铵的交感神经药物均可以引起窦房结功能障碍并引发危及生命的心律失常,临床常采用植入起搏器来进行治疗,但手术治疗的费用高昂,给多数家庭带来了经济压力[4]。参仙升脉口服液是临床常用的治疗心动过缓和心律失常的复合药物,具有温补心肾及活血化瘀的功效,可通过增强细胞代谢活力,提高心率[5]。窦房结细胞具有高度的自律性,细胞膜上存在超级化激活环核苷酸阳离子(hyperpolarization-activated cyclic nucleotide-gated,HCN)通道,HCN 通道有4种亚型,窦房结细胞主要表达环化核苷酸调控阳离子通道蛋白亚型4(cyclic nucleotide regulated cation channel protein subtype 4,HCN4),维持心脏正常的起搏电流[6]。当窦房结细胞受到损伤时,HCN4 的表达受到影响,影响电信号的传导,造成心率减慢和心律异常[7]。心肌细胞产生活性氧(reactive oxygen species,ROS),当循环失去平衡时,出现持续性氧化应激,过量的ROS 就会损伤心肌细胞[8],导致心律失常。然而参仙升脉口服液对HCN4 离子通道的作用及其调节机制尚未见报道。本文作者建立小鼠SSS 模型,基于参仙升脉口服液对SSS 小鼠ROS 释放的影响,探讨其对HCN4 离子通道调控的作用,为进一步研究其作用机制提供参考。
1 材料与方法
1.1 实验动物、主要试剂和仪器30只C57B6小鼠购自北京华阜康生物科技股份有限公司,动物生产合格证号:SCXK(京)2019-0008,饲养环境温度控制在约23℃,湿度约为70%。参仙升脉口服液购于山东步长制药有限公司,抗体SCN5A(ab56240)、CACNα1C(ab58552)、CACNα1G(ab128251)、CACNα1G(ab32675)和HRP标记山羊抗兔二抗(ab6721)(美国Abcam 公司)和ECL 发光试盒(34580)购于美国赛默飞公司,ROS 染色液(D7008)购于美国Sigma 公司,实时荧光定量PCR(Real-time fluorescence quantitative PCR,RT-qPCR)试剂盒购于日本TaKaRa公司,Masson染色试剂盒(G1340)和HE染色试剂盒(G1121)购自美国索莱宝公司。倒置荧光显微镜(FM-500)购自上海普丹公司,酶标仪(Epoch)购自美国BioTek 公司,WB 化学发光成像系统(JP-K300)购自广州沪瑞明仪器厂,MEDLAB 生物信号采集处理系统购自上海瑞鲍生物科技有限公司。
1.2 实验动物分组30只C57B6 小鼠随机分为假手术组、SSS组和参仙升脉治疗(SXSM)组,每组10只。
1.3 SSS 模型小鼠制备采用2% 戊巴比妥钠腹腔注射(45 mg·kg-1)麻醉小鼠,俯卧固定小鼠四肢,颈后备皮处切口,制作囊袋,将Alzet 渗透压泵植入囊袋,渗透压泵中放入血管紧张素Ⅱ(angiotensinⅡ,AngⅡ)(3 mg·kg-1·d-1),缝合切口,通过微量泵入AngⅡ建立窦房结纤维化模型模拟SSS[9];采用同样方法处理假手术组小鼠,将AngⅡ替换成生理盐水(3 mg·kg-1·d-1);SXSM组在小鼠造模后第2天灌胃参仙升脉口服液(0.2 mL·d-1),持续28 d。采集窦房结组织,取一部分置于中性甲醛中固定,一部分置于-80℃冰箱待用。
1.4 各组小鼠心率检测对各组小鼠于造模前0 d 和造模后7、14、21、28 d 检测心率,麻醉小鼠后,仰卧固定,刺入信号传导需要的电极针,接入电极后,利用生物信息采集系统采集各组小鼠的心率。
1.5 HE 染色观察各组小鼠窦房结组织损伤情况取出固定液中的窦房结组织样本,流水冲洗后酒精梯度脱水,采用二甲苯透明,浸入石蜡中包埋,包埋后蜡块连续切片,厚度为5 μm。展片、贴片和脱蜡后进行苏木素染色及伊红染色,树脂胶封片,显微镜下观察各组小鼠窦房结组织损伤情况。
1.6 MASSON 染色观察各组小鼠窦房结组织纤维化情况取出固定窦房结组织样本,冲洗,酒精梯度脱水,透明后浸入石蜡包埋,包埋蜡块连续切片,厚度为5 μm。展片、贴片、脱蜡,采用Masson 染色试剂盒染色,树脂胶封片,显微镜下观察各组小鼠窦房结组织纤维化情况。
1.7 免疫荧光法检测各组小鼠窦房结组织中ROS水平取出窦房结冰冻组织,制作冰冻切片,切片在室温下复温,控干水分。采用组织化学笔在组织周围画圈,在圈内加入自发荧光淬灭剂保持5 min,流水冲洗10 min,在圈内滴加ROS染液,避光37℃恒温孵育30min;采用PBS洗涤3次,每次5 min。切片稍甩干后在圈内滴加DAPI 染液,避光室温孵育10 min;采用PBS 缓冲液洗涤3次,每次5 min。切片稍甩干后采用抗荧光淬灭封片剂封片。于荧光显微镜下观察并采集图像,采用Image J 软件分析荧光强度,将参数设置为“Analyse”,直接检测荧光强度,以呈现荧光的面积与总面积百分比代表ROS 水平。
1.8 RT-qPCR 法检测各组小鼠窦房结组织中SCN5A、CACNα1C 和CACNα1GmRNA表达水平采用TRIzol裂解液裂解小鼠窦房结组织后,按照常规方法提取组织中RNA,并合成荧光定量引物。引物序列见表1。
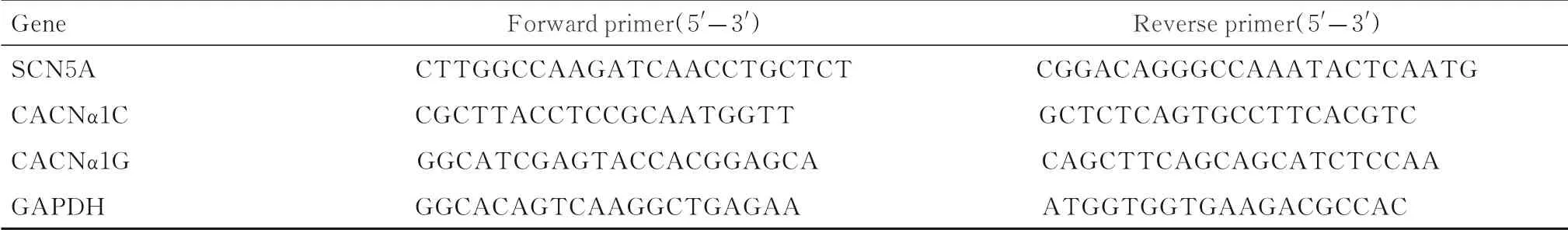
表1 引物序列Tab.1 Primer sequence
提取后反转录成cDNA,配伍反应体系,放置于RT-qPCR 仪中,设置PCR 热循环参数:95℃、2 min,95℃、30 s,60℃、30s收集荧光信号,40个循环。采用2-ΔΔCt法计算各组小鼠窦房结组织中SCN5A、CACNα1C 和CACNα1G mRNA 表达水平。
1.9 Western blotting 法检测各组小鼠窦房结组织中SCN5A、CACNα1C、CACNα1G 和HCN4 蛋白表达水平取各组小鼠窦房结组织,加入RIPA 裂解液、蛋白酶抑制剂、PMSF 提取总蛋白质。BCA法测定蛋白浓度,各组取相同质量蛋白质进行10% SDS-PAGE 凝胶电泳,转膜,5% 脱脂奶粉封闭液室温封闭3 h,TBST洗膜3次,每次10 min,按说明书建议比例加入SCN5A、CACNα1C、CACNα1G、HCN4 和GAPDH抗体稀释液,TBST 洗膜,每次5 min,洗涤3次。加入HRP 标记的二抗,室温孵育3 h。采用ECL 发光试剂盒发光,凝胶成像系统成像,采用Image J软件计算条带的灰度值,将目的蛋白条带灰度值与内参蛋白条带灰度值的比值作为目的蛋白表达水平。
1.10 免疫荧光法检测各组小鼠窦房结组织中HCN4 水平采用免疫荧光法检测各组小鼠窦房结组织中HCN4水平,操作步骤同“1.7”。
1.11 统计学分析采用GraphPad prism8.0 统计软件进行统计学分析。各组小鼠心率,各组小鼠窦房结组织中ROS 和HCN4 水平,窦房结组织中SCN5A、CACNα1C 和CACNα1G mRNA表达水平和SCN5A、CACNα1C、CACNα1G 及HCN4 蛋白表达水平均以±s 表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用t检验。以P<0.05 为差异有统计学意义。
2 结 果
2.1 各组小鼠心率接入电极后,采用生物信息采集系统采集各组小鼠的心率进行分析,随着时间的延长,与假手术组比较,从第7天开始,SSS组和SXSM组小鼠心率逐渐降低(P<0.05);与SSS组比较,从第14天开始SXSM组小鼠心率升高(P<0.05)。见图1。

图1 各组小鼠心率Fig.1 Heart rates of mice in various groups
2.2 各组小鼠窦房结组织损伤和纤维化情况HE染色结果显示:假手术组小鼠窦房结区域窦房结组织中细胞结构完整,细胞核清晰明显,细胞分布均匀;SSS组小鼠正常窦房结组织中较多细胞的结构被破坏,出现溶解坏死,未见细胞核,结缔纤维组织增生;SXSM组小鼠出现较少部分细胞坏死,结缔纤维组织少量增生,见图2。Masson 染色结果显示:假手术组小鼠窦房结组织中细胞结构正常,纹理清晰,界限明显,组织间隙存在极少量结缔组织;SSS组小鼠窦房结组织中细胞大量溶解坏死,组织间隙结缔纤维组织大量增生;SXSM组小鼠窦房结组织中细胞间隙有少量胶原纤维,细胞部分坏死溶解,多数细胞轮廓清晰。见图3。

图2 HE 染色观察各组小鼠窦房结组织病理形态表现(×200)Fig.2 Pathomorphology of sinoatrial node tissue of mice in various groups detected by HE staining(×200)

图3 Masson 染色观察各组小鼠窦房结组织纤维化情况(×200)Fig.3 Fibrillation of sinoatrial node tissue of mice in various groups detected by Masson staining(×200)
2.3 各组小鼠窦房结组织中ROS 水平免疫荧光法检测各组小鼠窦房结组织中ROS 水平结果显示:与假手术组比较,SSS组和SXSM组小鼠窦房结组织中荧光强度明显增加,ROS 水平升高(P<0.05);与SSS组比较,SXSM组小鼠窦房结组织中荧光强度明显降低,ROS 水平降低(P<0.05)。见图4 和5。

图4 各组小鼠窦房结组织中ROS 的阳性表达(免疫荧光,Bar=20 μm)Fig.4 Positive expressions of ROS in sinoatrial node tissue of mice in various groups(Immunofluorescence,Bar=20 μm)
2.4 各组小鼠窦房结组织中SCN5A、CACNα1C和CACNα1G mRNA 表达水平与假手术组比较,SSS组小鼠窦房结组织中SCN5A mRNA 表达水平明显降低(P<0.05),CACNα1C 和CACNα1G mRNA 表达水平明显升高(P<0.05);与SSS组比较,SXSM组小鼠窦房结组织中SCN5A mRNA表达水平明显升高(P<0.05),CACNα1C 和CACNα1G mRNA 表达水平明显降低(P<0.05)。见图6。

图6 各组小鼠窦房结组织中SCN5A、CACNα1C 和CACNα1G mRNA 表达水平Fig.6 Expression levels of SCN5A,CACNα1C,and CACNα1G mRNA in sinoatrial node tissue of mice in various groups
2.5 各组小鼠窦房结组织中SCN5A、CACNα1C和CACNα1G 蛋白表达水平与假手术组比较,SSS组小鼠窦房结组织中SCN5A 蛋白表达水平明显降低(P<0.05),CACNα1C 和CACNα1G 蛋白表达水平明显升高(P<0.05);与SSS组比较,SXSM组小鼠窦房结组织中SCN5A 蛋白表达水平明显升高(P<0.05),CACNα1C 和CACNα1G 蛋白表达水平明显降低(P<0.05)。见图7。

图7 各组小鼠窦房结组织中SCN5A、CACNα1C 和CACNα1G 蛋白表达电泳图(A)和直条图(B)Fig.7 Electrophoregram(A) and histogram(B) of expressions of SCN5A ,CACNα1C,and CACNα1G proteins in sinoatrial node tissue of mice in various groups
2.6 各组小鼠窦房结组织中HCN4 蛋白表达水平与假手术组比较,SSS组小鼠窦房结组织中HCN4 蛋白表达水平明显降低(P<0.05);与SSS组比较,SXSM组小鼠窦房结组织中HCN4 蛋白表达水平明显升高(P<0.05)。见图8。

图8 各组小鼠窦房结组织中HCN4 蛋白表达电泳图(A)和直条图(B)Fig.8 Electrophoregram(A) and histogram(B) of expressions of HCN4 protein in sinoatrial node tissue of mice in various groups
2.7 免疫荧光法检测各组小鼠窦房结组织中HCN4 水平与假手术组比较,SSS组小鼠窦房结组织中HCN4 表达荧光强度明显减弱,HCN4 水平降低(P<0.05);与SSS组比较,SXSM组小鼠窦房结组织中HCN4 表达荧光强度明显增强,HCN4 水平升高(P<0.05)。见图9 和10。

图9 各组小鼠窦房结组织中HCN4 的阳性表达(免疫荧光,Bar=20 μm)Fig.9 Positive expression of HCN4 in sinoatrial node tissue of mice in various groups(Immunofluorescence,Bar=20 μm)

图5 各组小鼠窦房结组织中ROS 水平Fig.5 Levels of ROS in sinoatrial node tissue of mice in various groups
3 讨 论
引起SSS 的原因有很多[10],窦房结细胞退行性病理改变、冠心病和心肌炎等心脏疾病均可引起SSS。SSS 的临床治疗常以植入起搏器为主要手段,但其价格较高,不能被大多数患者及其家属所接 受[11]。临床研究[12]显示:参仙升脉口服液能够有效治疗窦房结心动过缓及病态窦房结导致的心律失常。本研究结果表明:参仙升脉口服液可以明显提高SSS小鼠心率,抑制窦房结纤维化的发生;心肌细胞的活动需要大量的线粒体功能来实现[13],平衡状态下ROS 对心肌细胞兴奋性的产生具有一定作用,过量蓄积时出现氧化应激反应,造成细胞损伤和凋亡。李超等[14]发现:慢性心衰大鼠的超氧化物歧化酶(superoxide dismutase,SOD)和丙二醛(malondialdehyde,MDA)水平均高于正常组,说明在心率减退下降的过程中,氧化应激反应参与其中,而抑制这种氧化应激反应后能够增强心功能增加心率。研究[15]显示:外源性给予双氧水(H2O2)模拟氧化应激反应时,心脏起搏电流会受到影响,同时HCN 通道蛋白的表达受到影响,而该作用与ROS 的过量释放存在一定关系。本研究结果显示:与假手术组比较,SSS组小鼠窦房结组织中ROS 过度释放,采用参仙升脉口服液干预可以抑制这一现象,说明参仙升脉口服液可以抑制SSS 小鼠窦房结中ROS 的释放,并且推测与HCN通道有关联。

图10 各组小鼠窦房结组织中HCN4 水平Fig.10 Levels of HCN4 in sinoatrial node tissue of mice in various groups
HCN4 属于超级化激活环核苷酸门控阳离子通道基因家族的一员,主要在窦房结细胞中表达,维持并在一定程度上调节窦房结的起搏频率[16],HCN4 通道激活产生内向的阳离子电流,维持起搏点电位去极化,产生动作电位[17]。研究[18]显示:HCN4 与窦房结功能障碍和窦性心率过缓存在必然的联系,HCN4 表达异常是导致心律失常的根本原因之一。研究[19]显示:过表达HCN4 的干细胞可以向心肌细胞分化,并可产生起搏电流;王欢[20]研究显示:转染HCN4 的干细胞可以治疗缓慢型心律失常。本研究针对HCN4 离子通道进行实验研究结果显示:参仙升脉口服液可以提高SSS 小鼠心率,改善其病理损伤;同时免疫荧光检测结果显示:SSS 小鼠窦房结组织中HCN4 蛋白表达水平降低,且参仙升脉口服液可以升高HCN4 蛋白表达,说明参仙升脉口服液可以提高HCN4 表达,调控HCN4 离子通道发挥增强心率,增强窦房结功能的作用。心脏钠通道SCN5A 的缺失或功能丧失突变与广泛的心律失常有关[21]。本研究结果显示:与假手术组比较,SSS组小鼠窦房结组织中SCN5A mRNA 和蛋白表达水平降低,SXSM组小鼠窦房结组织中SCN5A mRNA 和蛋白表达水平增加;电压门控的L- 型钙通道(L-type calcium channel,LTCC)与心律相关,是钙离子流入兴奋细胞响应于膜去极化主通路[22],CACNα1C 是窦房结细胞中占主导地位的电压门控钙通道,影响心脏的起搏[23]。有研究[24]显示:CACNα1C 基因表 达的降低会导致心肌细胞重构及收缩能力的降低。电压门控T 型通道Cav3.1(α1G)Ca2+通道涉及多种生理功能[25],CACNα1G 是编码该通道的基因,该通道在起搏器细胞的自发活动中同样起重要作用,可影响心率,先天性心动过缓和心脏传导阻滞,均归因于Cav1.3 和Cav3.1 通道功能的丧失。本研究结果显示:与假手术组比较,SSS组小鼠窦房结组织中CACNα1C 和CACNα1G mRNA 和蛋白表达水平降低,SXSM组可以逆转这种改变,从而增强窦房结功能。
综上所述,参仙升脉口服液可以增强SSS小鼠心率,抑制窦房结纤维化发生,其机制可能与抑制ROS表达有关,其可进一步通过调节HCN4离子通道,增强SSS小鼠的窦房结功能。

