何首乌提取物对失重小鼠骨质疏松和骨髓间充质干细胞成骨分化的影响
刘轩辰, 帖晓瑛, 刘玉林, 王 宁
(1.空军军医大学唐都医院营养科,陕西 西安 710038;2.西安海棠职业技术学院医学技术学院,陕西 西安 710038;3.空军军医大学唐都医院骨科,陕西 西安 710038)
骨质疏松症(osteoporosis,OP)是一种异常的骨代谢性疾病,其主要特征是成骨细胞的骨形成和破骨细胞的骨吸收失衡,导致破骨细胞骨吸收能力强于成骨细胞的骨形成能力,进而导致骨质丢失以及骨量减少,形成OP[1]。在欧洲,超过2 000万女性和5 500万男性OP 患者,并且每年超过350万人遭受骨质疏松型骨折。在全球范围内,OP 相关并发症的治疗费用巨大,给社会和家庭带来了沉重的经济压力[2]。研究[3]显示:航天员由于长期处于失重环境,导致骨钙磷丢失、骨量和骨机械强度降低,使航天员出现类似于OP 的症状。随着中国载人航天的发展和中国太空站的建立及运行,越来越多的航天员长时间在太空失重环境中工作,因此探讨如何预防和治疗因失重导致的骨量丢失形成的OP 成为现阶段以及未来的研究重点。丝分裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路在调控细胞增殖和分化中发挥重要作用[4]。丝分裂原活化蛋白激酶激酶(MAP kinase kinase,MEK)/细胞外调节蛋白激酶(extracellular regulated protein kinase,ERK)作为MAPK 经典信号通路之一,在BMSCs 成骨分化代谢中扮演重要角色,激活Raf/MEK/ERK 能够促进骨重建和成骨分化[5]。因此,激活MEK/ERK 信号通路是促进BMSCs 向成骨细胞分化的关键之一。何首乌(polygonum multiflorum,PM)是一种传统中药,具有补益精血和固肾乌须作用[6]。近年来研究[7-10]显示:PM 提取物以及其主要成分二苯乙烯苷(stilbene glycoside,TSG)对多种疾病包括糖尿病和灰白发变黑等具有广泛的作用,同时可以促进骨形成,缓解骨丢失。但PM 能否缓解因失重导致的骨量丢失及其机制尚不清楚。本研究构建失重小鼠模型,给予失重小鼠PM 提取物进行治疗,采用微型计算机断层成像(micro-computer tomography,micro-CT)、免疫组织化学和Western blotting 等方法验证PM 对骨形成的促进作用,为PM 提取物在失重性OP 治疗中的应用提供依据。
1 材料与方法
1.1 实验动物和药物30只SPF级12周龄雄性C57BL/6 小鼠,动物生产许可证号:SCXK(陕)2019-001,体质量20~22 g,由空军军医大学实验动物中心提供。PM 的提取方法见参考文献[11-12]。
1.2 动物分组、造模和给药小鼠适应新的培养环境1周后,将小鼠随机分为对照组、失重组和失重+PM组,每组10只。对照组小鼠自由活动,失重组和失重+PM组小鼠采用尾悬吊28 d 的方法构建失重模型,构建失重模型方法依照文献[13] 报道的方法。失重+PM组小鼠以灌胃的形式给予200 mg·kg-1·d-1PM,连续给药30 d。
1.3 micro-CT 检测各组小鼠骨体积/组织体积比值、骨小梁数量和厚度以及骨小梁间隙采用1%戊巴比妥钠麻醉小鼠,将其固定于micro-CT分析仪上,分辨率为20 μm,扫描结束后进行图像重建,采用Inveon Research Workplace 2.2 软件分析各组小鼠骨体积/组织体积比值、骨小梁数量、骨小梁厚度和骨小梁间隙。
1.4 各组小鼠骨组织的收集和处理取各组小鼠双侧股骨和胫骨。4% 多聚甲醛固定3~6 d 后,10%EDTA 脱钙,每3~5 d 更换1次,脱钙约4周后,针头可以轻松扎透骨头表明脱钙完成。去除失重大鼠股骨两端,PBS 冲洗骨髓腔,离心,红细胞裂解液裂解,去除红细胞,离心,计数。取2只无菌流式管,标记为对照管和样品管。对照管中细胞数为1×106个,样品管中细胞数为1×107个。对照管中加入荧光素标记同型对照抗体作为同型对照。在样品管中加入PE 标记的小鼠单克隆抗体Integrin beta 1(ab218273)和FITC 标记的大鼠单克隆抗体Sca1/Ly6A/E(ab268016)抗体(美国Abcam 公司),混匀。4℃避光孵育30 min,1 000 r·min-1离心10 min,反复洗涤2次。弃上清,对照管中加入500 μL PBS 重悬。样品管中加入1 mL 培养基重悬,混匀。采用FACS-Aria 型流式细胞仪进行细胞分选。采用含有10% 胎牛血清(fetal bovine serum,FBS)的α-MEM 培养基,于37 °C、95% 湿度和5%CO2孵箱中培养分选后的骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)。
1.5 酒石酸酸性磷酸酶(tartrate acid phosphatase staining,TRAP)染色检测各组小鼠骨组织中BMSCs 数量、成骨细胞数量、脂肪细胞数量和破骨细胞数量4% 多聚甲醛固定骨组织切片30 s,去离子水清洗后等体积石榴石型碱溶液和亚硝酸盐溶液,混匀,室温静置1~2 min。染色杯中加入45 mL、37℃去离子水、1 mL 配制好的快速石榴石型碱溶液、0.5 mL Naphthol AS-BI phosphqte 溶液、2 mL 醋酸盐溶液和1 mL 酒石酸溶液。切片置入染色杯中,37℃避光孵育1 h。清洗切片,苏木精复染2 min。封片,采用显微镜统计每个视野中的破骨细胞数量,每组重复3次。免疫组织化学法检测各组小鼠骨组织中CD29、干细胞抗原1(stem cell antigen-1,Sca-1)和Ⅰ型胶原(collagenⅠ,Col-Ⅰ)蛋白表达水平。脱钙后的骨组织石蜡包埋,将蜡块固定于切片机中,调整切片厚度,切片,脱蜡,洗脱,3% H2O2水孵育10 min,PBS 洗涤3次,每次5 min,山羊血清封闭30 min,加一抗,4℃过夜。PBS 洗涤3次,每次5 min,二抗室温30 min。PBS 洗涤3次,每次5 min。加辣根酶标记链酶卵白素工作液,孵育30 min。PBS 缓冲液洗涤3次,每次5 min。DAB 显色,冲洗,苏木精复染,树胶封片。抗体采用兔多克隆抗体CD29(GTX128839,美国GeneTex 公司)、Sca-1(108103,美国Biolegend 公司)和鼠单克隆抗体Col-Ⅰ(ab6308)。镜下以被抗体标记的细胞数量作为该种细胞的数量,每组重复3次,取平均数。CD29 和Sca-1 阳性细胞为BMSCs、Col-Ⅰ阳性细胞为成骨细胞。
将细胞分为对照组(0 μ mol·L-1PM)、10 μmol·L-1PM组、20 μ mol·L-1PM组 和40 μmol·L-1PM组。为了验证MAPK 信号通路在PM 促进BMSCs 向成骨细胞分化中的作用,采用MEK 抑制剂PD98059(PD)探讨何首乌促进成骨分化的作用是否发生改变。PD 作用后再将细胞分为对照(0 μmol·L-1PD)组、1 μ mol·L-1PD组、10 μmol·L-1PD组和25 μmol·L-1PD组。
1.6 实时荧光定量PCR(Real-time fluorescence quantitative PCR,RT-qPCR)法检测各组BMSCs中成骨相关因子mRNA 表达水平将模板1 μL,上下游引物各1 μL、DEPC 水7 μL、Premix Taq 10 μL 混合。采用快速3 步法,扩增 条件: 变性95℃、5 min,变性95℃、30 s;退火65℃、30 s;延 伸72℃、40 s。以2-ΔΔCt法计算各组BMSCs 中RUNX 家族转录因子2(RUNX family transcription factor-2,Runx-2)、碱性磷酸酶(alkaline phosphatase,ALP)、Osterix、过氧化物酶体增殖物激活受体γ(peroxisome proliferators-activated receptor γ,PPARγ)mRNA 表达水平。引物序列见表1。

表1 引物序列Tab.1 Primer sequences
1.7 Western blotting 法检测各组BMSCs 中成骨相关蛋白和MEK/ERK 信号通路蛋白表达水平带胶玻璃板插入电泳槽,加入电泳缓冲液,上样。电压100 V,15 min 后调至120 V。PVDF 膜甲醇浸泡5~10 s,转膜缓冲液浸泡5~10 min。电压100 V、100 min。丽春红染色1~2 min,剪下目的条带。5% 脱脂牛奶室温封闭2 h。一抗4℃过夜孵育。二抗室温孵育2 h,PBST 清洗3次,每次10 min。化学发光仪发光检测各组细胞中Runx-2、ALP、Osterix、PPARγ、MEK、磷酸化MEK 1/2(phosphorylated MEK 1/2,p-MEK1/2)、ERK和磷酸化ERK1/2( phosphorylated ERK 1/2 ,p-ERK1/2)蛋白表达水平。采用Image J 软件扫描各蛋白条带灰度值,重复3次,取平均值。目的蛋白表达水平=目的蛋白条带灰度值/对照组蛋白条带灰度值。
1.8 统计学分析采用Graphpad Prism 6.0 统计软件进行统计学分析。各组大鼠骨体积/组织体积比值、骨小梁数量、骨小梁厚度、骨小梁间隙、BMSCs 数量、成骨细胞数量、脂肪细胞数量、破骨细胞数量、小鼠间充质干细胞中成骨相关因子Runx-2、ALP、Osterix、p-MEK1/2 和p-ERK1/2 mRNA 和蛋白表达水平均以xˉ±s表示,多组间多样本均数比较采用单因素方差分析,组间两两比较采用SNK-q检验。以P<0.05 为差异有统计学意义。
2 结 果
2.1 各组小鼠骨体积/组织体积比值、骨小梁数量、骨小梁厚度和骨小梁间隙与对照组比较,失重组小鼠骨体积/组织体积比值、骨小梁数量和骨小梁厚度明显降低(P<0.05),而骨小梁间隙增加(P<0.05)。与失重组比较,失重+PM组小鼠骨体积/组织体积比值、骨小梁数量和骨小梁厚度升高(P<0.05),骨小梁间隙降低(P<0.05)。见图1 和2。

图1 micro-CT 检测各组小鼠骨组织结构指标Fig.1 Construction indexes of bone tissue of mice in various groups detected by micro-CT
2.2 各组小鼠骨组织中BMSCs、成骨细胞、脂肪细胞和破骨细胞数量与对照组比较,失重组小鼠BMSCs 数量明显减少(P<0.05);与失重组比较,失重+PM组小鼠BMSCs 数量增加(P<0.05)。与对照组比较,失重组小鼠成骨细胞数量明显减少(P<0.05);与失重组比较,失重+PM组小鼠骨组织中成骨细胞数量明显增加(P<0.05)。与对照组比较,失重组小鼠脂肪细胞数量明显增加(P<0.05);与失重组比较,失重+PM组小鼠骨组织中脂肪细胞数量明显降低(P<0.05)。与对照组小鼠比较,失重组小鼠骨组织中破骨细胞数量明显增加(P<0.05);与失重组比较,失重+PM组小鼠破骨细胞数量明显降低(P<0.05)。见 图3~6。

图3 各组小鼠被标记的成骨细胞和BMSCs 形态表现(Bar= 20 μm)Fig.3 Morphology of labeled osteoblasts and BMSCs of mice in various groups (Bar= 20 μm)
2.3 各组BMSCs 中Runx-2、ALP 和Osterix 和PPARγ mRNA 及蛋白表达水平与对照组(0 μmol·L-1PM)比较,10、20 和40 μmol·L-1PM组BMSCs 中Runx-2、ALP 和Osterix mRNA和蛋白表达水平升高(P<0.05),PPARγ mRNA 和蛋白表达水平降低(P<0.05)。见图7。

图7 各组BMSCs 中Runx-2、ALP、Osterix 和PPARγ mRNA 和蛋白表达水平Fig.7 Expression levels of Runx-2,ALP,Osterix,and PPARγ mRNA and proteins in BMSCs in various groups

图2 各组小鼠骨体积分数(A)、骨小梁数量(B)、骨小梁厚度(C)和骨小梁间隙(D)Fig.2 Bone volume fraction(A),number of bone trabeculae(B),thickness of bone trabeculae(C),and trabecular space(D) of mice in various groups
2.4 各组BMSCs 中MEK/ERK 信号通路蛋白表达水平Western blotting 法检测结果显示:与对照组(0 μmol·L-1PM)比较,10 μmol·L-1PM组细胞中p-MEK1/2 和p-ERK1/2 蛋白表达水平升高(P<0.05);与10 μmol·L-1PM组比较,20 μmol·L-1PM组细胞中p-MEK1/2 和p-ERK1/2蛋白表达水平升高(P<0.05 或P<0.01);与20 μmol·L-1PM组比较,40 μmol·L-1PM组细胞中p-MEK1/2和p-ERK1/2 蛋白表达水平升高(P<0.05)。见图8。为了验证MAPK 信号通路在PM 促进间充质干细胞向成骨细胞分化中的作用,采用MEK 抑制剂PD98059(PD)探讨PM 促进成骨分化的作用是否发生改变。Western blotting 法检测结果显示:与对照组(0 μmol·L-1PD)比较,1 μmol·L-1PD组细胞中p-MEK1/2、p-ERK1/2、Runx-2 和Osterix蛋白表达水平降低(P<0.05);与1 μ mol·L-1PD组比较,10 μ mol·L-1PD组 细胞 中p-MEK1/2 、p-ERK1/2、Runx-2 和Osterix蛋白表达水平降低(P<0.05);与10 μmol·L-1PD组细 胞 比 较,25 μmol·L-1PD组细胞中p-MEK1/2、p-ERK1/2、Runx-2 和Osterix 蛋白表达水平降低(P<0.05)。见图9。
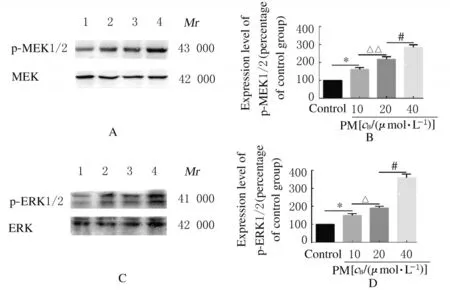
图8 各组细胞中p-MEK1/2 和p-ERK1/2 蛋白表达情况Fig.8 Expressions of p-MEK1/2 and p-ERK1/2 proteins in cells in various groups

图9 MEK 抑制剂PD 作用后各组BMSCs 中p-MEK1/2 和p-ERK1/2 蛋白表达情况Fig.9 Expression levels of p-MEK1/2 and p-ERK1/2 proteins in BMSCs in various groups after treated with MEK inhibitor PD
3 讨 论
OP 是一类以骨量降低和骨微结构破坏为特征的骨代谢性疾病[14]。老龄、失重、绝经和长久服用药物等均可导致OP 的发生[15-16]。本研究结果显示:与对照组比较,失重组小鼠骨体积/组织体积、骨小梁数量和厚度明显降低;而给予失重小鼠PM提取液治疗后,与失重组比较,失重+PM组小鼠骨体积/组织体积比值、骨小梁数量和厚度明显升高,但其与对照组比较差异无统计学意义,说明PM 能够 缓解失重导致的骨量丢失。HAM 等[11]研究显示:PM 能够改善因糖尿病导致的骨量丢失,提高糖尿病小鼠的骨体积/组织体积比值和骨小梁数量和骨小梁厚度,血清检测发现PM 可以提高血清中胰岛素水平、骨钙素含量以及碱性磷酸酶浓度,降低骨小梁表面积与骨小梁体积的比值。研究[11]显示:PM 提取物可以抑制破骨细胞的生成,从而缓解骨量丢失以及OP。PM 提取物能够缓解因使用糖皮质激素导致的OP。ZHOU 等[17]研究显示:强的松能够降低骨密度、骨体积/组织体积以及骨小梁厚度,不仅如此,强的松能够降低大鼠胫骨肌肉质量。不同浓度PM 提取物能显著改善大鼠的骨量,缓解强的松的不良反应。HWANG[12]等研究显示:给予OVX 小鼠PM 提取物治疗6周后,能够降低OVX 小鼠的体质量和器官质量,提高骨质量,改善骨形态计量学参数,降低骨量丢失。不仅如此,PM 提取物能够缓解卵巢切除小鼠的骨量丢失,促进绝经小鼠干细胞成骨分化,提高骨量[12]。除此之外,PM 提取物能够促进灰白发转变为黑发,增强骨骼强壮,改善心血管疾病[18]。同时,PM 提取物能够改善因肥胖导致的高血糖和高胰岛素血症[19]。研究[17]显示:给予类风湿性关节炎患者糖皮质激素治疗,能够抑制其成骨细胞的分化,抑制骨形成,从而导致OP,但配合使用PM则能够改善糖皮质激素导致的骨生长缓慢。

图4 各组小鼠被标记的成骨细胞和BMSCs 数量Fig.4 Numbers of labeled osteoblasts and BMSCs of mice in various groups

图5 各组小鼠被标记的脂肪细胞和破骨细胞形态表现(Bar= 20 μm)Fig.5 Morphology of labeled adipocytes and osteoclasts of mice in various groups (Bar= 20 μm)

图6 各组小鼠被标记的破骨细胞(A)和脂肪细胞(B)数量Fig.6 Numbers of labeled osteoclasts(A) and adipocytes(B) of mice in various groups
本实验采用免疫组织化学法检测BMSCs 和成骨细胞的结果显示:与对照组比较,失重减少小鼠骨表面BMSCs 和成骨细胞的数量,从而导致失重小鼠骨量降低。给予失重小鼠PM 提取物治疗后发现:失重小鼠BMSCs 和成骨细胞的数量明显升高,与失重组小鼠比较差异有统计学意义。失重导致骨量降低的原因可能是其减少了BMSCs 和成骨细胞的数量,从而降低骨量,而PM 提取物能够逆转因失重导致的成骨细胞数量降低,从而促进骨形成以及骨量增加。Western blotting 法检测结果显示:PM 提取物能够促进失重小鼠来源的BMSCs 向成骨细胞分化,使Runx-2 和Osterix 等成骨相关蛋白高表达。KIM 等[9]研究显示:PM 提取物能够促进SaOS-2 细胞向成骨细胞分化,同时提高细胞中Runx-2、ALP 和Osterix的表达水平。TSG是PM提取物中的主要成分,研究[20]显示:TSG 水平在1.56~25.00 mg·L-1能够提高BMSCs中ALP 活性,TSG 水平在6.25~25.00 mg·L-1时能够明显提高骨钙素水平。以上结果证实: PM 提取物和TSG 能够促进BMSCs 向成骨细胞分化以及成骨相关因子的表达。
Wnt/β-catenin 经典通路在BMSCs向成骨细胞分化过程中发挥重要角色[21-22]。ZHOU 等[17]提出:PM提取物能够激活BMSCs中Wnt/β-catenin信号通路,促进BMSCs向成骨细胞分化。MAPK 信号通路在细胞分化过程中发挥重要作用,其包含P38 MAPK 信号通路、JNK 信号通路和ERK 信号通路。本研究结果显示:PM 提取物能够提高MEK磷酸化和ERK 磷酸化水平,激活MEK/ERK 信号通路,提高成骨相关因子的表达,从而促进失重小鼠BMSCs 向成骨细胞分化。给予BMSCs MEK 抑制剂PD 后,BMSCs 中MEK 和ERK 的磷酸化水平明显降低,同时Runx-2 和Osterix 蛋白表达水平也明显降低。上述结果提示:PM 通过激活ERK 信号通路,从而促进BMSCs 成骨分化,促进骨形成,缓解失重导致的OP。
综上所述,PM 提取物可明显改善因失重导致的骨量丢失,其机制可能与激活MEK/ERK 信号通路和促进BMSCs 向成骨细胞分化有关。

