黄芪多糖对野百合碱诱导的肺动脉高压大鼠肺动脉血管的保护作用及其机制
李 聪, 赵 坤, 张景良, 张英杰, 王洪新
(1.锦州医科大学辽宁省心脑血管药物研究重点实验室,辽宁 锦州 121001;2.锦州医科大学附属第一医院心血管内科,辽宁 锦州 121000)
肺动脉高压(pulmonary arteries hypertension ,PAH)是一种以肺动脉重塑为特征的临床综合征,可导致肺血管阻力增加和右心室功能障碍,最终导致死亡[1-2]。到目前为止,PAH 的具体发病机制尚不清楚,但是肺血管内皮的损伤和功能障碍在疾病的进展中起关键作用[3]。炎症小体由NOD 样受体家族蛋白 3(NOD-like receptor protein 3,NLRP3)、凋亡相关斑点样蛋白(apoptosisassociated speck-like protein,ASC)和半胱氨酸天冬氨酸蛋白酶 1(cysteinyl aspartate specific proteinase 1,Caspase-1)组成,其激活炎症因子白细胞介素1β(interleukin-1β,IL-1β)和白细胞介素18(interleukin-18,IL-18),参与机体的炎症反应[4-5]。PASQUA 等[6]研究显示:NLRP3炎症小体参与PAH 的进展。钙蛋白酶(Calpain)是钙依赖性非溶酶体的中性半胱氨酸内肽酶家族,其参与多种生理过程,包括神经系统疾病、心血管疾病和癌症,Calpain 在动脉粥样硬化和炎症过程中发挥重要作用,而钙蛋白酶1(Calpain-1)和钙蛋白酶2(Calpain-2)是2个主要 的Calpain[7-8]。YU 等[9]研究显示:Calpian-1 对NLRP3 炎症小体的激活起一定作用。因此Calpian-1 可能是调控PAH 肺动脉血管炎症机制的重要靶点。
黄芪 多糖(astragalus polysaccharides,APS)是一种中草药,是从黄芪中提取的主要活性成分,APS 具有许多潜在的作用,如抗氧化、抗高血压、免疫调节和减轻动脉炎症[10-11]。研究[12-13]显示:在ATP 刺激下,炎症细胞Calpain 被激活从而促进IL-18 的分泌,并且Calpain 具有激活NLRP3 炎症小体的作用。目前尚无关于野百合碱(monocrotaline,MCT)诱导的PAH 大鼠模型中APS 对Calpain-1 表达影响的相关报道。本研究建立MCT 诱导的大鼠PAH 模型,探讨APS 对PAH大鼠肺组织中Calpain-1 表达和NLRP3 炎症小体的影响。
1 材料与方法
1.1 实验动物、主要试剂和仪器60只健康雄性SD 大鼠,体质量180~200 g,4~6周龄,由锦州医科大学动物实验中心提供,动物使用许可证号:SYXK(辽)2019-007。APS(纯度75%)和组织总蛋白提取试剂购自南京建成生物工程研究所,MCT 和MCC950购自美国Sigma公司,Calpain-1、NLRP3、ASC 、Caspase-1、B细胞淋巴瘤2(B cell lymphoma-2,Bcl-2)、Bcl-2 相关X蛋白(Bcl-2 assaciated X protein,Bax)和半胱氨酸天冬氨酸蛋白酶 3(cysteinyl aspartate specific proteinase-3,Caspase-3)一抗购自武汉爱博泰克生物科技有限公司,β-actin 一抗、兔二抗和鼠二抗购自武汉三鹰生物技术有限公司,ELISA 试剂盒购自上海酶联生物科技有限公司,Calpain 活性检测试剂盒购自艾美捷科技有限公司,HE 染色试剂盒购自碧云天生物技术研究所,免疫组织化学试剂盒购自北京中衫金桥生物公司。低温高速离心机购自美国Thermo Fisher 公司,BL-420S 生物机能实验系统购自成都泰盟科技有限公司,凝胶成像仪和半干转印仪购自美国Bio-Rad 公司,Leica DMI 3000B 倒置显微镜购自德国Leica 公司。
1.2 PAH 大鼠模型的建立从60只SD 雄性大鼠中随机取10只正常大鼠作为对照组,剩余50只大鼠腹腔注射60 mg·kg-1MCT 诱导PAH,随后随机分为PAH组、Calpain-1 抑制组、NLRP3 抑制剂组、低剂量APS组(400 mg·kg-1APS)和高剂量APS组(800 mg·kg-1APS)。NLRP3 抑制剂组大鼠每周给予MCC 950(NLRP3 抑制剂)3 mg·kg-1,Calpain-1 抑制剂组大鼠每周给予MDL 28170(MCT 抑制剂)10 mg·kg-1,其余各组大鼠腹腔注射相同体积的生理盐水。各剂量APS组每天根据大鼠体质量灌胃相应剂量的黄芪多糖,其余各组大鼠给予相同容积的生理盐水灌胃,持续4周。喂养期间密切观察各组大鼠的健康状况。
1.3 各组大鼠一般状况观察观察各组大鼠的进食情况、毛发情况、呼吸情况和死亡情况,并及时解剖大鼠,分析大鼠死因。
1.4 各组大鼠右心室收缩压(right ventricular systolic pressure,RVSP)和右心室肥厚指数(right ventricular hypertrophy index,RVHI)的测定各组大鼠饲养4周后,记录大鼠体质量。采用戊巴比妥钠(40 mg·kg-1)进行腹腔注射麻醉,经颈行正中切口,找到右颈外静脉并分离出,采用经颈静脉右心导管插管的方法检测RVSP,完成记录后,立即处死大鼠取出心脏,剪去心房和心耳,分别称量右心室(right ventricular,RV)、左心室(left ventricular,LV)和室间隔(interventricular septum,IVS)的质量,采用滤纸吸干血液后称质量,RVHI=RV 质量/(LV 质量+IVS 质量)。
1.5 各组大鼠血清IL-1β 和IL-18 水平检测各组大鼠心脏取血,4℃静置0.5 h,3 000 r·min-1离心15 min,提取上清,冻存于-80℃条件下以待检测。根据ELISA 试剂盒说明书检测各组大鼠血清IL-1β 和IL-18水平。
1.6 各组大鼠肺组织病理形态表现和血管厚度测定取各组大鼠左肺组织,并置于4% 甲醛固定24h后梯度乙醇脱水,石蜡包埋,切片4 μm 进行HE 染色,封片后置于光镜下观察各组大鼠肺组织病理形态表现。采用Image Pro Plus 5.1 软件测量各组大鼠肺动脉血管,测量血管壁直径(wall thickness,WT)、血管壁总直径(total thickness,TT)、血管壁面积(vessel wall area,WA)和血管总面积(vessel total area,TA)。根据公式计算:血管壁中层厚度占血管总直径的百分率(WT%)=(WT/TT)×100%,管壁面积占血管总面积的百分率(WA%)=(WA/TA)×100%。
1.7 免疫组织化学法检测各组大鼠肺小动脉组织中Calpian-1 的表达将肺组织切片预热二甲苯脱蜡,梯度乙醇脱水,抗原修复,3% 过氧化氢室温氧化15 min,PBS 缓冲液漂 洗3次,每次5 min,山羊血清常温封闭10 min 后滴加Calpain-1 一抗(1∶200),4℃过夜,PBS 缓冲液漂洗10 min,滴加二抗(1∶200)置于37℃放置1 h,PBS 缓冲液漂洗3次,每次5 min,DAB 显色1~2 min,苏木素复染,脱水,透明,封片,光学显微镜下观察出现棕褐色细颗粒为Calpain-1 阳性表达。采用Image-ProPlus 6.0 软件分析Calpain-1 的表达情况。
1.8 Western blotting 法检测各组大鼠肺组织中Bcl-2、Bax、Caspase-3、NLRP3、ASC、Caspase-1 和Calpain-1 蛋白表达水平取约100 mg 大鼠肺组织,加入RIPA 强裂解液后剪碎,超声粉碎30 s,4℃静置30 min,离心后提取上清,BCA分析法检测蛋白浓度。采用SDS-PAGE 凝胶电泳(上样蛋白量为50 μg),转膜后将PVDF 膜置于含5% 脱脂奶粉的TBST溶液封闭2h,分 别 加 入Calpain-1、NLRP3、Caspase-1、ASC、Caspase-3、Bax、Bcl-2和β-actin 抗体(1∶1 000),4℃孵育过夜,TBST洗膜3次(每次15 min)后加入二抗,室温孵育1 h,TBST 洗膜3次(每次15 min),ECL 显色液显影,分析蛋白条带灰度值计算目的蛋白表达水平。以目的蛋白条带灰度值与内参β-actin 条带灰度值比值表示目的蛋白表达水平。
1.9 各组大鼠肺组织中Calpain 活性的检测按照Calpain 活性检测试剂盒中说明书中的相应步骤操作上样,水浴锅37℃恒温孵育1h后,在400 nm/505 nm 的激发波长条件下检测Calpain 的荧光强度。Calpain 活性=测试组Calpain 的荧光强度/阴性对照组Calpain 的荧光强度。
1.10 统计学分析采用SPSS 13.0 统计软件进行统计学分析。各组小鼠RVSP 和RVHI,血清IL-1β和IL-18 水平,肺小动脉的WT% 和WA%,肺组织中Bcl-2、Bax、Caspase-3、NLRP3、ASC、Caspase-1 和Calpain-1 蛋白表达水平以及Calpain 活性均符合正态分布,以±s 表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用LSD-t检验。以P<0.05 为差异有统计学意义。
2 结 果
2.1 各组大鼠一般状况腹腔注射MCT 后第15天,PAH组、低和高剂量APS组、Calpain-1 抑制剂组及NLRP3 抑制剂组大鼠逐渐出现明显的呼吸困难,毛发粗糙,活动减少,体质量增加缓慢,症状逐渐加重,在注射MCT 后28 d 时造模成功。对照组大鼠情况正常,全程无死亡,其余各组均出现死亡大鼠,PAH组大鼠在注射MCT 后第17天出现死亡,共死亡4只大鼠;高剂量APS组大鼠于注射MCT 后第20天出现死亡,共死亡2只大鼠;低剂量APS组大鼠于注射MCT 后第18天出现死亡,共死亡3只大鼠;Calpain-1 抑制剂组大鼠于注射MCT 后第19天出现死亡,共死亡2只大鼠;NLRP3 抑制剂组大鼠于注射MCT 后第18天出现死亡,共死亡3只大鼠。解剖死亡大鼠发现其胸腔有大量积液,肺组织呈淤血状。
2.2 各组大鼠RVSP 和RVHI与对照组比较,PAH组大鼠RVSP 和RVHI 明显升高(P<0.05);与PAH组比较,低和高剂量APS组大鼠RVSP 和RVHI 明显降低(P<0.05),相关症状得到改善。见表1。
表1 各组大鼠RVSP 和RVHITab.1 RVSP and RVHI of rats in various groups(±s)

表1 各组大鼠RVSP 和RVHITab.1 RVSP and RVHI of rats in various groups(±s)
*P<0.05 compared with control group;△P<0.05 compared with PAH group.
Group Control PAH Calpain-1 inhibitor NLRP3 inhibitor APS Low dose High dose n 6 7 7 7 7 8 RVSP(P/mmHg)13.1±0.55 28.9±1.35*20.2±0.37△18.3±1.02△21.2±0.15△17.9±0.75△RVHI 0.21±0.02 0.53±0.03*0.38±0.01△0.31±0.02△0.41±0.01△0.32±0.02△
2.3 各组大鼠肺动脉血管病理形态表现和肺小动脉的WT%及WA%与对照组比较,PAH组大鼠肺组织小动脉管壁增厚明显,管腔面积小,血管平滑肌细胞增生明显,内皮细胞坏死、脱落,肺血管及其周围肺组织可见明显的炎性细胞浸润;与PAH组比较,低和高剂量APS组大鼠肺小动脉周围的炎性细胞浸润程度降低,血管壁增生程度也有所降低,而高剂量APS组大鼠减轻肺小动脉增厚更为明显。见图1。与对照组比较,PAH组大鼠WT% 和WA%明显升高(P<0.05);与PAH组比较,低和高剂量APS组大鼠WT%和WA%明显降低(P<0.05)。见表2。

图1 各组大鼠肺动脉血管病理形态表现(HE,×200)Fig.1 Pathomorphology of pulmonary artery of rats in various groups(HE,×200)
表2 各组大鼠肺小动脉WT%和WA%Tab.2 WT% and WA% of pulmonary artery of rats in various groups (n=6,±s,η/%)

表2 各组大鼠肺小动脉WT%和WA%Tab.2 WT% and WA% of pulmonary artery of rats in various groups (n=6,±s,η/%)
*P<0.05 compared with control group;△P<0.05 compared with PAH group.
Group Control PAH Calpain-1 inhibitor NLRP3 inhibitor APS Low dose High dose WT%18.32±1.56 55.15±2.23*36.34±2.41△25.45±2.65△34.98±2.12△26.96±2.24△WA%22.45±1.67 60.45±3.32*41.34±2.34△28.46±2.56△42.78±2.78△33.12±1.23△
2.4 各组大鼠肺组织中Bcl-2、Bax 和Caspase-3 蛋白表达水平与对照组比较,PAH组大鼠肺组织中Bax 和Caspase-3 蛋白表达水平明显升高,Bcl-2蛋白表达水平明显降低(P<0.05);与PAH组比较,低和高剂量APS组大鼠肺组织中Bax 和Caspase-3蛋白表达水平明显降低(P<0.05),Bcl-2 蛋白表达水平明显升高(P<0.05)。见图2 和表3。
表3 各组大鼠肺组织中Bax、Bcl-2 和Caspase-3 蛋白表达水平Tab.3 Expression levels of Bax, Bcl-2, and Caspase-3 proteins in lung tissue of rats in various groups (n=6,±s)

表3 各组大鼠肺组织中Bax、Bcl-2 和Caspase-3 蛋白表达水平Tab.3 Expression levels of Bax, Bcl-2, and Caspase-3 proteins in lung tissue of rats in various groups (n=6,±s)
*P<0.05 compared with control group;△P<0.05 compared with PAH group.
Group Control PAH Calpain-1 inhibitor NLRP3inhibitor APS Low dose High dose Bcl-2 0.78±0.05 0.37±0.03*0.57±0.04△0.62±0.03△0.63±0.03△0.71±0.05△Bax 0.38±0.04 0.84±0.05*0.67±0.04△0.58±0.03△0.62±0.05△0.54±0.04△Caspase-3 0.31±0.06 0.88±0.08*0.53±0.05△0.44±0.04△0.58±0.03△0.49±0.03△
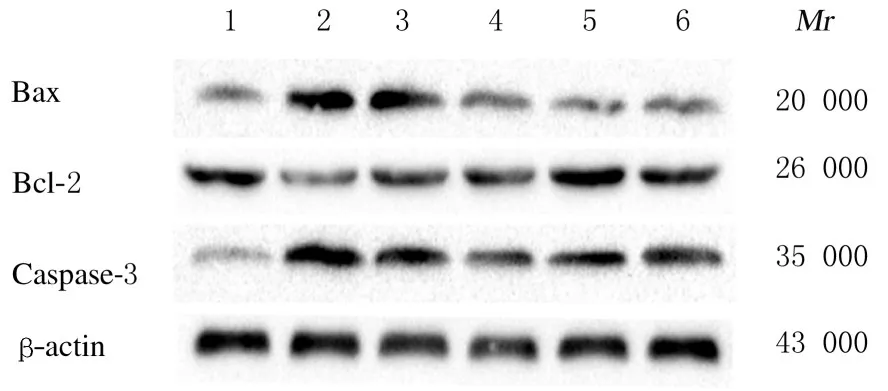
图2 各组大鼠肺组织中Bax、Bcl-2 和Caspase-3 蛋白表达电泳图Fig.2 Electrophoregram of expressions of Bax,Bcl-2,and Caspase-3 proteins in lung tissue of rats in various groups
2.5 各组大鼠肺组织中NLRP3、ASC 和Caspase-1蛋白表达水平与对照组比较,PAH组大鼠肺组织中NLRP3、ASC 和Caspase-1 蛋白表达水平明显升高(P<0.05);与PAH组比较,低和高剂量APS组、Calpain-1 抑制剂组和NLRP3 抑制剂组大鼠肺组织中NLRP3、Caspase-1 及ASC 蛋白表达水平明显降低(P<0.05),高剂量APS组大鼠肺组织中NLRP3、Caspase-1 和ASC 蛋白表达水平降低更为显著(P<0.05)。见图3 和表4。
表4 各组大鼠肺组织中NLRP3、ASC 和Caspase-1 蛋白表达水平Tab.4 Expression levels of NLRP3, ASC, and Caspase-1 proteins in lung tissue of rats in various groups (n=6,±s)

表4 各组大鼠肺组织中NLRP3、ASC 和Caspase-1 蛋白表达水平Tab.4 Expression levels of NLRP3, ASC, and Caspase-1 proteins in lung tissue of rats in various groups (n=6,±s)
*P<0.05 compared with control group;△P<0.05 compared with PAH group.
Group Control PAH Calpain-1 inhibitor NLRP3 inhibitor APS Low dose High dose NLRP3 0.39±0.05 0.82±0.06*0.59±0.06△0.48±0.04△0.58±0.05△0.53±0.02△ASC 0.31±0.04 0.87±0.04*0.54±0.04△0.43±0.02△0.68±0.05△0.61±0.02△Caspase-1 0.39±0.04 0.92±0.06*0.62±0.06△0.48±0.03△0.63±0.03△0.44±0.04△
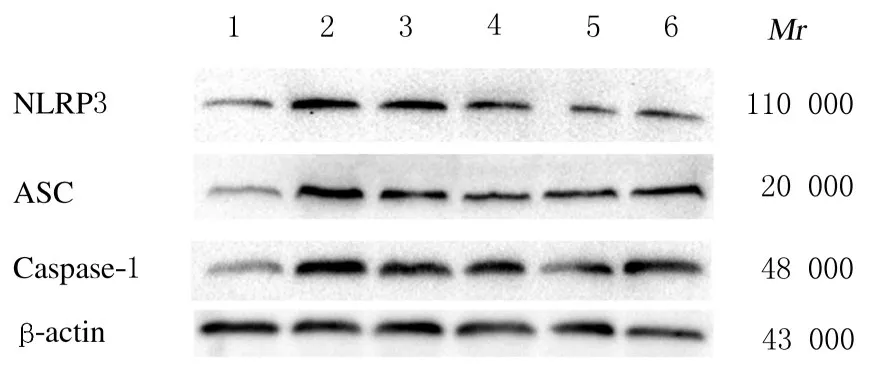
图3 各组大鼠肺组织中NLRP3、ASC 和Caspase-1 蛋白表达电泳图Fig.3 Electrophoregram of expressions of NLRP3,ASC, and Caspase-1 proteins in lung tissue of rats in various groups
2.6 各组大鼠血清IL-1β 和IL-18 水平与对照组比较,PAH组大鼠血清IL-1β和IL-18水平升高(P<0.05),表明炎性细胞因子增加;与PAH组比较,低和高剂量APS组大鼠血清中IL-1β 和IL-18水平降低(P<0.05),高剂量APS组IL-1β、IL-18 水平降低更为明显(P<0.05)。见表5。
表5 各组大鼠血清IL-1β 和IL-18 水平Tab.5 Levels of IL-1β and IL-18 in serum of rats in various groups [n=6,±s,ρβ/(μg·L-1)]
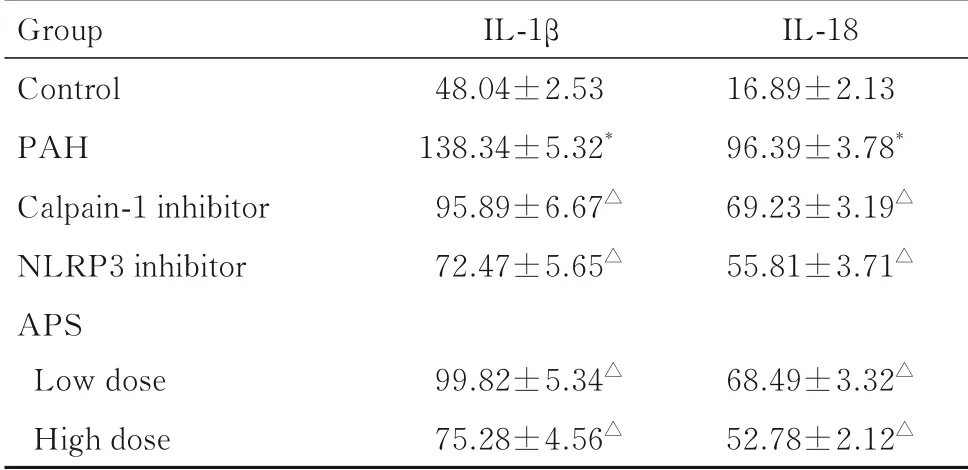
表5 各组大鼠血清IL-1β 和IL-18 水平Tab.5 Levels of IL-1β and IL-18 in serum of rats in various groups [n=6,±s,ρβ/(μg·L-1)]
*P<0.05 compared with control group;△P<0.05 compared with PAH group.
Group Control PAH Calpain-1 inhibitor NLRP3 inhibitor APS Low dose High dose IL-1β 48.04±2.53 138.34±5.32*95.89±6.67△72.47±5.65△99.82±5.34△75.28±4.56△IL-18 16.89±2.13 96.39±3.78*69.23±3.19△55.81±3.71△68.49±3.32△52.78±2.12△
2.7 各组大鼠肺组织中Calpain-1 蛋白表达水平和Calpain 活性免疫组织化学检测,与对照组比较,PAH组大鼠肺组织中Calpain-1 蛋白表达量增加;与PAH组比较,低和高剂量APS组及Calpain-1 抑制剂组大鼠肺组织中Calpain-1 蛋白表达量降低。见图4。与对照组比较,PAH组大鼠肺组织中Calpain-1 蛋白表达水平升高,Calpain 活性升高(P<0.05);与PAH组比较,NLRP3 抑制剂组大鼠肺组织中Calpain-1 蛋白表达水平差异无统计学意义(P>0.05),说明该抑制剂对Calpain-1 蛋白表达无作用;低和高剂量APS组大鼠肺组织中Calpain-1 蛋白表达水平降低(P<0.05),Calpain活性降低(P<0.05),高剂量APS组降低更明显。见图5、表6 和图6。
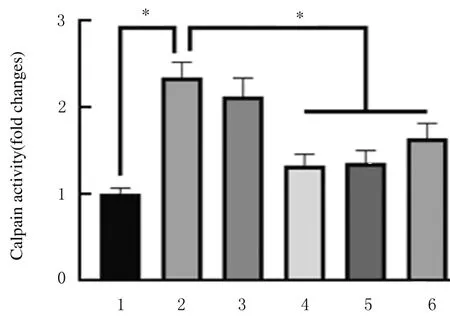
图6 各组大鼠肺组织中Calpain 活性Fig.6 Calpain activities in lung tissue of rats in various groups
表6 各组大鼠肺组织中Calpain-1 蛋白表达水平Tab.6 Expression levels of Calpain-1 protein in lung tissue of rats in various groups (n=6,±s)

表6 各组大鼠肺组织中Calpain-1 蛋白表达水平Tab.6 Expression levels of Calpain-1 protein in lung tissue of rats in various groups (n=6,±s)
*P<0.05 compared with control group;△P<0.05 compared with PAH group.
Group Control PAH NLRP3 inhibitor Calpain-1 inhibitor APS Low dose High dose Calpain-1 protein 0.29±0.08 0.74±0.04*0.69±0.06 0.42±0.11△0.48±0.07△0.38±0.05△

图5 各组大鼠肺组织中Calpain-1 蛋白表达电泳图Fig.5 Electrophoregram of expressions of Calpain-1 protein in lung tissue of rats in various groups
3 讨 论
PAH 是一种复杂的进行性疾病,由多种遗传和致病原因引起,其增加肺血管阻力和右心室后负荷,从而导致右心室功能障碍和衰竭[2]。PAH 患者血管系统重塑的特征包括弹性近端肺动脉僵硬增加、肌肉动脉内膜和(或)内侧层增厚和血管闭塞性病变的发展[1,14]。MCT 一直被广泛应用于PAH大鼠的动物模型制备,MCT 是一种大环吡咯烷核生物碱,该生物碱被吸收至肝脏中通过细胞色素P-450代谢转化为MCT 吡咯入血,其破坏内皮细胞的细胞内膜和膜蛋白,使促进血管舒张的一氧化氮合成减少,导致内皮屏障紊乱,加速了免疫细胞的聚集,加快了血管中的促炎反应[15-16]。本研究结果显示:与PAH组比较,低和高剂量APS组大鼠RVSP、RVHI、WA%及WT%降低,低和高剂量APS组大鼠肺组织中炎性细胞浸润减少,肺动脉血管阻塞和增厚情况改善,说明APS 可以改善肺动脉增厚和阻塞相关指标。
发生PAH 时,NLRP3 炎症小体活化,并促使pro-Caspase-1 活化为Caspase-1,而Caspase-1 促进IL-1β 和IL-18 的表达水平升高,加快炎症反应,同时Caspase-1 的表达上调触发细胞凋亡,进一步导致 血管内皮功能紊乱[17-18]。本研究结果 显示: 与PAH组比较,NLRP3 抑制剂组大鼠肺组织中NLRP3、ASC 和Caspase-1 蛋白表达水平降低且血清IL-1β 和IL-18 水平降低,低和高剂量APS组大鼠肺组织中NLRP3、ASC 和Caspase-1 蛋白表达水平降低且血清IL-1β 和IL-18 水平降低。上述结果提示:APS 有助于改善PAH 大鼠肺动脉血管的炎症。与PAH组比较,APS组大鼠肺组织中Caspase-3 和Bax 蛋白表达水平降低,Bcl-2 蛋白表达水平升高,提示APS 对NLRP3 炎症小体诱导的细胞凋亡有一定的改善作用。
Calpain-1 是钙离子(Ca2+)活化的半胱氨酸蛋白酶家族中的一员,位于细胞质和线粒体中,参与多种细胞过程,包括细胞骨架/膜附着的重塑,不同的信号传导途径和细胞凋亡,以及心肌缺血和冠状动脉粥样硬化等各种心脑血管疾病[19-21]。本研究结果显示:由MCT 诱导的PAH 与NLRP3 炎症小体和Calpain-1 的表达水平升高有关。本研究结果显示:与PAH组比较,各剂量APS组大鼠肺组织中Calpain-1 蛋白表达水平降低和Calpain 活性降低,从而使肺动脉中的血管增厚程度和阻塞程度有所改善。有研究[22]已经证实Calpain-1 蛋白表达与血清IL-18 和IL-1β 水平呈正相关关系。本研究结果显示:抑制Calpain-1 表达的同时,NLRP3 炎症小体的表达也减少,肺组织中相关炎症因子表达水平降低,这说明Calpain-1/NLRP3 信号通路参与了MCT 诱导PAH 产生炎症因子的调节。
综上所述,APS 可减轻PAH 大鼠的肺动脉血管阻塞程度,其作用机制与抑制Calpain-1 介导的NLRP3 活化诱导的炎症有关。Calpain-1 可能是APS 改善PAH 病情进展潜在的新的作用靶点。

