黄芪甲苷对miRNA-1 过表达诱导大鼠心力衰竭的保护作用及其机制
黄 悦, 王秋宁, 杨雪峰, 陶贵周
(1.锦州医科大学附属第一医院心内科,辽宁 锦州 121000;2.锦州医科大学基础医学院生理实验室,辽宁 锦州 121000);
心力衰竭(heart failure,HF)是各种心血管疾病发展的终末阶段[1]。HF 是全球范围内心血管疾病患者死亡的主要原因之一[2]。随着我国人口老龄化加剧,HF 的患病率持续升高,然而目前并无十分有效控制HF 症状的治疗方法[3],寻找新的治疗靶点和药物非常重要。微小RNA(microRNA,miRNA)是调节内源性基因的一类短链非编码小RNA,通过与目的基因的mRNA 3′端非翻译区互补配对,形成RNA 沉默,在目的基因转录后负性调节其表达水平,从而调控机体各种生理病理过程[4]。miRNA-1 具有肌细胞特异性,且是心脏组织中表达丰度最高的miRNA,占心肌组织总miRNA的40%。miRNA-1 在HF[2]、心肌肥厚[5]和心肌梗死[6]等许多心血管疾病中表达异常。过表达的miRNA-1 可以引起小鼠心室重构,损伤心脏的收缩和舒张功能,导致HF[7]。研究[8]证实:下调miRNA-1 表达具有心脏保护作用。目前,miRNA-1已被认为是心血管疾病新的治疗靶点。
黄芪甲苷(astragaloside Ⅳ,ASⅣ)是中药黄芪的主要活性成分之一,具有抗炎[9]、抗氧化[10]、抗细胞凋亡[11]和调节代谢[12]等多种药理作用,尤其是在心血管方面具有广泛的临床应用潜力。目前本课题组[13]已经明确ASⅣ对HF具有保护作用,但ASⅣ能否通过调节miRNA-1 表达来治疗HF 目前尚未见报道。本研究探讨ASⅣ对HF 的改善作用,为临床上应用ASⅣ防治心血管疾病提供依据。
1 材料与方法
1.1 实验动物、细胞、主要试剂和仪器32只SD大鼠,7~8周龄,健康雄性,体质量(240±20)g,购自锦州医科大学实验动物中心,动物生产许可证号:SCXK(辽)2016-0004。实验前适应性饲养1周,实验期间自由摄食和饮水。大鼠H9C2 心肌细胞购自上海名劲生物科技有限公司。ASⅣ(纯度≥98%)购自南京景竹生物科技有限公司,miRNA-1 mimics 购自上海吉凯基因科技有限公司,DMEM 培养基购自美国Gibco 公司,胎牛血清购自德国PAN-Biotech 公司,钙测试盒购自南京建成生物有限公司,实时荧光定量PCR(Realtime fluorescence quantitative PCR,RT-qPCR)测定试剂盒购自南京Vazyme 公司,钙离子/钙调蛋白依赖性蛋白激酶Ⅱ(calcium/calmodulin dependent protein kinaseⅡ,CaMKⅡ)和兰尼碱受体2(ryanodine receptor type 2,RyR2)单克隆抗体购自武汉ABclonal 公司,山羊抗兔IgG购自武汉Elabscience 公司。DP-50Vet 动物心脏超声检测仪器购自中国Mindray 公司,HERAcell150i CO2培养箱购自美国Thermo Scientific 公司,SW-CJ-1FD 超净工作台购自苏州安泰空气技术有限公司,StepOnePlus RT-qPCR 仪购自美国Applied Biosystems 公司,OPTIMA S/N 413-3921 酶标分析仪购自德国Bmg Labtech 公司。
1.2 实验分组和模型建立将32只SD 大鼠随机分为正常对照组、miRNA-1 mimics 阴性病毒对照(miRNA-1 mimics NC)组、miRNA-1 mimics组和ASⅣ+miRNA-1 mimics组,每组8只。正常对照组、miRNA-1 mimics NC组和miRNA-1 mimics组大鼠给予0.9% 生理盐水灌胃,ASⅣ+ miRNA-1 mimics组大鼠给予80 mg·kg-1ASⅣ灌胃,连续1周。灌胃结束后造模。采用10%水合氯醛[0.4 mL·(100g)-1] 对大鼠进行腹腔注射麻醉,大鼠仰卧伸展四肢并固定,在大鼠左侧第3~4 根胸骨处剪开1个小口暴露心脏。在左心室壁上取3个点注射miRNA-1 慢病毒溶液,总剂量为10 μL(1×107mL-1),然后快速缝合和消毒。之后连续3 d 腹腔注射8万单位青霉素钠。ASⅣ+miRNA-1 mimics组大鼠继续80 mg·kg-1ASⅣ灌胃,连续2周,RT-qPCR 法结果显示miRNA-1 过表达视为转染成功,超声结果显示左心室射血分数(ejection fraction,EF)和左心室短轴缩短率(fraction shortening,FS)明显降低视为模型建立成功。
将H9C2 心肌细胞置于含10% 胎牛血清的DMEM 培养基中,于37℃、5% CO2培养箱中培养,当细胞铺满培养皿80% 时,采用0.25% 胰酶消化传代。将H9C2 心肌细胞(8×104mL-1)和2 mL 常规培养基分别置入4只干净的25 cm2培养瓶中,分为正常对照组、miRNA-1 mimics阴性病毒对照(miRNA-1 mimics NC)组、miRNA-1 mimics组 和ASⅣ+miRNA-1 mimics组;20h后,ASⅣ+miRNA-1 mimics组心肌H9C2细胞加入ASⅣ溶液(10 μmol·L-1,ASⅣ溶于二甲基亚砜(dimethyl sulfoxide,DMSO)预保护心肌 细胞;4h后,弃掉4组H9C2 心肌细胞的常规培养基,正常对照组H9C2 心肌细胞中加入新鲜常规培养基,miRNA-1 mimics NC组H9C2 心肌细胞中加入含有miRNA-1 mimics 阴性慢病毒的感染复数(multiplicity of infection,MOI)为3 的无血清培养基(含1% 青霉素/链霉素),miRNA-1 mimics组和ASⅣ+ miRNA-1 mimics组心肌H9C2 细胞加入含有miRNA-1 mimics 慢病毒(MOI 为3)的无血清培养基(含1% 青霉素/链霉素),ASⅣ组H9C2心肌细胞再加入ASⅣ;8h后,弃掉4组心肌H9C2细胞的常规培养基,加入新鲜常规培养基;72h后,收取细胞样品。以RT-qPCR 法结果显示miRNA-1 过表达视为转染成功。
1.3 RT-qPCR 法检测各组大鼠心肌组织和H9C2心肌细胞中miRNA-1 表达水平按照试剂盒说明书提取各组大鼠心肌组织和H9C2 心肌细胞总RNA,逆转录生成cDNA 后进行RT-qPCR 检测,引物序列见表1。设置反应条件:95℃预变性1 min;95℃变性10 s,60℃退火30 s,72℃延伸30 s,40个循环,采用2-ΔΔCt法计算miRNA-1表达水平。

表1 miRNA-1 引物序列Tab.1 Primer sequences of miRNA-1
1.4 超声心动图检测各组大鼠EF 和FS采用10% 水合氯醛腹腔注射进行麻醉后,将大鼠四肢伸展仰卧固定,暴露前胸。采用脱毛工具将大鼠左侧胸毛去除干净,并均匀涂上超声耦合剂。将超声探头置于大鼠左心室长轴切面,显示左心室长轴二维超声心动图,引出M 型曲线并进行测量,每组取3个连续心动周期测量的平均值。检测各组大鼠EF 和FS。
1.5 MTT 法筛选ASⅣ的最适给药浓度和细胞存活率取对数生长期的H9C2 心肌细胞,以5×104mL-1密度接种于96 孔板,按照分组进行药物和转染处理,其中ASⅣ+miRNA-1 mimics组H9C2心肌细胞分别采用4、6、8、10 和12 μmol·L-1ASⅣ预处理,弃去原培养基,加入10 %MTT 新鲜培养基,于培养箱中孵育4h后弃上清,加入150 μL DMSO 于细胞培养箱中继续孵育15 min,采用酶标仪在490 nm 波长处检测各孔吸光度(A)值,计算细胞存活率。细胞存活率=实验组A 值/正常对照组A 值×100 %。
1.6 各组H9C2 心肌细胞中Ca2+水平检测H9C2心肌细胞采用胰酶消化,培养液室温1 000 r·min-1,离心10 min,弃去上清。细胞沉淀中加入1 mL 等渗PBS 缓冲液混匀,室温1 000 r·min-1,离心10 min,弃去上清,重复1~2次。采用裂解液将细胞沉淀制成细胞匀浆。取10 μL 细胞匀浆,加入9 倍体积的去离子水,冰水浴匀浆,2 500 r·min-1离心10 min,取10 %匀浆上清液待测。按照钙测试盒说明书的分组采用酶标仪检测出各组细胞的A 值,计算细胞中Ca2+水平。细胞中Ca2+水平=(测定A值-空白A值)/(标准A值-空白A值)×标准品浓度/待测样本蛋白浓度。
1.7 RT-qPCR 法检测各组H9C2 心肌细胞中CaMKⅡ和RyR2 mRNA 表达水平H9C2 心肌细胞按照试剂盒说明书提取总RNA,逆转录生成cDNA后进行RT-qPCR检测,通过引物分析mRNA 表达水平。反应条件:95℃预变性1 min;95℃变性10 s,60℃退火30 s,72℃延伸30 s,40个循环,采用2-ΔΔCt法计算CaMKⅡ和RyR2 mRNA表达水平。CaMK Ⅱ和RyR2 引物序列见表2。
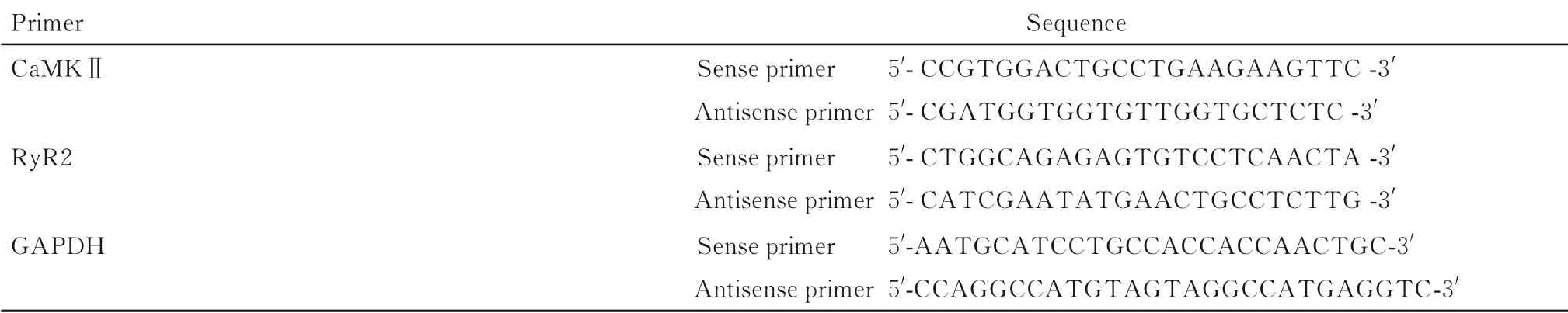
表2 CaMKⅡ和RyR2 引物序列Tab.2 Primer sequences of CaMKⅡand RyR2
1.8 Western blotting 法检测各组H9C2 心肌细胞中CaMKⅡ和RyR2 蛋白表达水平提取各组细胞总蛋白,采用BCA蛋白定量试剂盒检测细胞中蛋白表达水平。按照相应比例配好浓缩胶和分离胶然后上样,SDS-PAGE 电泳(80 V、10 min,120 V、80 min),湿转法(60 V、90 min)转至PVDF 膜上,PVDF 膜放置5 %脱脂奶粉封闭1 h,加入一抗CaMK Ⅱ(1∶3 000)、RyR2(1∶3 000)和GAPDH(1∶3 000),4℃孵育过夜;TBST 清洗PVDF膜3次,5 min,室温下二抗孵育1 h;采用ECL 对蛋白显色,Image Lab 进行显影和Image J进行灰度值分析。以GAPDH 作为内参蛋白,计算目的蛋白表达水平。目的蛋白表达水平=目的蛋白条带灰度值/GAPDH 条带灰度值。
1.9 统计学分析采用SPSS 13.0 统计软件进行统计学分析。各组大鼠心肌组织和H9C2 心肌细胞中miRNA-1 表达水平,各组大鼠EF和FS值,各组大鼠H9C2 心肌细胞存活率,各组大鼠H9C2 心肌细胞中miRNA-1 和Ca2+水平,各组大鼠H9C2心肌细胞中CaMKⅡ和RyR2 mRNA 及蛋白表达水平均符合正态分布,以±s 表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用LSD-t检验。以P<0.05 为差异有统计学意义。
2 结 果
2.1 各组大鼠心肌组织和H9C2 心肌细胞中miRNA-1 表达水平与miRNA-1 mimics NC组比较,miRNA-1 mimics组大鼠心肌组织和H9C2 心肌细胞中miRNA-1 表达水平明显升高(P<0.01);miRNA-1 mimics组大鼠心肌组织和心肌H9C2 细胞中miRNA-1 表达水平分别约是miRNA-1 mimicsNC组的6倍和82 倍;表明miRNA-1 mimics 过表达转染成功。与miRNA-1 mimics组比较,ASⅣ+miRNA-1 mimics组大鼠心肌组织和H9C2 心肌细胞中miRNA-1 表达水平明显降低(P<0.01)。见表3。
表3 各组大鼠心肌组织和H9C2 心肌细胞中miRNA-1 表达水平Fig.3 Expression levels of miRNA-1 in myocardium tissue and H9C2 cardiomyocytes of rats in various groups(n=4,±s)

表3 各组大鼠心肌组织和H9C2 心肌细胞中miRNA-1 表达水平Fig.3 Expression levels of miRNA-1 in myocardium tissue and H9C2 cardiomyocytes of rats in various groups(n=4,±s)
*P<0.01 compared with miRNA-1 mimics NC group;△P<0.01 compared with miRNA-1 mimics group.
Group Normal control miRNA-1 mimics NC miRNA-1 mimics ASⅣ+miRNA-1 mimics Expression level of miRNA-1 Myocardium tissue 1.00±0.00 0.95±0.28 5.81±0.48*2.95±0.69△H9C2 cells 1.00±0.00 7.08±1.12 82.51±4.14*20.38±1.53△
2.2 各组HF 大鼠左心室EF 和FS与miRNA-1 mimics NC组比较,miRNA-1 mimics组大鼠左心室EF和FS明显降低(P<0.01),表明大鼠HF建立成功;与miRNA-1 mimics组比较,AS Ⅳ+miRNA-1 mimics组大鼠左心室EF 和FS 明显升高(P<0.01)。见图1 和表4。

表4 各组大鼠左心室EF 和FSTab.4 EF and FS of left ventricle of rats in various groups(n=4,x±s,η/%)

图1 各组大鼠心功能超声心动图Fig.1 Echocardiography of cardac function of rats in various groups
2.3 各组大鼠H9C2心肌细胞存活率与miRNA-1 mimics NC组比较,miRNA-1 mimics组大鼠H9C2心肌细胞存活率明显降低(P<0.01)。与miRNA-1 mimics组比较,AS Ⅳ+ miRNA-1 mimics组大鼠H9C2心肌细胞存活率明显升高(P<0.01),10 μmol·L-1ASⅣ+ miRNA-1 mimics组大鼠H9C2心肌细胞存活率明显高于4、6、8 和12 μ mol·L-1AS Ⅳ+ miRNA-1 mimics组(P<0.01),因 此10 μmol·L-1ASⅣ为最适给药质量浓度。见图2。

图2 各组大鼠H9C2 心肌细胞存活率Fig.2 Survival rates of H9C2 cardiomyoctyes of rats in various groups
2.4 各组大鼠H9C2 心肌细胞中Ca2+水平与miRNA-1 mimics NC组比较,miRNA-1 mimics组大鼠H9C2 心肌细胞中Ca2+水平明显升高(P<0.01)。与miRNA-1 mimics组比较,AS Ⅳ+miRNA-1 mimics组大鼠H9C2心肌细胞中Ca2+水平明显降低(P<0.01)。见图3。

图3 各组大鼠心肌H9C2 细胞中Ca2+水平Fig.3 Expression levels of Ca2+in H9C2 cardiomyocytes of rats in various groups
2.5 各组大鼠H9C2 心肌细胞中CaMK Ⅱ和RyR2 mRNA 表达水平与miRNA-1 mimics NC组比较,miRNA-1 mimics组大鼠H9C2 心肌细胞中CaMK ⅡmRNA 表达水平明显升高(P<0.01),RyR2 mRNA 表达水平明显降低(P<0.01)。与miRNA-1 mimics组比较,ASⅣ+miRNA-1 mimics组大鼠H9C2 心肌细胞中CaMKⅡmRNA 表达水平明显降低(P<0.01),RyR2 mRNA 表达水平明显升高(P<0.01)。见图4。

图4 各组大鼠H9C2 心肌细胞中CaMKⅡ(A)和RyR2 (B)mRNA 表达水平Fig.4 Expression levels of CaMKⅡ(A) and RyR2(B) mRNA in H9C2 cardiomyocytes of rats in various groups
2.6 各组大鼠H9C2 心肌细胞中CaMKⅡ和RyR2蛋白表达水平与miRNA-1 mimics NC组比较,miRNA-1 mimics组大鼠H9C2 心肌细胞中CaMK Ⅱ蛋白表达水平明显升高(P<0.01),RyR2 蛋白表达水平明显降低(P<0.01)。与miRNA-1 mimics组比较,ASⅣ+miRNA-1 mimics组H9C2 心肌细胞中CaMKⅡ蛋白表达水平明显降低(P<0.01),RyR2 蛋白表达水平明显升高(P<0.01)。见 图5 和6。

图5 各组大鼠H9C2 心肌细胞中CaMKⅡ和RyR2 蛋白表达电泳图Fig.5 Electrophoregram of expressions of CaMK Ⅱand RyR2 proteins in H9C2 cardiomyocytes of rats in various groups
3 讨 论
HF 是心脏结构和(或)功能异常改变导致心室心肌收缩和舒张功能障碍的疾病。本实验通过对大鼠左心室转染miRNA-1 的方法建立大鼠HF 模型[14]。本研究结果显示:与miRNA-1 mimics NC组比较,miRNA-1 mimics组大鼠EF 和FS 明显降低,说明过表达的miRNA-1 能损伤大鼠左心室收缩功能,导致HF。这与ZHANG 等[14]研究结果一致,说明通过该方法建立HF 模型是可行的。
ASⅣ具有药效温和稳定、不易产生耐药性和药物不良反应较少等特点,临床上常被用于心血管疾病的治疗[15]。本研究结果显示: 与miRNA-1 mimics组 比 较,AS Ⅳ+miRNA-1 mimics组大鼠H9C2 心肌细胞中miRNA-1 表达水平明显降低,EF 和FS 明显升高,说明ASⅣ可改善HF 大鼠心脏功能和心肌损伤,其心脏保护作用的机制是通过下调miRNA-1 表达实现的。本研究结果为临床上应用ASⅣ防治心血管疾病的发生发展提供了实验依据并拓宽了思路。本课题组进一步探讨了ASⅣ保护心肌细胞对抗miRNA-1 过表达诱导的心肌细胞损伤的具体作用机制。

图6 各组大鼠H9C2 心肌细胞中CaMKⅡ(A) 和RyR2(B)蛋白表达水平Fig.6 Expression levels of CaMK Ⅱ(A) and RyR2(B) proteins in H9C2 cardiomyocytes of rats in various groups
HF 的发病机制十分复杂,涉及神经内分泌[16]、心肌细胞凋亡[17]和心肌细胞中Ca2+循环异常[18]等,特别是心肌细胞中Ca2+水平变化可直接引起心肌收缩和(或)舒张功能的异常。因此抑制心肌细胞中Ca2+超载对于保护心肌十分重要[19]。RyR2 和CaMK Ⅱ均是心肌细胞中重要的钙调蛋白[20]。RyR2是心肌肌质网(sarcoplasmic reticulum,SR)上广泛分布的调控Ca2+释放的核心通道;CaMKⅡ是细胞中Ca2+信号传导者,可以使底物磷酸化从而调节心肌细胞中Ca2+水平的变化[21]。研究[22]显示:CaMKⅡ可以介导RyR2 S2814 位点的磷酸化。蛋白磷酸酶2A(protein phosphatase 2A,PP2A)是丝氨酸苏氨酸磷酸化酶,可以调节RyR2在CaMK ⅡS2814位点的磷酸化状态[23]。ALI等[24]发现:PP2A 的调节亚基B56α 是miRNA-1的靶点。TERENTYEV 等[25]在miRNA-1过表达的大鼠心肌细胞中发现:miRNA-1 通过转录后水平抑制PP2A 调节亚基B56α 表达,增强RyR2 在CaMKⅡS2814 位点磷酸化,激活SR 上的RyR2 通道释放大量Ca2+,导致心肌细胞中Ca2+水平明显升高,诱导心脏电生理紊乱。CaMKⅡ抑制剂KN93 可以抑制miRNA-1 表达,逆转上述结果。由此可见,miRNA-1 可调控CaMKⅡ介导RyR2 的磷酸化。
本研究结果证实:miRNA-1 过表达可诱导心肌细胞中Ca2+超 载,与TERENTYEV 等[25]研究结果一致,且下调miRNA-1 表达可减轻心肌损伤[8]。本研究结果显示:与miRNA-1 mimics组比较,AS Ⅳ+miRNA-1 mimics组大鼠心肌细胞中miRNA-1 表达水平和胞浆中Ca2+水平明显降低,同时心肌细胞中CaMKⅡ蛋白表达水平明显降低,RyR2 蛋白表达水平明显升高,提示ASⅣ可有效抑制心肌细胞中miRNA-1 表达,并通过miRNA-1 调控CaMKⅡ介导RyR2 的磷酸化改善心肌细胞中钙超载造成的心肌损伤。
本研究在结果证实: AS Ⅳ可以通过抑制miRNA-1 表达改善HF 引起的心肌收缩功能障碍和心肌损伤,其机制可能是通过下调miRNA-1 来调控CaMKⅡ介导RyR2 的磷酸化,从而改善心肌细胞中Ca2+超载造成的心肌损伤。

